
反应实例 如果酯的α-碳上只有一个氢原子,由于酸性太弱,用乙醇钠难于形成负离子,需 要用较强的碱才能把酯变为负离子。如异丁酸乙酯在三苯甲基钠作用下,可以进行缩合,而 在乙醇钠作用下则不能发生反应: tO O CH3 2(CH CHCO2C2Hs (CHCNa+ (CH3)2CH-C-CCO2C2Hs (C 6H)3CF CH3 两种不同的酯也能发生酯缩合,理论上可得到四种不同的产物,称为混合酯缩合, 在制备上没有太大意义。如果其中一个酯分子中既无ā-氢原子,而且烷氧羰基又比较活泼 时,则仅生成一种缩合产物。如苯甲酸酯、甲酸酯、草酸酯、碳酸酯等。与其它含ā-氢原 子的酯反应时,都只生成一种缩合产物。 NaH H O CH3 CHsCO2CH3 CH 3CH2COC2H5 →C.H,C-CHC02c2H 56% HCOC,Hs+CH COCH CONH OHCCH 2CO2C2Hs 0 CHCHCOCH+ONCoHCHO:175C CO2C2Hs C.HsCH-CO2C2Hs 8085% CO2C2H5 实际上这个反应不限于酯类自身的缩合,酯与含活泼亚甲基的化合物都可以发生这 样的缩合反应,这个反应可以用下列通式表示: R-0-OC2Hs +-CH-R R=CO C2Hs R CN COR 13 Claisen-Schmidt反应 一个无α-氢原子的醛与一个带有-氢原子的脂肪族醛或酮在稀氢氧化钠水溶液或 醇溶液存在下发生缩合反应,并失水得到,B-不饱和醛或酮: NaOH水溶液 CHO CH:CHO CH=CH-CHO H20
反应实例 如果酯的 α-碳上只有一个氢原子,由于酸性太弱,用乙醇钠难于形成负离子,需 要用较强的碱才能把酯变为负离子。如异丁酸乙酯在三苯甲基钠作用下,可以进行缩合,而 在乙醇钠作用下则不能发生反应: 两种不同的酯也能发生酯缩合,理论上可得到四种不同的产物,称为混合酯缩合, 在制备上没有太大意义。如果其中一个酯分子中既无 α-氢原子,而且烷氧羰基又比较活泼 时,则仅生成一种缩合产物。如苯甲酸酯、甲酸酯、草酸酯、碳酸酯等。与其它含 α-氢原 子的酯反应时,都只生成一种缩合产物。 实际上这个反应不限于酯类自身的缩合,酯与含活泼亚甲基的化合物都可以发生这 样的缩合反应,这个反应可以用下列通式表示: 13 Claisen—Schmidt 反应 一个无−氢原子的醛与一个带有−氢原子的脂肪族醛或酮在稀氢氧化钠水溶液或 醇溶液存在下发生缩合反应,并失水得到−不饱和醛或酮:
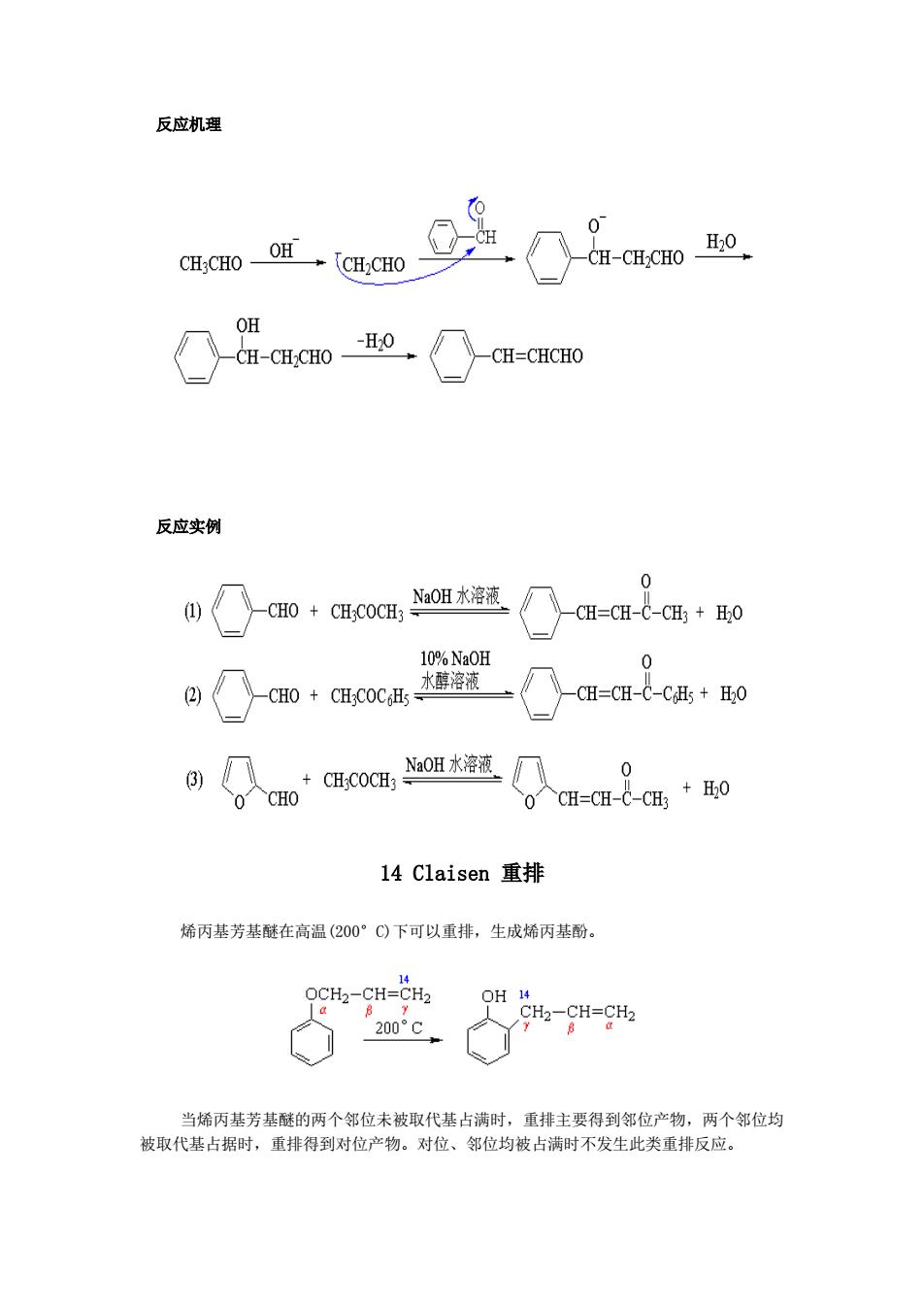
反应机理 0 H OH H20 CH:CHO CH2CHO CH-CH-CHO OH -H0 CH-CH2CHO CH-CHCHO 反应实例 0 NaOH水溶液 CHO CHCOCH: CH=CH-C-CH3 H20 10%NaOH 0 2 CHO CH COCHs 水醇溶液 CH=CH-C-CHs +20 NaOH水溶液 3) CH;COCH 0 + CHO 0 CH=CH-C-CH? +H0 14 Claisen 重排 烯丙基芳基醚在高温(200°C)下可以重排,生成烯丙基酚。 14 OCH2-CH=CH2 OH 14 CH2-CH=CH2 200°C B 当烯丙基芳基醚的两个邻位未被取代基占满时,重排主要得到邻位产物,两个邻位均 被取代基占据时,重排得到对位产物。对位、邻位均被占满时不发生此类重排反应
反应机理 反应实例 14 Claisen 重排 烯丙基芳基醚在高温(200°C)下可以重排,生成烯丙基酚。 当烯丙基芳基醚的两个邻位未被取代基占满时,重排主要得到邻位产物,两个邻位均 被取代基占据时,重排得到对位产物。对位、邻位均被占满时不发生此类重排反应
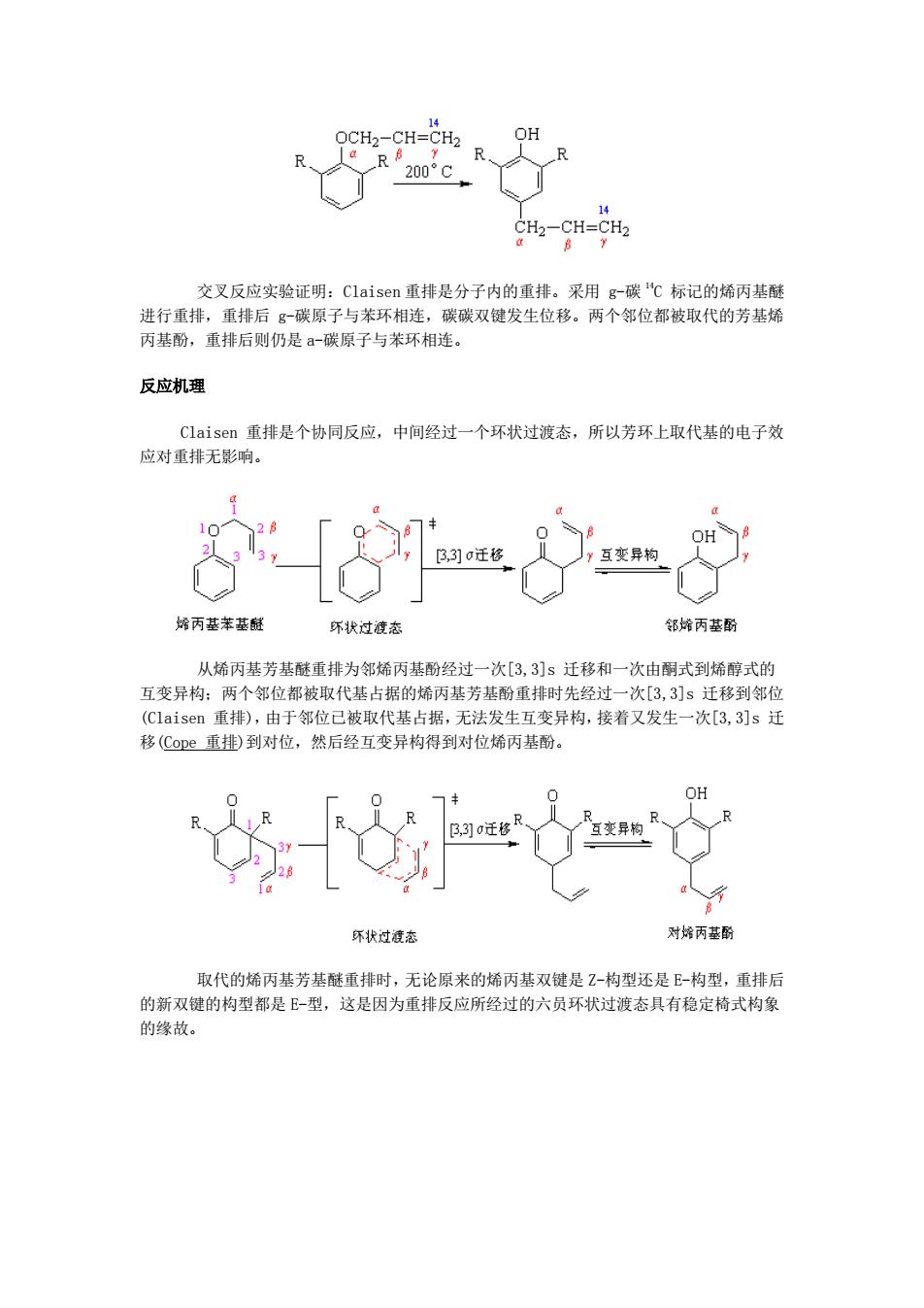
14 OCH2-CH=CH2 OH R 200°C CH2-CH=CH2 交叉反应实验证明:Claisen重排是分子内的重排。采用g-碳“℃标记的烯丙基醚 进行重排,重排后g-碳原子与苯环相连,碳碳双键发生位移。两个邻位都被取代的芳基烯 丙基酚,重排后则仍是a-碳原子与苯环相连。 反应机理 Claisen重排是个协同反应,中间经过一个环状过渡态,所以芳环上取代基的电子效 应对重排无影响。 ,3]迁移 互变异构 烯丙基苯基链 环状过渡态 邻烯丙基酚 从烯丙基芳基醚重排为邻烯丙基酚经过一次[3,3]s迁移和一次由酮式到烯醇式的 互变异构:两个邻位都被取代基占据的烯丙基芳基酚重排时先经过一次[3,3]s迁移到邻位 (Claisen重排),由于邻位已被取代基占据,无法发生互变异构,接着又发生一次[3,3]s迁 移(Coe重排)到对位,然后经互变异构得到对位烯丙基酚。 OH R R ,3]迁移 互变异构 尔状过渡态 对烯丙基酚 取代的烯丙基芳基醚重排时,无论原来的烯丙基双键是Z-构型还是E-构型,重排后 的新双键的构型都是E-型,这是因为重排反应所经过的六员环状过渡态具有稳定椅式构象 的缘故
交叉反应实验证明:Claisen 重排是分子内的重排。采用 g-碳 14C 标记的烯丙基醚 进行重排,重排后 g-碳原子与苯环相连,碳碳双键发生位移。两个邻位都被取代的芳基烯 丙基酚,重排后则仍是 a-碳原子与苯环相连。 反应机理 Claisen 重排是个协同反应,中间经过一个环状过渡态,所以芳环上取代基的电子效 应对重排无影响。 从烯丙基芳基醚重排为邻烯丙基酚经过一次[3,3]s 迁移和一次由酮式到烯醇式的 互变异构;两个邻位都被取代基占据的烯丙基芳基酚重排时先经过一次[3,3]s 迁移到邻位 (Claisen 重排),由于邻位已被取代基占据,无法发生互变异构,接着又发生一次[3,3]s 迁 移(Cope 重排)到对位,然后经互变异构得到对位烯丙基酚。 取代的烯丙基芳基醚重排时,无论原来的烯丙基双键是 Z-构型还是 E-构型,重排后 的新双键的构型都是 E-型,这是因为重排反应所经过的六员环状过渡态具有稳定椅式构象 的缘故
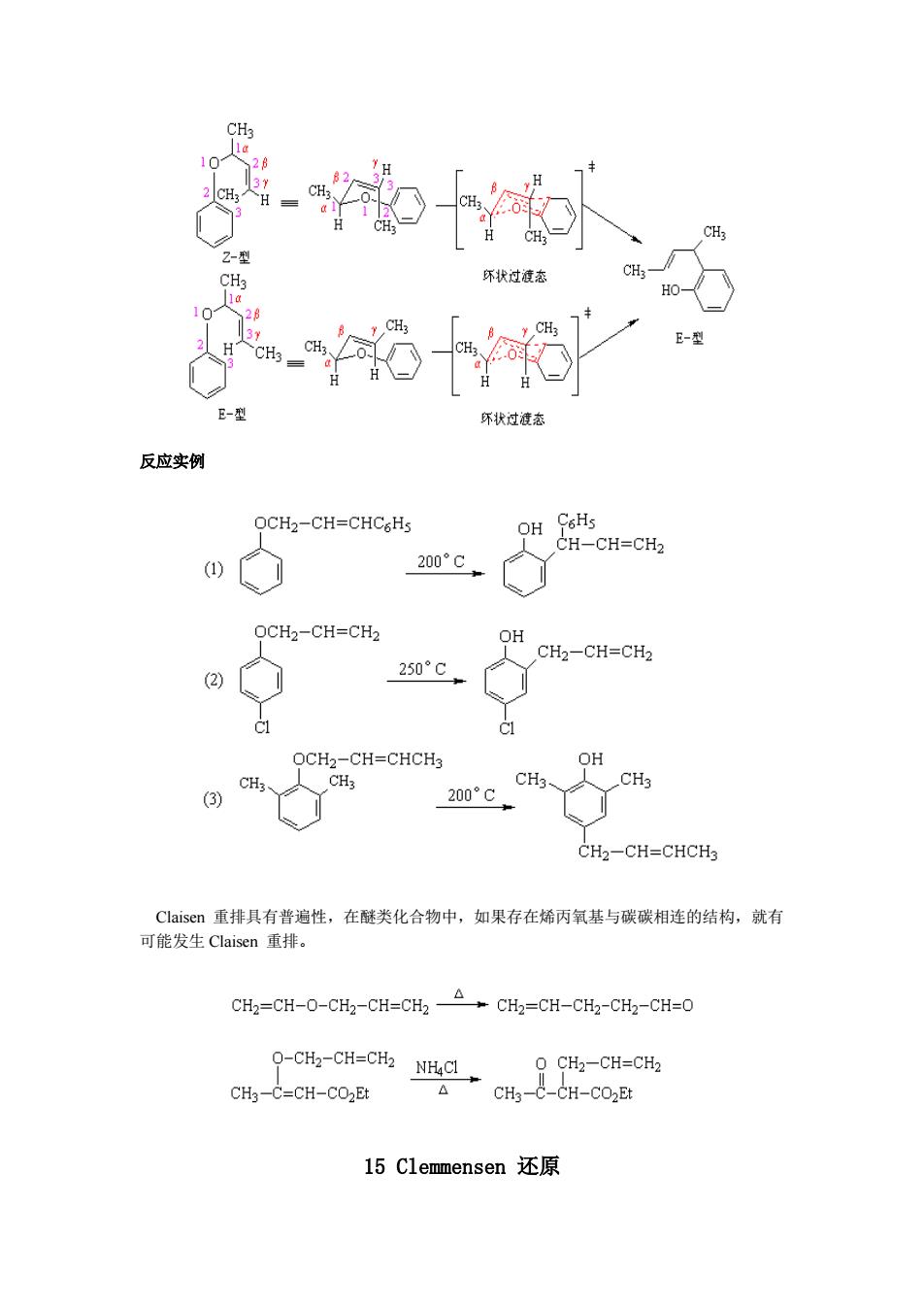
CH3 10 82 2 CH3 H CH; H CH3 2-型 CH3 坏状过渡态 HO 10 28 13Y CH: CH3、 E-型 CH3 E-型 尔状过渡态 反应实例 OCH2-CH=CHC6Hs OH C6Hs CH-CH=CH2 (1) 200°C OCH2-CH=CH2 OH CH2-CH=CH2 (2) 250°C OCH2-CH=CHCH3 OH CH3 CH3 CH3 CH3 (3) 200°C CH2-CH=CHCH3 Claisen重排具有普遍性,在醚类化合物中,如果存在烯丙氧基与碳碳相连的结构,就有 可能发生Claisen重排。 CH2=CH-O-CH2-CH=CH2 CH2=CH-CH2-CH2-CH=O O-CH2-CH=CH2 NH4C→ O CH2-CH=CH2 CH3-C=CH-CO2Et CH3-C-CH-CO2Et 15C1 emmensen还原
反应实例 Claisen 重排具有普遍性,在醚类化合物中,如果存在烯丙氧基与碳碳相连的结构,就有 可能发生 Claisen 重排。 15 Clemmensen 还原
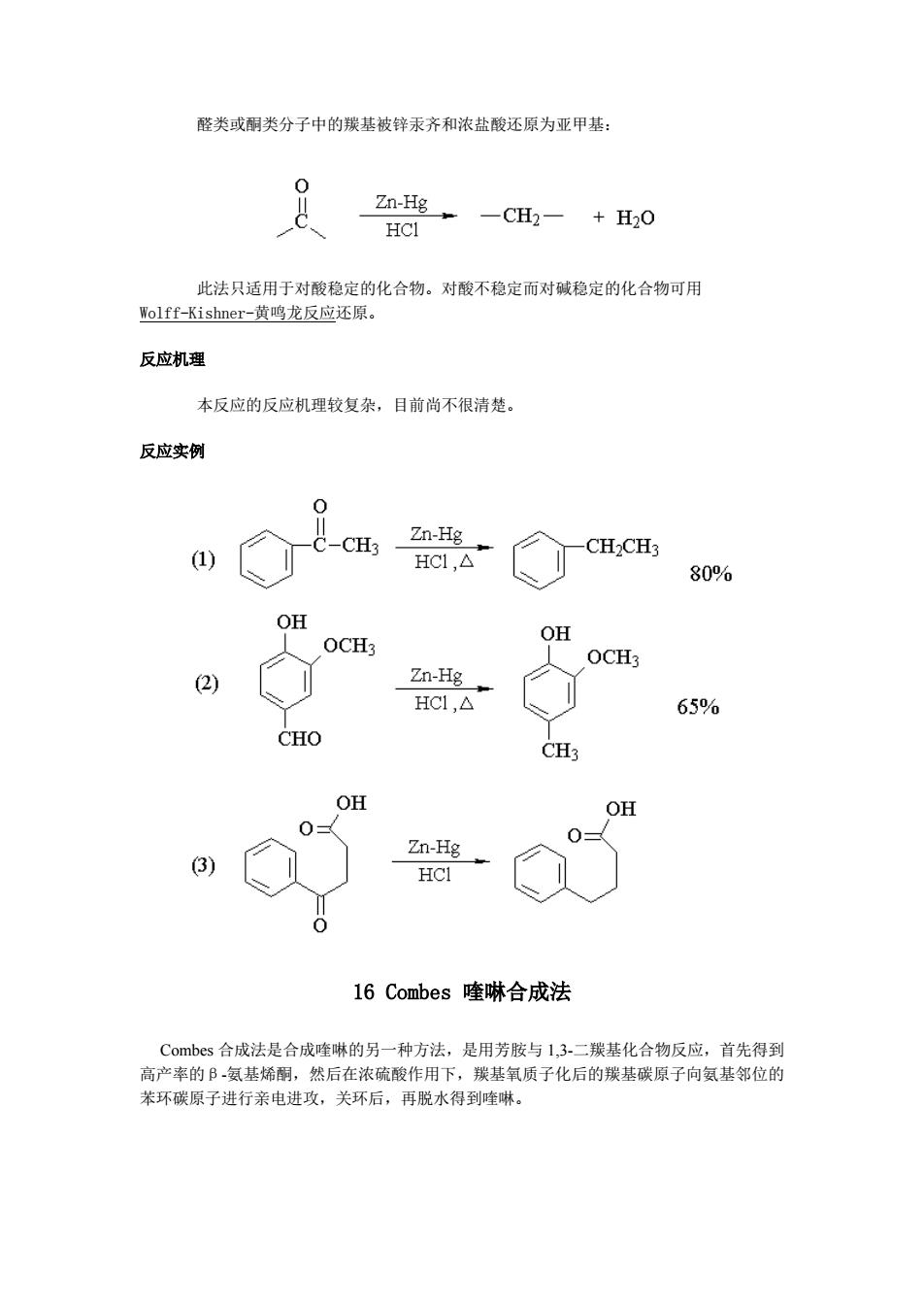
醛类或酮类分子中的羰基被锌汞齐和浓盐酸还原为亚甲基: Zn-Hg HCI 一CH2一+H20 此法只适用于对酸稳定的化合物。对酸不稳定而对碱稳定的化合物可用 Wolff-Kishner--黄鸣龙反应还原。 反应机理 本反应的反应机理较复杂,目前尚不很清楚。 反应实例 0 C-CH3 Zn-Hg (1) CH2CH3 HC1,△ 80% OH OCH3 OH OCH3 (2) Zn-Hg HC1,△ 65% CHO CH3 OH OH Zn-Hg 3) HCI 0 16 Combes喹啉合成法 Combes合成法是合成喹啉的另一种方法,是用芳胺与1,3-二羰基化合物反应,首先得到 高产率的B氨基烯酮,然后在浓硫酸作用下,羰基氧质子化后的羰基碳原子向氨基邻位的 苯环碳原子进行亲电进攻,关环后,再脱水得到喹啉
醛类或酮类分子中的羰基被锌汞齐和浓盐酸还原为亚甲基: 此法只适用于对酸稳定的化合物。对酸不稳定而对碱稳定的化合物可用 Wolff-Kishner-黄鸣龙反应还原。 反应机理 本反应的反应机理较复杂,目前尚不很清楚。 反应实例 16 Combes 喹啉合成法 Combes 合成法是合成喹啉的另一种方法,是用芳胺与 1,3-二羰基化合物反应,首先得到 高产率的β-氨基烯酮,然后在浓硫酸作用下,羰基氧质子化后的羰基碳原子向氨基邻位的 苯环碳原子进行亲电进攻,关环后,再脱水得到喹啉