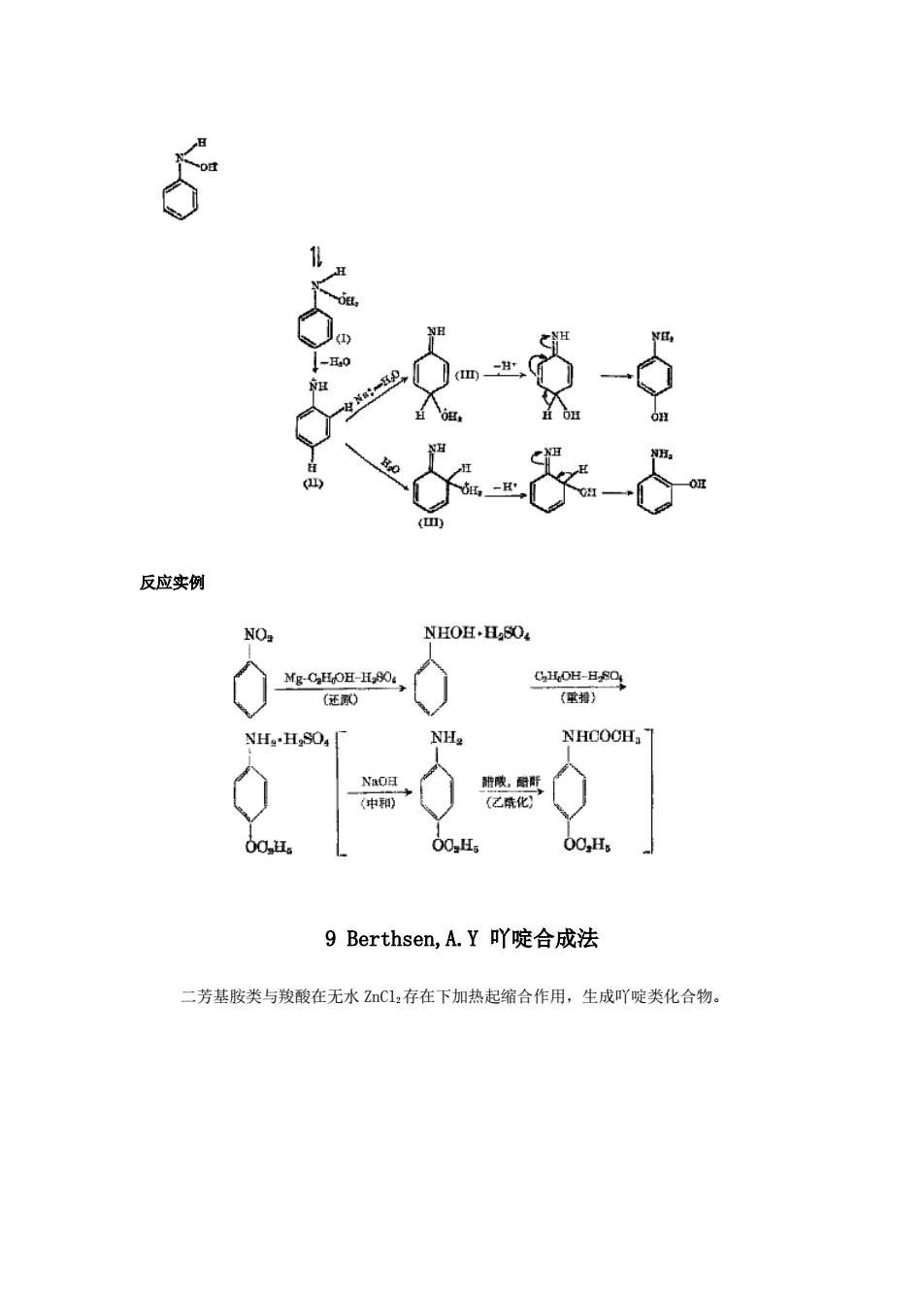
I) H40 (四 反应实例 NOz NHOH.H.SO Mg-CHOH-H.80 CHOH-HSOL (还弧0 (重拇) NH4-HgSO4「 NHa NHCOCH NaOH 醋膜,酚所 (中和) (乙疏化) 00H。 00,H5 00,Hs 9 Berthsen,A.Y吖啶合成法 二芳基胺类与羧酸在无水ZC12存在下加热起缩合作用,生成吖啶类化合物
反应实例 9 Berthsen,A.Y 吖啶合成法 二芳基胺类与羧酸在无水 ZnCl2存在下加热起缩合作用,生成吖啶类化合物
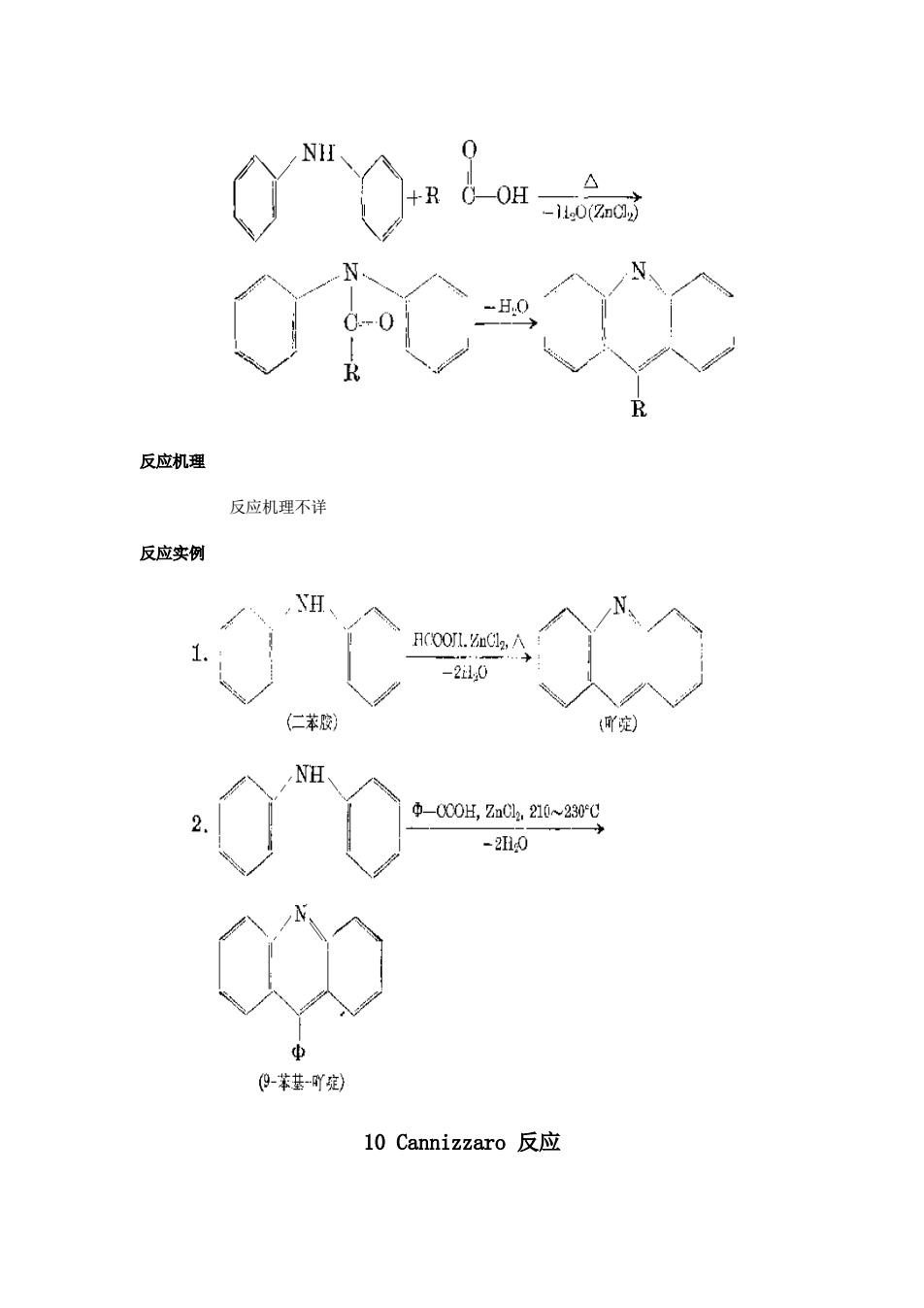
0 +R -10(aC,j -H0 R 反应机理 反应机理不详 反应实例 YH Hc00l.mCl2,八 -2i0 (仁苯胶 (吖) NH Φ-000H,ZaC02,210~230℃ -20 中 (0-苯基-吖) 10 Cannizzaro反应
反应机理 反应机理不详 反应实例 10 Cannizzaro 反应

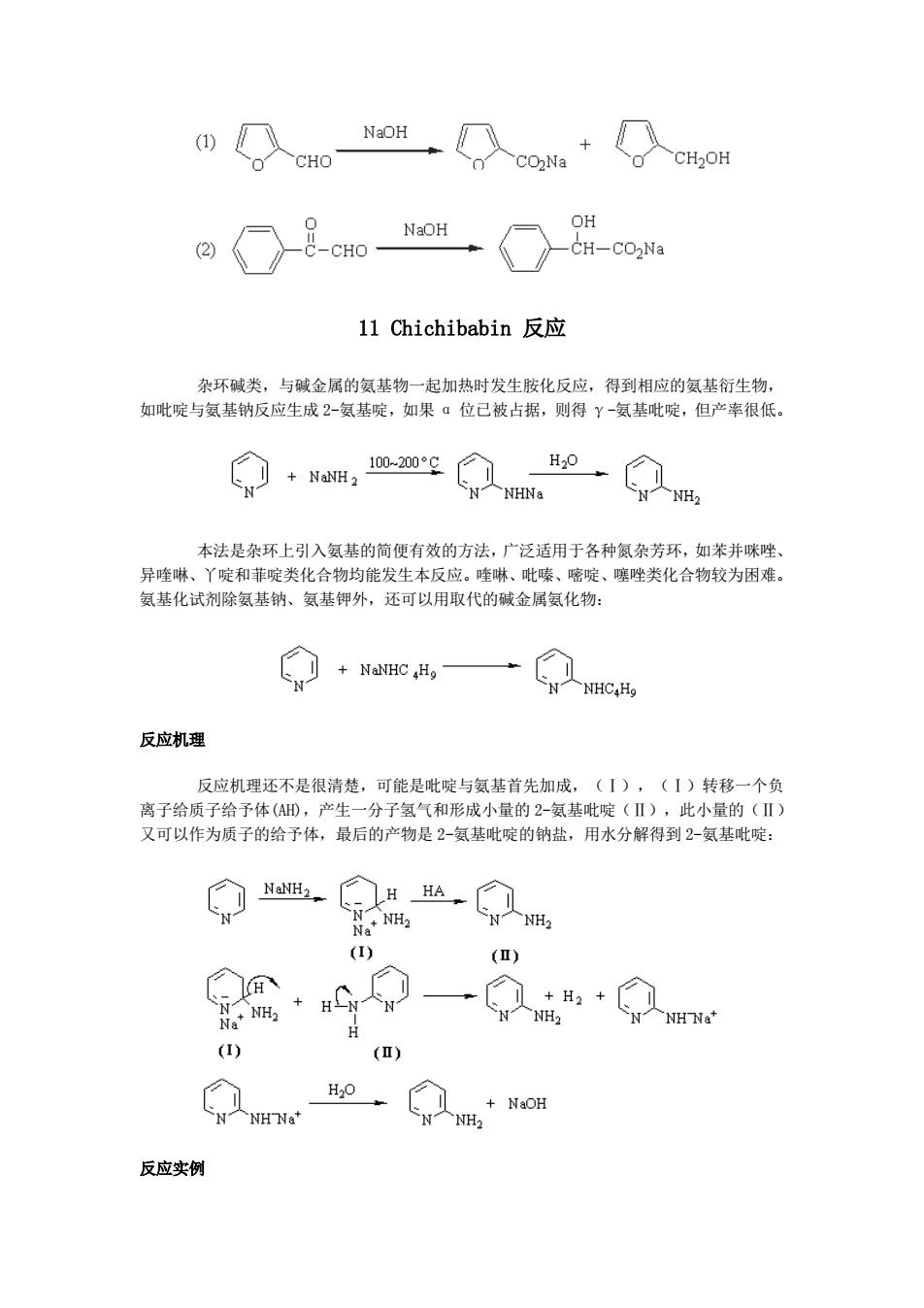
凡a位碳原子上无活泼氢的醛类和浓NaOH或KOH水或醇溶液作用时,不发生醇醛 缩合或树脂化作用而起歧化反应生成与醛相当的酸(成盐)及醇的混合物。此反应的特征是醛 自身同时发生氧化及还原作用,一分子被氧化成酸的盐,另一分子被还原成醇: NaOH CHO CH2OH NaOH HCHO CH3OH HCO 2 脂肪醛中,只有甲醛和与羰基相连的是一个叔碳原子的醛类,才会发生此反应,其 他醛类与强碱液,作用发生醇醛缩合或进一步变成树脂状物质。 HCHO +C HCHOH HCO2C HCHOH 具有ā-活泼氢原子的醛和甲醛首先发生羟醛缩合反应,得到无α-活泼氢原子的 B-羟基醛,然后再与甲醛进行交叉Cannizzaro反应,如乙醛和甲醛反应得到季戊四醇: 3HCHO CH CHOOH (HOCH23CCHO HCHO OH- -C(CH2OH)HCO2 反应机理 醛首先和氢氧根负离子进行亲核加成得到负离子,然后碳上的氢带着一对电子以氢 负离子的形式转移到另一分子的羰基不能碳原子上。 0 0 CoHs-C-H OH- C6Hs-C-H 02 CoHs-CH C6Hs OH C6HsCO2+CHsCH2OH 反应实例
凡 α 位碳原子上无活泼氢的醛类和浓 NaOH 或 KOH 水或醇溶液作用时,不发生醇醛 缩合或树脂化作用而起歧化反应生成与醛相当的酸(成盐)及醇的混合物。此反应的特征是醛 自身同时发生氧化及还原作用,一分子被氧化成酸的盐,另一分子被还原成醇: 脂肪醛中,只有甲醛和与羰基相连的是一个叔碳原子的醛类,才会发生此反应,其 他醛类与强碱液,作用发生醇醛缩合或进一步变成树脂状物质。 具有 α-活泼氢原子的醛和甲醛首先发生羟醛缩合反应,得到无 α-活泼氢原子的 β-羟基醛,然后再与甲醛进行交叉 Cannizzaro 反应,如乙醛和甲醛反应得到季戊四醇: 反应机理 醛首先和氢氧根负离子进行亲核加成得到负离子,然后碳上的氢带着一对电子以氢 负离子的形式转移到另一分子的羰基不能碳原子上。 反应实例
NaOH 1 CHO CONa CH2OH NaOH OH (2) CHO CH-CO2Na l1 Chichibabin反应 杂环碱类,与碱金属的氨基物一起加热时发生胺化反应,得到相应的氨基衍生物, 如吡啶与氨基钠反应生成2-氨基啶,如果ā位已被占据,则得Y-氨基吡啶,但产率很低。 100-200°C H20 NaNH2 NHNa NH2 本法是杂环上引入氨基的简便有效的方法,广泛适用于各种氮杂芳环,如苯并咪唑、 异喹啉、丫啶和菲啶类化合物均能发生本反应。喹啉、吡嗪、嘧啶、噻唑类化合物较为困难。 氨基化试剂除氨基钠、氨基钾外,还可以用取代的碱金属氨化物: 十 NaNHC Ho NHC Ho 反应机理 反应机理还不是很清楚,可能是吡啶与氨基首先加成,(I),(I)转移一个负 离子给质子给予体(AD,产生一分子氢气和形成小量的2-氨基吡啶(Ⅱ),此小量的(Ⅱ) 又可以作为质子的给予体,最后的产物是2-氨基吡啶的钠盐,用水分解得到2-氨基吡啶: NaNH2 H HA NH2 NH Na (I) (Ⅱ) +H2+ Na'NH2 N NH2 NH Na" (I) (Ⅱ) H20 +NaOH NH Na+ NNH2 反应实例
11 Chichibabin 反应 杂环碱类,与碱金属的氨基物一起加热时发生胺化反应,得到相应的氨基衍生物, 如吡啶与氨基钠反应生成 2-氨基啶,如果 α 位已被占据,则得 γ-氨基吡啶,但产率很低。 本法是杂环上引入氨基的简便有效的方法,广泛适用于各种氮杂芳环,如苯并咪唑、 异喹啉、丫啶和菲啶类化合物均能发生本反应。喹啉、吡嗪、嘧啶、噻唑类化合物较为困难。 氨基化试剂除氨基钠、氨基钾外,还可以用取代的碱金属氨化物: 反应机理 反应机理还不是很清楚,可能是吡啶与氨基首先加成,(Ⅰ),(Ⅰ)转移一个负 离子给质子给予体(AH),产生一分子氢气和形成小量的 2-氨基吡啶(Ⅱ),此小量的(Ⅱ) 又可以作为质子的给予体,最后的产物是 2-氨基吡啶的钠盐,用水分解得到 2-氨基吡啶: 反应实例

二甲苯 + NaNH2 100°C 40% NH2 吡啶类化合物不易进行硝化,用硝基还原法制备氨基吡啶甚为困难。本反应是在杂 环上引入氨基的简便有效的方法,广泛适用于各种氮杂芳环,如苯并咪唑、异喹啉、吖啶和 菲啶类化合物均能发生本反应。 12 Claisen酯缩合反应 含有ā-氢的酯在醇钠等碱性缩合剂作用下发生缩合作用,失去一分子醇得到B-酮酸酯。 如2分子乙酸乙酯在金属钠和少量乙醇作用下发生缩合得到乙酰乙酸乙酯。 2CH3CO2C2H5 C2H;ONa CH3COCH 2CO2C2H5 75% 二元羧酸酯的分子内酯缩合见Dieckmann缩合反应。 反应机理 乙酸乙酯的ā-氢酸性很弱(pK。-24.5),而乙醇钠又是一个相对较弱的碱(乙醇的 pK15.9),因此,乙酸乙酯与乙醇钠作用所形成的负离子在平衡体系是很少的。但由于最 后产物乙酰乙酸乙酯是一个比较强的酸,能与乙醇钠作用形成稳定的负离子,从而使平衡朝 产物方向移动。所以,尽管反应体系中的乙酸乙酯负离子浓度很低,但一形成后,就不断地 反应,结果反应还是可以顺利完成。 CH3CO2C2H5 CHsO CH2CO2C2H5 C2HsOH CH3-C-OC2Hs + CH3-C-OC2Hs CH2CO2CHs 0 CHs-8-CH.CO.CaHs +C2H50 O O CH3-C-CH2CO2C2Hs C2HsO CH-CHCO.C.Hs+CHOH H CH2-C-CH2CO2C2Hs 常用的碱性缩合剂除乙醇钠外,还有叔丁醇钾、叔丁醇钠、氢化钾、氢化钠、三苯甲 基钠、二异丙氨基锂(LDA)和Grignard试剂等
吡啶类化合物不易进行硝化,用硝基还原法制备氨基吡啶甚为困难。本反应是在杂 环上引入氨基的简便有效的方法,广泛适用于各种氮杂芳环,如苯并咪唑、异喹啉、吖啶和 菲啶类化合物均能发生本反应。 12 Claisen 酯缩合反应 含有 α-氢的酯在醇钠等碱性缩合剂作用下发生缩合作用,失去一分子醇得到 β-酮酸酯。 如 2 分子乙酸乙酯在金属钠和少量乙醇作用下发生缩合得到乙酰乙酸乙酯。 二元羧酸酯的分子内酯缩合见 Dieckmann 缩合反应。 反应机理 乙酸乙酯的 α-氢酸性很弱(pKa-24.5),而乙醇钠又是一个相对较弱的碱(乙醇的 pKa~15.9),因此,乙酸乙酯与乙醇钠作用所形成的负离子在平衡体系是很少的。但由于最 后产物乙酰乙酸乙酯是一个比较强的酸,能与乙醇钠作用形成稳定的负离子,从而使平衡朝 产物方向移动。所以,尽管反应体系中的乙酸乙酯负离子浓度很低,但一形成后,就不断地 反应,结果反应还是可以顺利完成。 常用的碱性缩合剂除乙醇钠外,还有叔丁醇钾、叔丁醇钠、氢化钾、氢化钠、三苯甲 基钠、二异丙氨基锂(LDA)和 Grignard 试剂等