
山东理工大客导电体SHANDONGUNIVERSITYOFTECHNOLOGY第二类导体又称离子导体,如电解质溶液、熔融电解质等第二类导体的特点是:A.正、负离子作反向移动而导电B.导电过程中有化学反应发生C.温度升高,电阻下降D.导电总量分别由正、负离子分担固体电解质,如AgBr、Pbl,等,也属于离子K导体,1但它导电的机理比较复杂,导电能力不高本章以讨论电解质水溶液为主
8 - 7 - *固体电解质,如 等,也属于离子 导体,但它导电的机理比较复杂,导电能力不高, 本章以讨论电解质水溶液为主。 AgBr PbI 、 2 第二类导体又称离子导体,如电解质溶液、熔 融电解质等 第二类导体的特点是: A. 正、负离子作反向移动而导电 B. 导电过程中有化学反应发生 C. 温度升高,电阻下降 D. 导电总量分别由正、负离子分担 导电体

山东理工大客电极:正极、负极SHANDONGUNIVERSITYOFTECHNOLOGY正极:电势高的极称为正极,电流从正极流向负极。负极:电势低的极称为负极,电子从负极流向正极。8
9 - 8 - 负极: 电势低的极称为负极,电子从负极流向正极。 正极: 电势高的极称为正极,电流从正极流向负极。 电极:正极、负极

山东理工大客电极:正极、负极SHANDONGUNIVERSITYOFTECHNOLOGY发生还原作用的极称为阴极。阴极:在原电池中,阴极是正极;在电解(Cathode)池中,阴极是负极理工发生氧化作用的极称为阳极,阳极:在原电池中,阳极是负极;在电解(Anode)池中,阳极是正极。9
10 - 9 - 阴极: 发生还原作用的极称为阴极。 (Cathode) 发生氧化作用的极称为阳极。 阳极: (Anode) 在原电池中,阴极是正极;在电解 池中,阴极是负极。 在原电池中,阳极是负极;在电解 池中,阳极是正极。 电极:正极、负极

山东理工大客电极:正极、负极SHANDONGUNIVERSITYOFTECHNOLOGY电极反应:电极上进行的有电子得失的化学反应阳极: H2 (g)→2H+(m)+ 2e阴极: Cl2 (g)+2e= →2Cl(m)电池反应:两个电极反应的总结果表示电池反应以上电极反应的总反应为:H2(g)+Cl2(g)→>2HC1(m
11 电极:正极、负极 电极反应:电极上进行的有电子得失的化学反应 阳极: H2 (g)→2H+ (m)+ 2e- 阴极: Cl2 (g)+2e - →2Cl- (m) 电池反应:两个电极反应的总结果表示电池反应 以上电极反应的总反应为: H2 (g)+Cl2 (g)→2HCl(m)
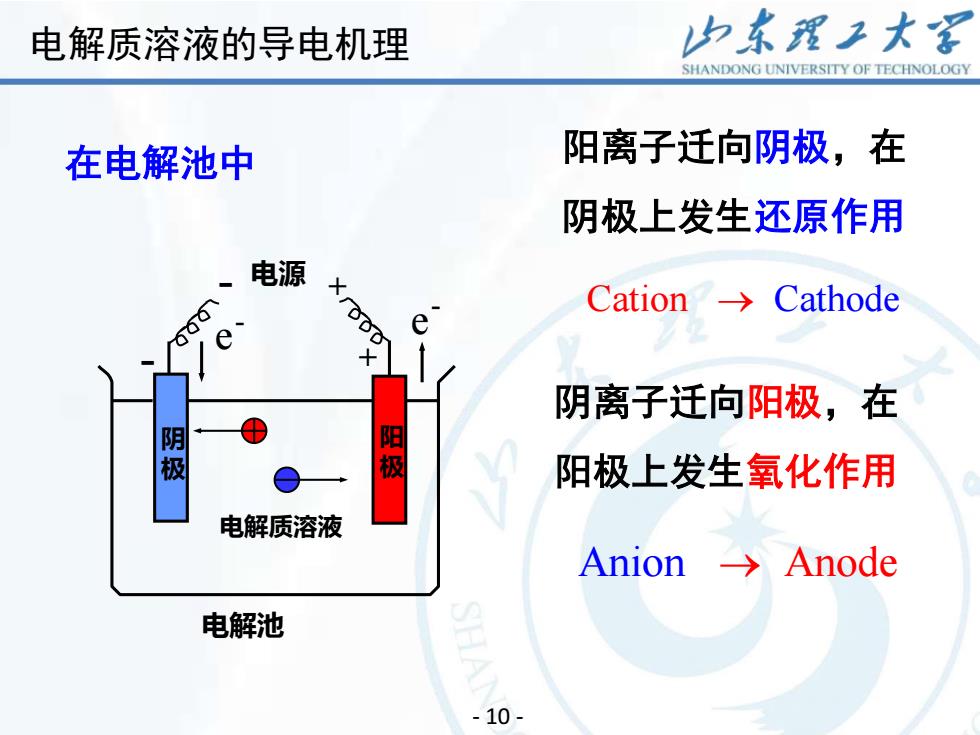
山东理工大客电解质溶液的导电机理SHANDONGUNIVERSITYOFTECHNOLOGY阳离子迁向阴极,在在电解池中阴极上发生还原作用电源xrgCationCathode00ee+阴离子迁向阳极,在阳极阴极阳极上发生氧化作用电解质溶液Anion→ Anode电解池- 10-
12 - 10 - 电解质溶液 阳离子迁向阴极,在 阴极上发生还原作用 Anion → Anode - 电源 + 电解池 + 阳 极 - e - e - 阴 极 Cation → Cathode 阴离子迁向阳极,在 阳极上发生氧化作用 在电解池中 电解质溶液的导电机理