
大连理工大学 分析化学电子教案-59分析化学中的分离与富集方法 Anal Chem. §9.1沉淀分离法 9.1.1无机沉淀剂沉淀分离法 1.氢氧化物沉淀分离法 沉淀剂: NaOH:可控制pH≥12。常用于两性金属离子和 非两性金属离子的分离。 NHOH:可以将pH控制在9左右,常用来沉淀不 与NHL3形成配离子的许多种金属离子。 影响因素: 溶液pH,共沉淀(该法选择性较差,非晶形沉淀) 2024年10月11日1时7 分
2024年10月11日1时7 分 §9.1 沉淀分离法 9.1.1 无机沉淀剂沉淀分离法 1. 氢氧化物沉淀分离法 沉淀剂: NaOH: 可控制pH≥12。常用于两性金属离子和 非两性金属离子的分离。 NH4OH: 可以将pH控制在9左右,常用来沉淀不 与 NH3 形成配离子的许多种金属离子。 影响因素: 溶液pH ,共沉淀(该法选择性较差, 非晶形沉淀) 分析化学电子教案-§9分析化学中的分离与富集方法
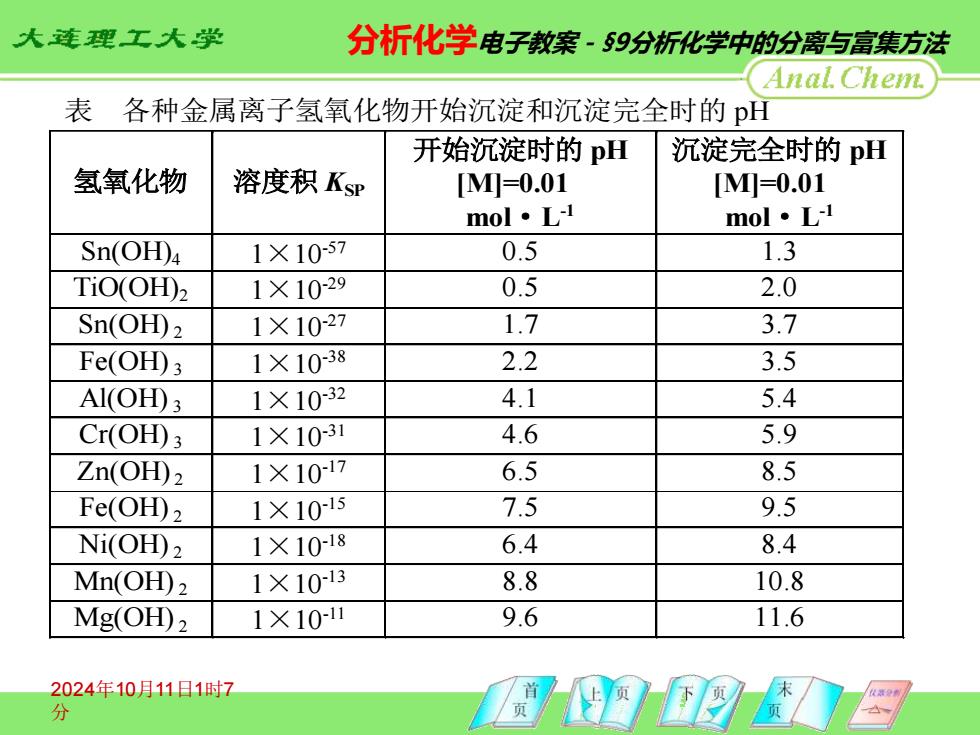
大连理工大学 分析化学电子教案·59分析化学中的分离与富集方法 Anal Chem. 表各种金属离子氢氧化物开始沉淀和沉淀完全时的p 开始沉淀时的pH 沉淀完全时的pH 氢氧化物 溶度积KsP [M0=0.01 [M4=0.01 mol·Ll mol·Ll Sn(OH)4 1×10-57 0.5 1.3 TiO(OH)2 1×10-29 0.5 2.0 Sn(OH)2 1×10-27 1.7 3.7 Fe(OH)3 1×1038 2.2 3.5 Al(OH)3 1×10-32 4.1 5.4 Cr(OH)3 1×10-31 4.6 5.9 Zn(OH)2 1×10-17 6.5 8.5 Fe(OH)2 1×10-15 7.5 9.5 Ni(OH)2 1×10-18 6.4 8.4 Mn(OH)2 1×1013 8.8 10.8 Mg(OH)2 1×10-11 9.6 11.6 2024年10月11日1时7 分
2024年10月11日1时7 分 表 各种金属离子氢氧化物开始沉淀和沉淀完全时的 pH 氢氧化物 溶度积 KSP 开始沉淀时的 pH [M]=0.01 mol·L -1 沉淀完全时的 pH [M]=0.01 mol·L -1 Sn(OH)4 1×10-57 0.5 1.3 TiO(OH)2 1×10-29 0.5 2.0 Sn(OH) 2 1×10-27 1.7 3.7 Fe(OH) 3 1×10-38 2.2 3.5 Al(OH) 3 1×10-32 4.1 5.4 Cr(OH) 3 1×10-31 4.6 5.9 Zn(OH) 2 1×10-17 6.5 8.5 Fe(OH) 2 1×10-15 7.5 9.5 Ni(OH) 2 1×10-18 6.4 8.4 Mn(OH) 2 1×10-13 8.8 10.8 Mg(OH) 2 1×10-11 9.6 11.6 分析化学电子教案-§9分析化学中的分离与富集方法

大连理工大学 分析化学电子教案-59分析化学中的分离与富集方法 Anal Chem 2.硫化物沉淀分离法 沉淀剂:H2S 能形成硫化物沉淀的金属离子约有40余种; 利用其溶解度相差悬殊,因而可以通过控制溶液 中[S2的办法使硫化物分步沉淀实现分离。 可通过控制适当的酸度来控制S2: -H+ -H HS HS S2- +H+ +H+ 缺点:选择性较差;非晶形沉淀,吸附现象严重。 H2S有毒,气味难闻 2024年10月11日1时7 分
2024年10月11日1时7 分 2. 硫化物沉淀分离法 能形成硫化物沉淀的金属离子约有40余种; 利用其溶解度相差悬殊,因而可以通过控制溶液 中[S 2- ]的办法使硫化物分步沉淀实现分离。 可通过控制适当的酸度来控制[S 2- ]: 缺点:选择性较差;非晶形沉淀,吸附现象严重。 H2S 有毒,气味难闻 分析化学电子教案-§9分析化学中的分离与富集方法 沉淀剂:H2S

大连理工大学 分析化学电子教案-9分析化学中的分离与富集方法 Anal.Chem 9.1.2有机沉淀剂沉淀分离法 有机沉淀剂的选择性和灵敏度较高,生成的沉淀 性能好。有机沉淀剂与金属离子形成的沉淀主要有: 1.螯合物沉淀 8-羟基喹啉与Mg2+生成六元环结构的螯合物沉淀,在氨缓冲 溶液中可实现镁与碱金属及碱土金属的分离: 2.缔合物沉淀 四苯基硼化物与K+的反应产物,溶度积2.25×10-8; 3.三元配合物沉淀 提高选择性和灵敏度的一条途径; 2024年10月11日1时7 分
2024年10月11日1时7 分 9.1.2 有机沉淀剂沉淀分离法 有机沉淀剂的选择性和灵敏度较高,生成的沉淀 性能好。有机沉淀剂与金属离子形成的沉淀主要有: 1.螯合物沉淀 8-羟基喹啉与Mg2+生成六元环结构的螯合物沉淀,在氨缓冲 溶液中可实现镁与碱金属及碱土金属的分离; 2.缔合物沉淀 四苯基硼化物与K+的反应产物, 溶度积2.25×10-8; 3.三元配合物沉淀 提高选择性和灵敏度的一条途径; 分析化学电子教案-§9分析化学中的分离与富集方法

大连理工大学 分析化学电子教案·59分析化学中的分离与富集方法 Anal Chem 9.1.3共沉淀分离法 利用共沉淀现象富集痕量组分,达到分离目的。 1.利用吸附作用进行共沉淀分离 利用CaC2O4作载体,可将微量稀土离子的草酸盐吸附。 2.利用生成混晶进行共沉淀分离 海水中亿万分之一的Cd2+,可用SrCO,作载体,生成 SrCO3和CdCO3混晶沉淀而富集。 3.利用有机共沉淀剂进行共沉淀分离 作用机理与无机共沉淀剂不同:形成固溶体。 有机大分子物质;选择性较好;可藉灼烧而除去。 2024年10月11日1时7 分
2024年10月11日1时7 分 9.1.3 共沉淀分离法 利用共沉淀现象富集痕 量组分,达到分离目的。 1. 利用吸附作用进行共沉淀分离 利用 CaC2O4 作载体,可将微量稀土离子的草酸盐吸附。 2. 利用生成混晶进行共沉淀分离 海水中亿万分之一的Cd2+ ,可用 SrCO3 作载体,生成 SrCO3 和 CdCO3 混晶沉淀而富集。 3. 利用有机共沉淀剂进行共沉淀分离 作用机理与无机共沉淀剂不同:形成固溶体。 有机大分子物质;选择性较好;可藉灼烧而除去。 分析化学电子教案-§9分析化学中的分离与富集方法