
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 1 第 2 章 化学键与分子结构 Chapter 2 Chemical Bond and Molecular Structure 教学要求 1.认识化学键的本质; 2.掌握离子键的形成及其特点; 3.掌握离子的特征,离子极化概念; 4.掌握价键理论的内容;会用价键理论解释共价键的特征,会用价电子对互斥理论和 杂化轨道理论解释简单的分子结构; 5.初步认识分子轨道,掌握第二周期元素的分子轨道特点; 6.理解金属键理论,特别是能带理论,会用能带理论解释固体分类; 7.初步了解晶体与非晶体的区别和晶体的内部结构; 8.认识分子间作用力和氢键的本质,会用其解释对物质性质的影响。 课时分配(8 学时) 1.化学键的定义; 2.离子键理论; 3.电子对键与路易斯结构式; 共 2 学时 4.价层电子对互斥理论; 5.价键理论; 6.杂化轨道理论; 共 4 学时 7.化学轨道理论; 8.金属键理论; 9.分子间力、氢键; 共 2 学时 前言 1.从结构观点看,除稀有气体外,其它原子都是不稳定结构,因此不可能以孤立的原 子存在,而是以可以独立存在的分子形式存在,分子由原子组成,是参与反应的基本单元, 可以是一个原子组成(rare gas 金属蒸气),可是以千千万万(为金刚石等)。物质的性质取 决于分子性质。 2.取决于分子的内部结构——了解物质的性质和化学反应规律,分子结构包含的内 容: (1)分子中原子间的强相互作用力(>40kJ·mol-1),即化学键(可由 IR, UV 等实验判断,也可进行量子力学计算); 分子水平研究 (2)分子或晶体的空间构型(即几何形状),可由四圆衍射测定或理论推测; (3)分子间力;
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 1 第 2 章 化学键与分子结构 Chapter 2 Chemical Bond and Molecular Structure 教学要求 1.认识化学键的本质; 2.掌握离子键的形成及其特点; 3.掌握离子的特征,离子极化概念; 4.掌握价键理论的内容;会用价键理论解释共价键的特征,会用价电子对互斥理论和 杂化轨道理论解释简单的分子结构; 5.初步认识分子轨道,掌握第二周期元素的分子轨道特点; 6.理解金属键理论,特别是能带理论,会用能带理论解释固体分类; 7.初步了解晶体与非晶体的区别和晶体的内部结构; 8.认识分子间作用力和氢键的本质,会用其解释对物质性质的影响。 课时分配(8 学时) 1.化学键的定义; 2.离子键理论; 3.电子对键与路易斯结构式; 共 2 学时 4.价层电子对互斥理论; 5.价键理论; 6.杂化轨道理论; 共 4 学时 7.化学轨道理论; 8.金属键理论; 9.分子间力、氢键; 共 2 学时 前言 1.从结构观点看,除稀有气体外,其它原子都是不稳定结构,因此不可能以孤立的原 子存在,而是以可以独立存在的分子形式存在,分子由原子组成,是参与反应的基本单元, 可以是一个原子组成(rare gas 金属蒸气),可是以千千万万(为金刚石等)。物质的性质取 决于分子性质。 2.取决于分子的内部结构——了解物质的性质和化学反应规律,分子结构包含的内 容: (1)分子中原子间的强相互作用力(>40kJ·mol-1),即化学键(可由 IR, UV 等实验判断,也可进行量子力学计算); 分子水平研究 (2)分子或晶体的空间构型(即几何形状),可由四圆衍射测定或理论推测; (3)分子间力;

西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 2 (4)分子的结构与物性间的关系; 3.化学键的本质是什么?为什么总是按一定的比例化合? 1916 年 Kossel——稀有气体的稳定结构提出离子键理论(简单明了,但不能说明 H2、 O2、N2 等相同原子组成的双原子分子) 1916 年 Lewis——共享电子对——共价键理论(根据电磁知识,很难解释为什么能共享 电子对就能结合成稳定的分子) 1927 年——Heitler 和 London 把量子力学应用到 H2 分子的形成上。 现代的物理研究成就提供了研究基础:四圆衍射磁性,核磁共振等。 解释了: a.分子的稳定性和共价键的本质问题; b.共价键的饱和性; c.分子的几何构型和共价键的方向性; d.化学键和分子的物化性质的关系。 4.化学键(现在已明确知道的化学键的类型) 5.分子间力和氢键:这些概念都在深入——超分子化学 随着化学进入一个复杂体系尤其是生命体系后,化学就不仅仅涉及我们研究对象分子的 成键和断键,也即不仅是离子键和共价键那样的强作用力,而且必须考虑这一复杂体系中分 子的弱相互作用力,如范德华力、库伦力、π-π堆集和氢键等等。虽然它们的作用力较弱, 如其中较强的氢键键能一般仅为普通 C—H 共价键键能的四分之一不到,但由此都组装了分 子聚集体、分子互补体系或通称的超分子体系。此种体系具有全新的性质或可使通常无法进 行的反应得以进行。在生物体中最著名的 DNA 的双螺旋结构就是由源自氢键的碱基配对而 形成的。高效的酶催化反应和信息的传递也是通过分子聚集体进行的。这样一个分子间互补、 组装的过程也就是通称的分子识别的过程。 DNA 的碱基主要有四种:腺嘌呤、鸟嘌呤、胞嘧啶、胸腺嘧啶。 生物体的遗传信息的密码的形式编码在 DNA 上,表现为特定的核苷酸排列顺序,并通 过 DNA 的复制由亲代传递给子代。 由于生命活动是通过蛋白质来表现,所以生物的遗传特征实际上是通过 DNA→RNA→ 蛋白质过程传统的。 DMA ← → ( ) ( ) 反转录 酶 转录 酶 RNA 转录 → 蛋白质 复制(酶) 复制(酶) DNA 分子双螺旋结构模型(a)及其图解(b) 酶催化作用的锁-钥理论 Lock and key model of enzyme action
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 2 (4)分子的结构与物性间的关系; 3.化学键的本质是什么?为什么总是按一定的比例化合? 1916 年 Kossel——稀有气体的稳定结构提出离子键理论(简单明了,但不能说明 H2、 O2、N2 等相同原子组成的双原子分子) 1916 年 Lewis——共享电子对——共价键理论(根据电磁知识,很难解释为什么能共享 电子对就能结合成稳定的分子) 1927 年——Heitler 和 London 把量子力学应用到 H2 分子的形成上。 现代的物理研究成就提供了研究基础:四圆衍射磁性,核磁共振等。 解释了: a.分子的稳定性和共价键的本质问题; b.共价键的饱和性; c.分子的几何构型和共价键的方向性; d.化学键和分子的物化性质的关系。 4.化学键(现在已明确知道的化学键的类型) 5.分子间力和氢键:这些概念都在深入——超分子化学 随着化学进入一个复杂体系尤其是生命体系后,化学就不仅仅涉及我们研究对象分子的 成键和断键,也即不仅是离子键和共价键那样的强作用力,而且必须考虑这一复杂体系中分 子的弱相互作用力,如范德华力、库伦力、π-π堆集和氢键等等。虽然它们的作用力较弱, 如其中较强的氢键键能一般仅为普通 C—H 共价键键能的四分之一不到,但由此都组装了分 子聚集体、分子互补体系或通称的超分子体系。此种体系具有全新的性质或可使通常无法进 行的反应得以进行。在生物体中最著名的 DNA 的双螺旋结构就是由源自氢键的碱基配对而 形成的。高效的酶催化反应和信息的传递也是通过分子聚集体进行的。这样一个分子间互补、 组装的过程也就是通称的分子识别的过程。 DNA 的碱基主要有四种:腺嘌呤、鸟嘌呤、胞嘧啶、胸腺嘧啶。 生物体的遗传信息的密码的形式编码在 DNA 上,表现为特定的核苷酸排列顺序,并通 过 DNA 的复制由亲代传递给子代。 由于生命活动是通过蛋白质来表现,所以生物的遗传特征实际上是通过 DNA→RNA→ 蛋白质过程传统的。 DMA ← → ( ) ( ) 反转录 酶 转录 酶 RNA 转录 → 蛋白质 复制(酶) 复制(酶) DNA 分子双螺旋结构模型(a)及其图解(b) 酶催化作用的锁-钥理论 Lock and key model of enzyme action
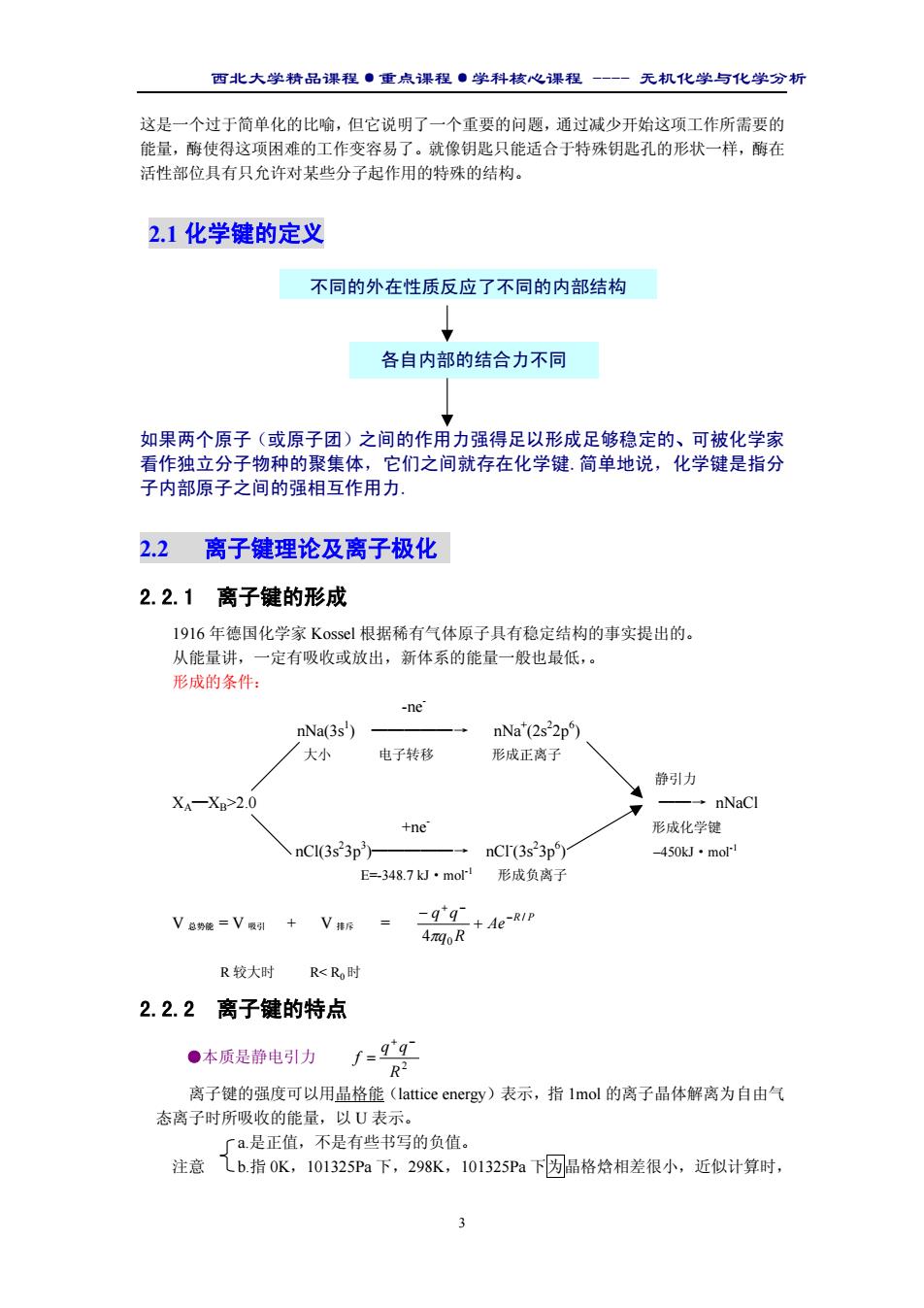
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 3 这是一个过于简单化的比喻,但它说明了一个重要的问题,通过减少开始这项工作所需要的 能量,酶使得这项困难的工作变容易了。就像钥匙只能适合于特殊钥匙孔的形状一样,酶在 活性部位具有只允许对某些分子起作用的特殊的结构。 2.1 化学键的定义 如果两个原子(或原子团)之间的作用力强得足以形成足够稳定的、可被化学家 看作独立分子物种的聚集体,它们之间就存在化学键.简单地说,化学键是指分 子内部原子之间的强相互作用力. 2.2 离子键理论及离子极化 2.2.1 离子键的形成 1916 年德国化学家 Kossel 根据稀有气体原子具有稳定结构的事实提出的。 从能量讲,一定有吸收或放出,新体系的能量一般也最低,。 形成的条件: -ne- nNa(3s1 ) —————→ nNa+ (2s2 2p6 ) 大小 电子转移 形成正离子 静引力 XA—XB>2.0 ——→ nNaCl +ne- 形成化学键 nCl(3s2 3p3 )—————→ nCl- (3s2 3p6 ) –450kJ·mol-1 E=-348.7 kJ·mol-1 形成负离子 V 总势能 = V 吸引 + V 排斥 = R P Ae q R q q / 0 4 − + − + − π R 较大时 R< R0时 2.2.2 离子键的特点 ●本质是静电引力 2 R q q f + − = 离子键的强度可以用晶格能(lattice energy)表示,指 1mol 的离子晶体解离为自由气 态离子时所吸收的能量,以 U 表示。 a.是正值,不是有些书写的负值。 注意 b.指 0K,101325Pa 下,298K,101325Pa 下为晶格焓相差很小,近似计算时, 不同的外在性质反应了不同的内部结构 各自内部的结合力不同
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 3 这是一个过于简单化的比喻,但它说明了一个重要的问题,通过减少开始这项工作所需要的 能量,酶使得这项困难的工作变容易了。就像钥匙只能适合于特殊钥匙孔的形状一样,酶在 活性部位具有只允许对某些分子起作用的特殊的结构。 2.1 化学键的定义 如果两个原子(或原子团)之间的作用力强得足以形成足够稳定的、可被化学家 看作独立分子物种的聚集体,它们之间就存在化学键.简单地说,化学键是指分 子内部原子之间的强相互作用力. 2.2 离子键理论及离子极化 2.2.1 离子键的形成 1916 年德国化学家 Kossel 根据稀有气体原子具有稳定结构的事实提出的。 从能量讲,一定有吸收或放出,新体系的能量一般也最低,。 形成的条件: -ne- nNa(3s1 ) —————→ nNa+ (2s2 2p6 ) 大小 电子转移 形成正离子 静引力 XA—XB>2.0 ——→ nNaCl +ne- 形成化学键 nCl(3s2 3p3 )—————→ nCl- (3s2 3p6 ) –450kJ·mol-1 E=-348.7 kJ·mol-1 形成负离子 V 总势能 = V 吸引 + V 排斥 = R P Ae q R q q / 0 4 − + − + − π R 较大时 R< R0时 2.2.2 离子键的特点 ●本质是静电引力 2 R q q f + − = 离子键的强度可以用晶格能(lattice energy)表示,指 1mol 的离子晶体解离为自由气 态离子时所吸收的能量,以 U 表示。 a.是正值,不是有些书写的负值。 注意 b.指 0K,101325Pa 下,298K,101325Pa 下为晶格焓相差很小,近似计算时, 不同的外在性质反应了不同的内部结构 各自内部的结合力不同
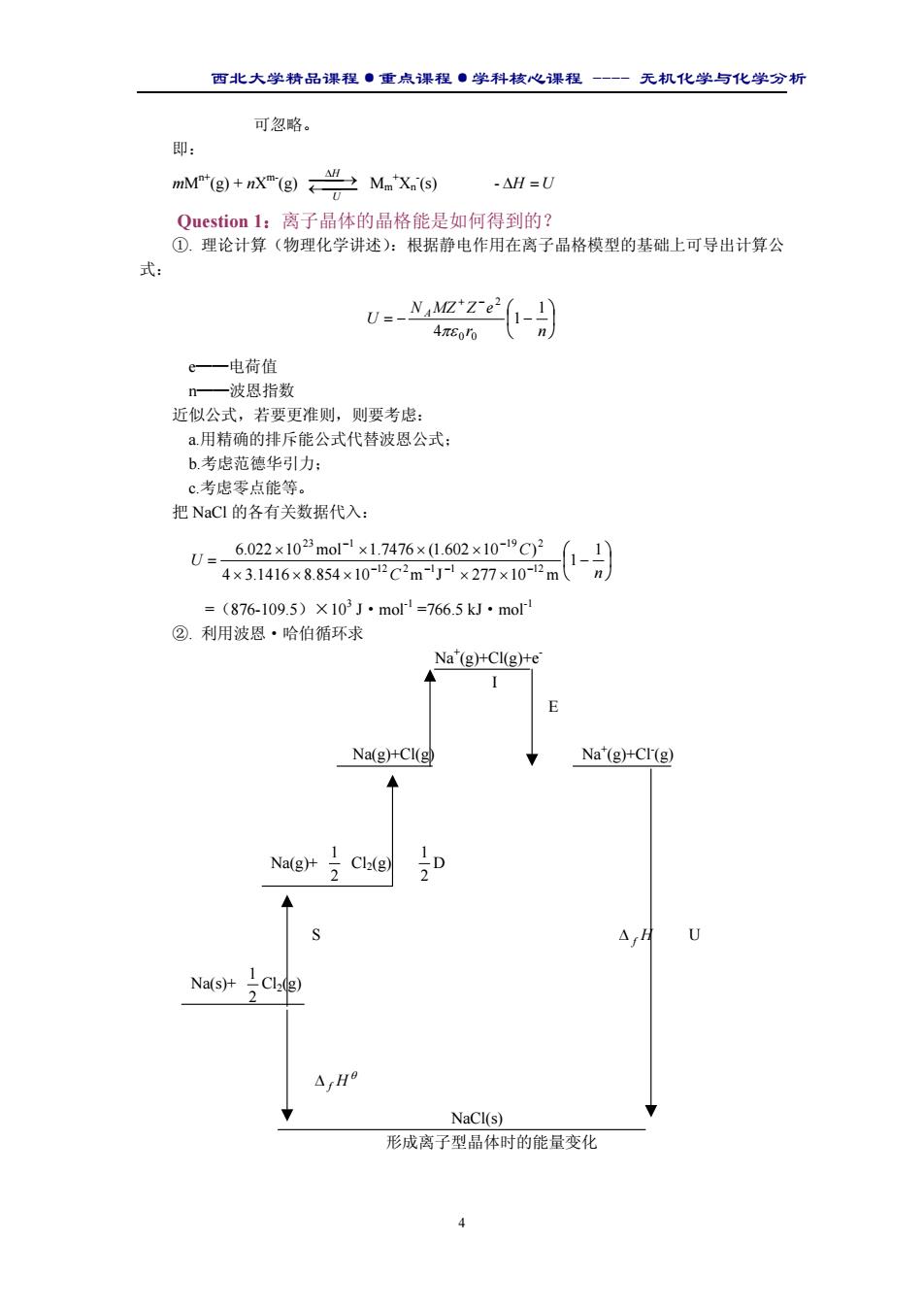
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 4 可忽略。 即: mMn+(g) + nXm-(g) ← ∆ → U H Mm + Xn - (s) - ∆H = U Question 1:离子晶体的晶格能是如何得到的? ①. 理论计算(物理化学讲述):根据静电作用在离子晶格模型的基础上可导出计算公 式: = − − + − r n N MZ Z e U A 1 1 4 0 0 2 πε e——电荷值 n——波恩指数 近似公式,若要更准则,则要考虑: a.用精确的排斥能公式代替波恩公式; b.考虑范德华引力; c.考虑零点能等。 把 NaCl 的各有关数据代入: − × × × × × × × × × = − − − − − − C n C U 1 1 4 3.1416 8.854 10 m J 277 10 m 6.022 10 mol 1.7476 (1.602 10 ) 12 2 1 1 12 23 1 19 2 =(876-109.5)×103 J·mol-1 =766.5 kJ·mol-1 ②. 利用波恩·哈伯循环求 Na+ (g)+Cl(g)+e- I E Na(g)+Cl(g) Na+ (g)+Cl- (g) Na(g)+ 2 1 Cl2(g) 2 1 D S ∆ f H U Na(s)+ 2 1 Cl2(g) θ ∆ f H NaCl(s) 形成离子型晶体时的能量变化
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 4 可忽略。 即: mMn+(g) + nXm-(g) ← ∆ → U H Mm + Xn - (s) - ∆H = U Question 1:离子晶体的晶格能是如何得到的? ①. 理论计算(物理化学讲述):根据静电作用在离子晶格模型的基础上可导出计算公 式: = − − + − r n N MZ Z e U A 1 1 4 0 0 2 πε e——电荷值 n——波恩指数 近似公式,若要更准则,则要考虑: a.用精确的排斥能公式代替波恩公式; b.考虑范德华引力; c.考虑零点能等。 把 NaCl 的各有关数据代入: − × × × × × × × × × = − − − − − − C n C U 1 1 4 3.1416 8.854 10 m J 277 10 m 6.022 10 mol 1.7476 (1.602 10 ) 12 2 1 1 12 23 1 19 2 =(876-109.5)×103 J·mol-1 =766.5 kJ·mol-1 ②. 利用波恩·哈伯循环求 Na+ (g)+Cl(g)+e- I E Na(g)+Cl(g) Na+ (g)+Cl- (g) Na(g)+ 2 1 Cl2(g) 2 1 D S ∆ f H U Na(s)+ 2 1 Cl2(g) θ ∆ f H NaCl(s) 形成离子型晶体时的能量变化

西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 5 ( ) ( ) 2 θ 1 ∆f H = S + D + I + −E + −U ∴ U = −∆ H S + D + I − E 2 θ 1 f 以 NaCl 为例: U = [-(-411)+09+121+496-349] kJ· mol-1 =788 kJ·mol-1 如果再者的结果相当接近,说明离子键理论基本上是正确的。 ③.水合能循环法(上边的常常缺少 E 和晶体结构参数) 盖斯定律 始态 NaCl(s) → −U Na+ (g) + Cl- (g) ∆Hsol 溶解热 h(Na ) ∆H + h(Cl ) ∆H − 绝对水合能 Na+ (aq) + Cl- (aq) 终态 则 sol h(Na ) h(Cl ) U = ∆H + + ∆H − − ∆H =(-443.9)+(-340.6)-3.8 =788.3 kJ·mol-1 Question 2:离子键的键能(焓)和晶格能(焓)的含义是否相同? 不同。 298K,101325Pa Na(g) ∆ →E1 Na+ (g) ∆ →E3 NaCl(g) ∆ →E4 NaCl(s) Cl(g) ∆ →E2 Cl- (g) 则 键焓= ∆E1 + ∆E2 + ∆E3 晶格焓= ∆E3 + ∆E4 (由于离子型晶体稳定,分子只有在极高的强度下存在,因此键焓用处不大。) 影响 U 大小主要是电荷和 r0(P31 表 2.1) ●没有方向性和饱和性(P36) 结构化学还可计算,但不属本课程内容。 ●键的离子性与元素的电负性有关 单键的离子性能百分数与电负性差值之间的关系 XA-XB 离子性百分比/% XA-XB 离子性百分比/%
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 5 ( ) ( ) 2 θ 1 ∆f H = S + D + I + −E + −U ∴ U = −∆ H S + D + I − E 2 θ 1 f 以 NaCl 为例: U = [-(-411)+09+121+496-349] kJ· mol-1 =788 kJ·mol-1 如果再者的结果相当接近,说明离子键理论基本上是正确的。 ③.水合能循环法(上边的常常缺少 E 和晶体结构参数) 盖斯定律 始态 NaCl(s) → −U Na+ (g) + Cl- (g) ∆Hsol 溶解热 h(Na ) ∆H + h(Cl ) ∆H − 绝对水合能 Na+ (aq) + Cl- (aq) 终态 则 sol h(Na ) h(Cl ) U = ∆H + + ∆H − − ∆H =(-443.9)+(-340.6)-3.8 =788.3 kJ·mol-1 Question 2:离子键的键能(焓)和晶格能(焓)的含义是否相同? 不同。 298K,101325Pa Na(g) ∆ →E1 Na+ (g) ∆ →E3 NaCl(g) ∆ →E4 NaCl(s) Cl(g) ∆ →E2 Cl- (g) 则 键焓= ∆E1 + ∆E2 + ∆E3 晶格焓= ∆E3 + ∆E4 (由于离子型晶体稳定,分子只有在极高的强度下存在,因此键焓用处不大。) 影响 U 大小主要是电荷和 r0(P31 表 2.1) ●没有方向性和饱和性(P36) 结构化学还可计算,但不属本课程内容。 ●键的离子性与元素的电负性有关 单键的离子性能百分数与电负性差值之间的关系 XA-XB 离子性百分比/% XA-XB 离子性百分比/%