
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 1 第六章 氧化还原反应 Chapter 6 Redox Reaction 教学要求 1. 理解氧化还原反应的基本概念; 2. 掌握氧化还原方程式的两种配平方法; 3.了解埃灵罕姆图的意义及其应用; 4. 熟悉能斯特公式、影响电极电势的因素及其应用; 5. 了解电势数据的两种图示法及其应用。 课时分配(8 学时) 1.氧化还原反应的基本概念(1 学时) (1)氧化与还原,氧化剂与还原剂,氧化值,氧化还原对 (2)氧化还原反应方程式的配平: 氧化值法,半反应法(离子—电子法) 2.高温氧化还原反应的自发性及 Ellingham 图(1 学时) 3.水溶液中氧化还原反应的自发性和电极电势(3 学时) (1)氧化还原反应与化学电池 (2)标准电极电势 (3)能斯特方程 4.电势数据的图示法(与下一个问题共 1 学时) (1)Latimer diagram 及其应用 (2)Frost diagram 及其应用 5.影响氧化还反应的动力学因素和氧化还原反应机理 6.1 基本概念 6.1.1 氧化与还原概念的演变 起先:与氧结合的过程叫氧化; 2Mg(s)+O2(g)=2MgO(S) 覆盖范围比较小 后来:失电子的过程叫氧化 Mg→Mg2++2e 揭露实质,扩大覆盖范围 现在:对 2P(s)+3Cl2(g)=2PCl3(l)显然“失电子”不明显 1.氧化值 Oxidation number 人为规定的给单质和化合物中某元素原子所带形式电荷的数值(1948 年在价键理论和
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 1 第六章 氧化还原反应 Chapter 6 Redox Reaction 教学要求 1. 理解氧化还原反应的基本概念; 2. 掌握氧化还原方程式的两种配平方法; 3.了解埃灵罕姆图的意义及其应用; 4. 熟悉能斯特公式、影响电极电势的因素及其应用; 5. 了解电势数据的两种图示法及其应用。 课时分配(8 学时) 1.氧化还原反应的基本概念(1 学时) (1)氧化与还原,氧化剂与还原剂,氧化值,氧化还原对 (2)氧化还原反应方程式的配平: 氧化值法,半反应法(离子—电子法) 2.高温氧化还原反应的自发性及 Ellingham 图(1 学时) 3.水溶液中氧化还原反应的自发性和电极电势(3 学时) (1)氧化还原反应与化学电池 (2)标准电极电势 (3)能斯特方程 4.电势数据的图示法(与下一个问题共 1 学时) (1)Latimer diagram 及其应用 (2)Frost diagram 及其应用 5.影响氧化还反应的动力学因素和氧化还原反应机理 6.1 基本概念 6.1.1 氧化与还原概念的演变 起先:与氧结合的过程叫氧化; 2Mg(s)+O2(g)=2MgO(S) 覆盖范围比较小 后来:失电子的过程叫氧化 Mg→Mg2++2e 揭露实质,扩大覆盖范围 现在:对 2P(s)+3Cl2(g)=2PCl3(l)显然“失电子”不明显 1.氧化值 Oxidation number 人为规定的给单质和化合物中某元素原子所带形式电荷的数值(1948 年在价键理论和

西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 2 电负性的基础上提出的) 氧化 oxidation 氧化剂 oxidant 还原 reduction 还原剂 reductant ·从而可以准确地定义氧化和还原; ·揭示氧化还原反应的特征(character):在化学反应中,元素的原子或离子在反应前 后氧化数发生了变化的一类反应; ·歧化反应 disproportionation reaction 4KClO3===KClO4+KCl ·确定氧化值的规则(P146) ·氧化值的概念也有不足之处,不是十分严格。 Co(NH3)6 3+, NH3 为中性分子,Co 的氧化数为+3,但近代实验指出,由于 6 个 NH3分子 向 Co3+给出 6 对电子,大大降低了 Co3+离子的正电荷; 固体 PCl5 具有[PCl4] + [PCl6] - 式的结构,P 的原子价一个是+4,一个是+6,但氧化数却是 +5;而 CH4,CH4, CH3Cl,CH2Cl, CHCl3 和 CCl4中 C 的原子价为+4,氧化数却不同,依次 为-4,-2,0,+2 和+4。 还有一些例子,尽管如此,用氧化值讨论仍很方便。 2.氧化还原对 redox couple 与共轭酸碱对一样,存在共轭氧化还原电对: 反应中 Cu2+ + Zn = Zn2+ +Cu O1 R1 O2 R2 Cu2+/Cu Zn2+/Zn (O)(R) (O)(R) ·显然,氧化剂降低氧化值的趋势越强,它的氧化能力越强,则其共轭还原剂升高氧化 的趋势就越弱,还原能力越弱;对还原剂同。 ·反应一般按较强的氧化剂和较强的还原剂相互作用的方向进行。 ·这种共轭关系用半反应式来表示。 Cu2++2e- Cu Zn Zn2++2e- 6.2 氧化还原反应方程式的配平 就是为各物种找到合适的化学计量数,有时很难用目视法配平,有氧化值法,离子-电 子法和矩阵法等。 1.氧化值法(P146) 步骤 P146;原则,氧化剂氧化数的降低=还原剂氧化数的升高值 2.离子-电子法(半反应法)(P149) 配平原则:使氧化剂得到的电子数和还原剂失去的电子数相等;反应前后各元素的原子 总数相等。 步骤:P150 配平关键:是还原反应和氧化反应这两个半反应的配平,配平半反应,先使半反应前后 各元素的原子数相等,然后是电荷数相等。 配平难点:配平半反应的氧原子数。 酸性溶液 碱性溶液
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 2 电负性的基础上提出的) 氧化 oxidation 氧化剂 oxidant 还原 reduction 还原剂 reductant ·从而可以准确地定义氧化和还原; ·揭示氧化还原反应的特征(character):在化学反应中,元素的原子或离子在反应前 后氧化数发生了变化的一类反应; ·歧化反应 disproportionation reaction 4KClO3===KClO4+KCl ·确定氧化值的规则(P146) ·氧化值的概念也有不足之处,不是十分严格。 Co(NH3)6 3+, NH3 为中性分子,Co 的氧化数为+3,但近代实验指出,由于 6 个 NH3分子 向 Co3+给出 6 对电子,大大降低了 Co3+离子的正电荷; 固体 PCl5 具有[PCl4] + [PCl6] - 式的结构,P 的原子价一个是+4,一个是+6,但氧化数却是 +5;而 CH4,CH4, CH3Cl,CH2Cl, CHCl3 和 CCl4中 C 的原子价为+4,氧化数却不同,依次 为-4,-2,0,+2 和+4。 还有一些例子,尽管如此,用氧化值讨论仍很方便。 2.氧化还原对 redox couple 与共轭酸碱对一样,存在共轭氧化还原电对: 反应中 Cu2+ + Zn = Zn2+ +Cu O1 R1 O2 R2 Cu2+/Cu Zn2+/Zn (O)(R) (O)(R) ·显然,氧化剂降低氧化值的趋势越强,它的氧化能力越强,则其共轭还原剂升高氧化 的趋势就越弱,还原能力越弱;对还原剂同。 ·反应一般按较强的氧化剂和较强的还原剂相互作用的方向进行。 ·这种共轭关系用半反应式来表示。 Cu2++2e- Cu Zn Zn2++2e- 6.2 氧化还原反应方程式的配平 就是为各物种找到合适的化学计量数,有时很难用目视法配平,有氧化值法,离子-电 子法和矩阵法等。 1.氧化值法(P146) 步骤 P146;原则,氧化剂氧化数的降低=还原剂氧化数的升高值 2.离子-电子法(半反应法)(P149) 配平原则:使氧化剂得到的电子数和还原剂失去的电子数相等;反应前后各元素的原子 总数相等。 步骤:P150 配平关键:是还原反应和氧化反应这两个半反应的配平,配平半反应,先使半反应前后 各元素的原子数相等,然后是电荷数相等。 配平难点:配平半反应的氧原子数。 酸性溶液 碱性溶液
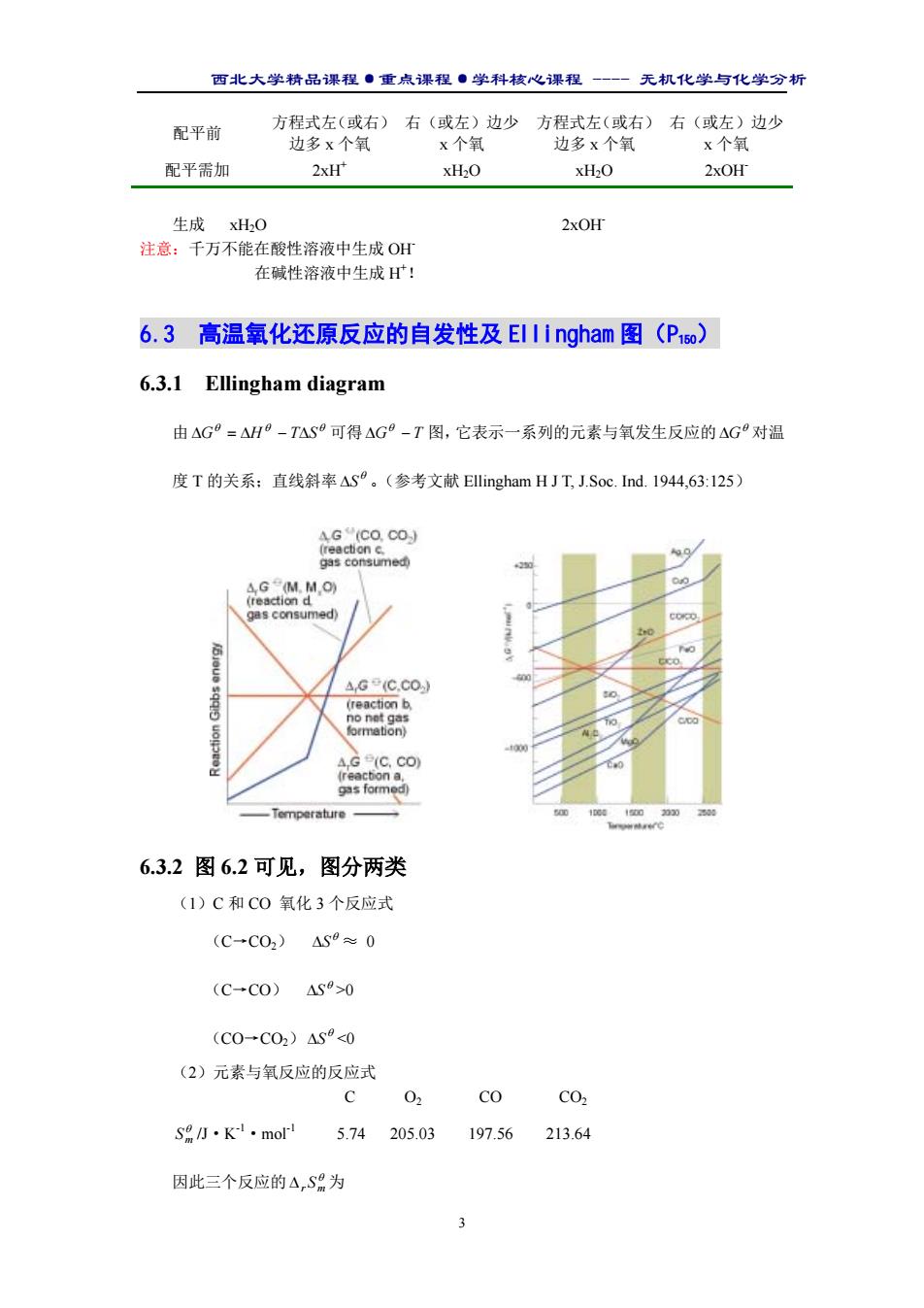
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 3 配平前 方程式左(或右) 边多 x 个氧 右(或左)边少 x 个氧 方程式左(或右) 边多 x 个氧 右(或左)边少 x 个氧 配平需加 2xH+ xH2O xH2O 2xOH- 生成 xH2O 2xOH- 注意:千万不能在酸性溶液中生成 OH- 在碱性溶液中生成 H+ ! 6.3 高温氧化还原反应的自发性及 Ellingham 图(P150) 6.3.1 Ellingham diagram 由 θ θ θ ∆G = ∆H − T∆S 可得 ∆G − T θ 图,它表示一系列的元素与氧发生反应的 θ ∆G 对温 度 T 的关系;直线斜率 θ ∆S 。(参考文献 Ellingham H J T, J.Soc. Ind. 1944,63:125) 6.3.2 图 6.2 可见,图分两类 (1)C 和 CO 氧化 3 个反应式 (C→CO2) θ ∆S ≈ 0 (C→CO) θ ∆S >0 (CO→CO2) θ ∆S <0 (2)元素与氧反应的反应式 C O2 CO CO2 θ Sm /J·K-1·mol-1 5.74 205.03 197.56 213.64 因此三个反应的 θ ∆r Sm 为
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 3 配平前 方程式左(或右) 边多 x 个氧 右(或左)边少 x 个氧 方程式左(或右) 边多 x 个氧 右(或左)边少 x 个氧 配平需加 2xH+ xH2O xH2O 2xOH- 生成 xH2O 2xOH- 注意:千万不能在酸性溶液中生成 OH- 在碱性溶液中生成 H+ ! 6.3 高温氧化还原反应的自发性及 Ellingham 图(P150) 6.3.1 Ellingham diagram 由 θ θ θ ∆G = ∆H − T∆S 可得 ∆G − T θ 图,它表示一系列的元素与氧发生反应的 θ ∆G 对温 度 T 的关系;直线斜率 θ ∆S 。(参考文献 Ellingham H J T, J.Soc. Ind. 1944,63:125) 6.3.2 图 6.2 可见,图分两类 (1)C 和 CO 氧化 3 个反应式 (C→CO2) θ ∆S ≈ 0 (C→CO) θ ∆S >0 (CO→CO2) θ ∆S <0 (2)元素与氧反应的反应式 C O2 CO CO2 θ Sm /J·K-1·mol-1 5.74 205.03 197.56 213.64 因此三个反应的 θ ∆r Sm 为

西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 4 2CO+O2→2CO2 θ ∆r Sm =-172.87 C+O2→CO2 θ ∆r Sm =2.87 2C+O2→2CO θ ∆r Sm =178.61 由此形成三条斜率不同的直线。 6.3.3 图的用途: 金属制备的热还原法(另一种方法为电解法)用于判断碳还原金属氧化物反应的可 能性。 若用 C 还原金属氧化物: C(s)+ ( x 2 ) MOx(s) →( x 2 )M(l)+CO2(g) 则 θ ∆G = θ ∆G (C,CO2)- θ ∆G (M,MOx) 或 θ ∆G = θ ∆G (CO,CO2)- θ ∆G (M,MOx) ·只有右端后项的代数值大于前项时 θ ∆G <0,只要在给定的温度区间内金属氧化物反 应的线段处于 C 和 CO 氧化反应的任一线段的上方,相应的热还原反应在热力学上才是允 许的。 ·同理,只要 θ ∆G (M,MOx)的线段处于 θ ∆G (M’,M’Ox)线段的上方,金属 M’ 就可用来还原金属 M 的氧化物。 举例: ·CuO 的线段在图中处于较高的位置(大部分温度区间内处于碳的三条线段的上方), 因而铜矿的还原是困难最小的还原反应之一,(还有谁?Hg、Ag.) 这也是人类先经历铜器时代(公元前 4000 年)而后才是铁器时代(公元前 1000 年)的 原因。 ·Fe,Si 等 ·找被 C 还原的最低温度(P134 例 6.6) 6.4 水溶液中氧化学原反应的自发性和电极电势(重点!) 6.4.1 氧化还原反应与化学电池 (1)丹尼尔电池的原理:
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 4 2CO+O2→2CO2 θ ∆r Sm =-172.87 C+O2→CO2 θ ∆r Sm =2.87 2C+O2→2CO θ ∆r Sm =178.61 由此形成三条斜率不同的直线。 6.3.3 图的用途: 金属制备的热还原法(另一种方法为电解法)用于判断碳还原金属氧化物反应的可 能性。 若用 C 还原金属氧化物: C(s)+ ( x 2 ) MOx(s) →( x 2 )M(l)+CO2(g) 则 θ ∆G = θ ∆G (C,CO2)- θ ∆G (M,MOx) 或 θ ∆G = θ ∆G (CO,CO2)- θ ∆G (M,MOx) ·只有右端后项的代数值大于前项时 θ ∆G <0,只要在给定的温度区间内金属氧化物反 应的线段处于 C 和 CO 氧化反应的任一线段的上方,相应的热还原反应在热力学上才是允 许的。 ·同理,只要 θ ∆G (M,MOx)的线段处于 θ ∆G (M’,M’Ox)线段的上方,金属 M’ 就可用来还原金属 M 的氧化物。 举例: ·CuO 的线段在图中处于较高的位置(大部分温度区间内处于碳的三条线段的上方), 因而铜矿的还原是困难最小的还原反应之一,(还有谁?Hg、Ag.) 这也是人类先经历铜器时代(公元前 4000 年)而后才是铁器时代(公元前 1000 年)的 原因。 ·Fe,Si 等 ·找被 C 还原的最低温度(P134 例 6.6) 6.4 水溶液中氧化学原反应的自发性和电极电势(重点!) 6.4.1 氧化还原反应与化学电池 (1)丹尼尔电池的原理:

西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 5 oxidation Zn(S) → Zn+ (aq)+2e- Cu 2+(aq)+Zn(S)=Zn2+ (aq)+Cu(S) Cu2+(aq)+2e- →Cu(S) Reduction P154 图 6.4 两个电对 Ox/Red 化学电池的三个过程:(同时发生) a. 两个半电池,一个发生氧化反应,一个发生还原反应; b. 电子流过外电路; c. 离子流过电解质溶。 (2)双电层原理:P54 图 6.3 产生金属和它的盐溶液之间的电势叫做金属的电极电势(electrode potential) M(s) Mn+(aq)+ne- 产生电势 动态平衡 (这个平衡的特点具有电子得失,即发生 OR 反应) 图空 金属电极电势的高低: 与本身的活泼性有关 与之平衡的盐溶液的浓度有关 与温度有关 (3)盐桥(salt bridge) 通常内盛饱和 KCl 溶液或 NH4NO3 溶液 作用:a.让溶液始终保持电中性,电极反应得以继续进行; b.消除原电池中的液接电势(或扩散电势) 图空 由于浓度不同,H3O+ 的扩散速度大于 Cl- ,因而最后两边正负电荷不同,最后达到平衡 时,膜两侧的净电荷达到定值。这样就在界面上形成了一定的电势差,即液接电势 Qd。 它的产生使电动势与两电极的电极电势关系复杂。 化: = Q+ − Q− + Qd ε 而且对于较复杂的体系,Qd 值难于准确计算,也难于用实验方法准确测定。所以在实 际工作中通常采用盐桥装置消除它。当把盐桥架于两个半电池之间时,它就把两个半电池溶 液间的接界面变成盐桥两端 KCl 溶液分别与两侧溶液的两个接界面。由于 KCl 溶液浓度很 高,盐桥与电池溶液间的液接电势主要由 KCl 扩散产生的。又由于 K+ 和 Cl- 的扩散速度几乎 相等,所以在这两个接界面上会产生两个很小的电势差。而且这两个很小的电势差又是方向 相反,能相互消减。这样盐桥就起到了消除液接电势的效果。 (4)电极的类型与原电池的表示法 四种类型的电极: a.金属—金属离子电极: 电极反应 Zn2++2e- Zn 电极符号 Zn(S)|Zn2+(aq) 界面 b. 气体—离子电极(需要一个固体导电体,对所接能的 gas 和 solution 都不起作用,但
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 5 oxidation Zn(S) → Zn+ (aq)+2e- Cu 2+(aq)+Zn(S)=Zn2+ (aq)+Cu(S) Cu2+(aq)+2e- →Cu(S) Reduction P154 图 6.4 两个电对 Ox/Red 化学电池的三个过程:(同时发生) a. 两个半电池,一个发生氧化反应,一个发生还原反应; b. 电子流过外电路; c. 离子流过电解质溶。 (2)双电层原理:P54 图 6.3 产生金属和它的盐溶液之间的电势叫做金属的电极电势(electrode potential) M(s) Mn+(aq)+ne- 产生电势 动态平衡 (这个平衡的特点具有电子得失,即发生 OR 反应) 图空 金属电极电势的高低: 与本身的活泼性有关 与之平衡的盐溶液的浓度有关 与温度有关 (3)盐桥(salt bridge) 通常内盛饱和 KCl 溶液或 NH4NO3 溶液 作用:a.让溶液始终保持电中性,电极反应得以继续进行; b.消除原电池中的液接电势(或扩散电势) 图空 由于浓度不同,H3O+ 的扩散速度大于 Cl- ,因而最后两边正负电荷不同,最后达到平衡 时,膜两侧的净电荷达到定值。这样就在界面上形成了一定的电势差,即液接电势 Qd。 它的产生使电动势与两电极的电极电势关系复杂。 化: = Q+ − Q− + Qd ε 而且对于较复杂的体系,Qd 值难于准确计算,也难于用实验方法准确测定。所以在实 际工作中通常采用盐桥装置消除它。当把盐桥架于两个半电池之间时,它就把两个半电池溶 液间的接界面变成盐桥两端 KCl 溶液分别与两侧溶液的两个接界面。由于 KCl 溶液浓度很 高,盐桥与电池溶液间的液接电势主要由 KCl 扩散产生的。又由于 K+ 和 Cl- 的扩散速度几乎 相等,所以在这两个接界面上会产生两个很小的电势差。而且这两个很小的电势差又是方向 相反,能相互消减。这样盐桥就起到了消除液接电势的效果。 (4)电极的类型与原电池的表示法 四种类型的电极: a.金属—金属离子电极: 电极反应 Zn2++2e- Zn 电极符号 Zn(S)|Zn2+(aq) 界面 b. 气体—离子电极(需要一个固体导电体,对所接能的 gas 和 solution 都不起作用,但