
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 1 第 13 章 p 区元素(一) Chapter 13 p Block (1) 教学要求 1.了解 p 区元素的特点; 2.了解 p 区元素的存在、制备及用途; 3.掌握重点元素硼、铝、碳、硅、氮和磷的单质及其化合物的性质,会用结构理论和 热力学解释它们的某些化学现象; 4.从正硼烷的结构了解缺电子键和硼烷结构; 5.了解一些无机材料的制备和用途; 6.了解惰性电子对效应概念及其应用。 课时分配(9 学时) 1. 概述:(1 学时) 2. 天然资源、单质的提取和用途:(1 学时) 3. 硼的单质和化合物:(1 学时) 4. 金属铝及其化合物:(1 学时) 5. 碳的单质及其化合物:(1 学时) 6. 硅及其化合物:(1 学时) 7. 氮及其化合物:(1 学时) 8. 磷及其化合物:(1 学时) 9. 长周期元素和惰性电子对效应:(1 学时)
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 1 第 13 章 p 区元素(一) Chapter 13 p Block (1) 教学要求 1.了解 p 区元素的特点; 2.了解 p 区元素的存在、制备及用途; 3.掌握重点元素硼、铝、碳、硅、氮和磷的单质及其化合物的性质,会用结构理论和 热力学解释它们的某些化学现象; 4.从正硼烷的结构了解缺电子键和硼烷结构; 5.了解一些无机材料的制备和用途; 6.了解惰性电子对效应概念及其应用。 课时分配(9 学时) 1. 概述:(1 学时) 2. 天然资源、单质的提取和用途:(1 学时) 3. 硼的单质和化合物:(1 学时) 4. 金属铝及其化合物:(1 学时) 5. 碳的单质及其化合物:(1 学时) 6. 硅及其化合物:(1 学时) 7. 氮及其化合物:(1 学时) 8. 磷及其化合物:(1 学时) 9. 长周期元素和惰性电子对效应:(1 学时)

西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 2 p 区包括第13 至第 18 共六族元素, 加上新近合成的 114 号、116 号和 118 号在内, 元素总 数共 34 种。该区的 12 个短周期元素(硼、碳、氮、氧、氟、氖和铝、硅、磷、硫、氯、氩)与 s 区的 4 个短周期元素(锂、铍、钠、镁)一起被叫作为典型元素; 包括尚未发现的 3 个元素(Z=113, 115, 117)在内的 24 个长周期元素又叫过渡后元素. p区元素价电子组态为ns 2 np 1~6. 最高氧化态为+3至+8,不再与IUPAC推荐的族序号相一致。 ● 唯一同时包括金属和非金属元素的一个区 ● 包括 “不活泼的单原子气体—稀有气体” ● 无机非金属材料库:C—C复合材料,人造金刚石,半导体硅,分子筛(铝硅酸盐), 高能燃料(N2H4) ● 有毒的小元素群 ● 多有同素异形体 ● 成键的多样性:如乙硼烷的 3c2e 键等 13.1 第 13、第 14 和第 15 族概述 本节介绍硼族、碳族和氮族元素的重要物理和化学特征。 Some properties of group 13 to group 15 elements Element First ionization energy I1/kJ·mol-1 Electronegativity a χ Covalent radius rcov/pm Ionic radius rion/pm Oxidation state b B Al Ga In Tl C Si Ge Sn Pb N P As Sb Bi 899 578 579 558 589 1086 786 760 708 715 1410 1020 953 840 710 2.04 1.61 1.84 1.78 2.04 2.55 1.90 2.01 1.96 2.33 3.04 2.06 2.18 2.05 2.02 85 143 153 167 171 77 117 122 140 175 75 110 122 143 152 - 54 62 80 89 - 40 53 69 92 - - - - - +3 +3 +3, +1 +3, +1 +3, +1 (+4, +2)c +4 +4, +2 +4, +2 +4, +2 +5, +4, +3, +2, +1, -3 +5, +3, -3 +5, +3 +5, +3 +5, +3 a in Pauling scale. b Oxidation numbers in bold type indicate the most stable state(s). c for inorganic compounds of carbon. 周期表中即包括非金属元素又包括金属元素的族只有硼族、碳族和氮族。 ★ 金属性:总的变化规律是由上而下逐渐增强 P区元素的化学以其多样性为特点:
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 2 p 区包括第13 至第 18 共六族元素, 加上新近合成的 114 号、116 号和 118 号在内, 元素总 数共 34 种。该区的 12 个短周期元素(硼、碳、氮、氧、氟、氖和铝、硅、磷、硫、氯、氩)与 s 区的 4 个短周期元素(锂、铍、钠、镁)一起被叫作为典型元素; 包括尚未发现的 3 个元素(Z=113, 115, 117)在内的 24 个长周期元素又叫过渡后元素. p区元素价电子组态为ns 2 np 1~6. 最高氧化态为+3至+8,不再与IUPAC推荐的族序号相一致。 ● 唯一同时包括金属和非金属元素的一个区 ● 包括 “不活泼的单原子气体—稀有气体” ● 无机非金属材料库:C—C复合材料,人造金刚石,半导体硅,分子筛(铝硅酸盐), 高能燃料(N2H4) ● 有毒的小元素群 ● 多有同素异形体 ● 成键的多样性:如乙硼烷的 3c2e 键等 13.1 第 13、第 14 和第 15 族概述 本节介绍硼族、碳族和氮族元素的重要物理和化学特征。 Some properties of group 13 to group 15 elements Element First ionization energy I1/kJ·mol-1 Electronegativity a χ Covalent radius rcov/pm Ionic radius rion/pm Oxidation state b B Al Ga In Tl C Si Ge Sn Pb N P As Sb Bi 899 578 579 558 589 1086 786 760 708 715 1410 1020 953 840 710 2.04 1.61 1.84 1.78 2.04 2.55 1.90 2.01 1.96 2.33 3.04 2.06 2.18 2.05 2.02 85 143 153 167 171 77 117 122 140 175 75 110 122 143 152 - 54 62 80 89 - 40 53 69 92 - - - - - +3 +3 +3, +1 +3, +1 +3, +1 (+4, +2)c +4 +4, +2 +4, +2 +4, +2 +5, +4, +3, +2, +1, -3 +5, +3, -3 +5, +3 +5, +3 +5, +3 a in Pauling scale. b Oxidation numbers in bold type indicate the most stable state(s). c for inorganic compounds of carbon. 周期表中即包括非金属元素又包括金属元素的族只有硼族、碳族和氮族。 ★ 金属性:总的变化规律是由上而下逐渐增强 P区元素的化学以其多样性为特点:
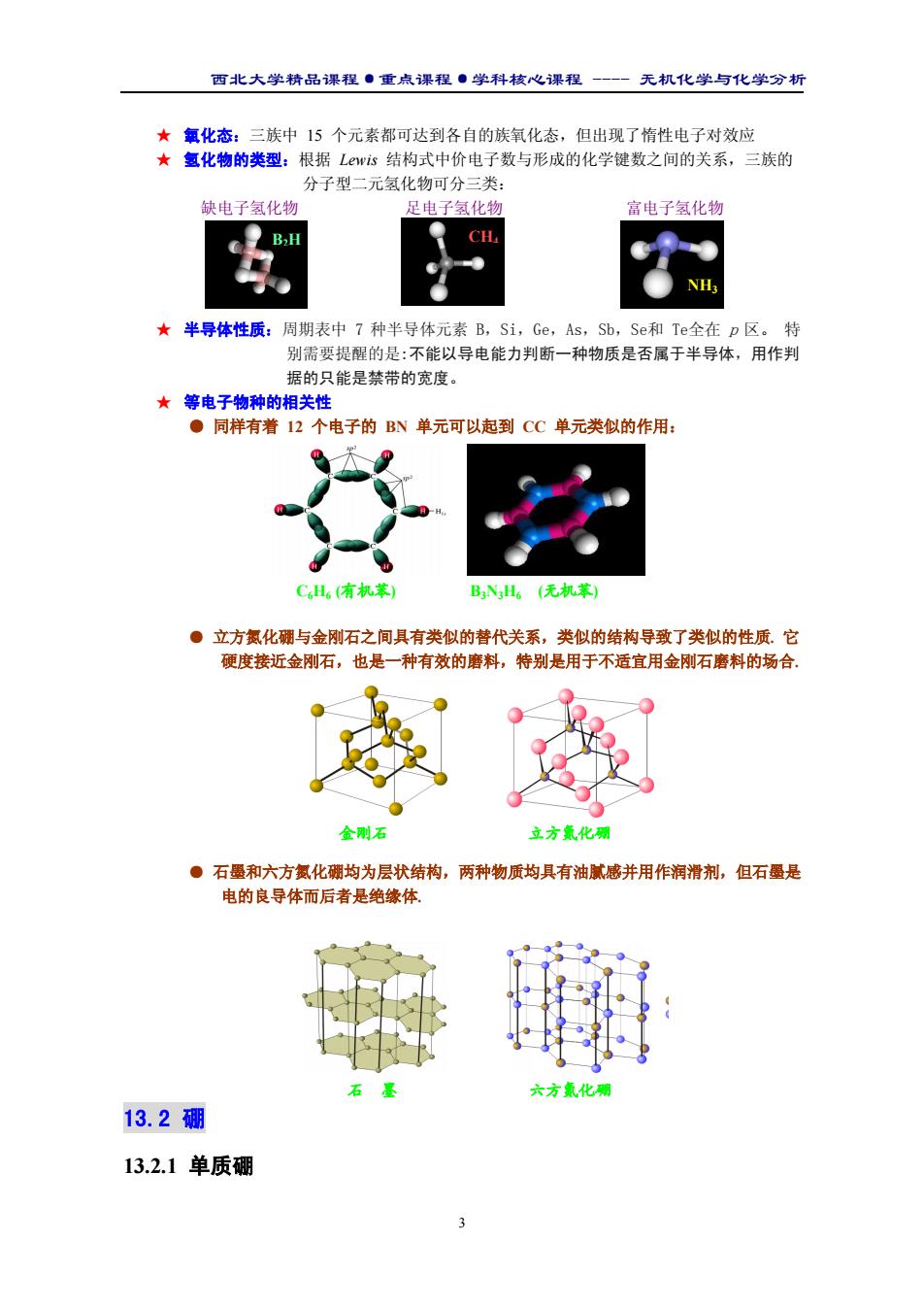
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 3 ★ 氧化态:三族中 15 个元素都可达到各自的族氧化态,但出现了惰性电子对效应 ★ 氢化物的类型:根据 Lewis 结构式中价电子数与形成的化学键数之间的关系,三族的 分子型二元氢化物可分三类: 缺电子氢化物 足电子氢化物 富电子氢化物 缺电子 ★ 半导体性质:周期表中 7 种半导体元素 B,Si,Ge,As,Sb,Se和 Te全在 p 区。 特 别需要提醒的是:不能以导电能力判断一种物质是否属于半导体,用作判 据的只能是禁带的宽度。 ★ 等电子物种的相关性 ● 同样有着 12 个电子的 BN 单元可以起到 CC 单元类似的作用: ● 立方氮化硼与金刚石之间具有类似的替代关系,类似的结构导致了类似的性质. 它 硬度接近金刚石,也是一种有效的磨料,特别是用于不适宜用金刚石磨料的场合. ● 石墨和六方氮化硼均为层状结构,两种物质均具有油腻感并用作润滑剂,但石墨是 电的良导体而后者是绝缘体. 13.2 硼 13.2.1 单质硼 B2H CH4 NH3 C6H6 (有机苯) B3N3H6 (无机苯) 金刚石 立方氮化硼 石 墨 六方氮化硼
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 3 ★ 氧化态:三族中 15 个元素都可达到各自的族氧化态,但出现了惰性电子对效应 ★ 氢化物的类型:根据 Lewis 结构式中价电子数与形成的化学键数之间的关系,三族的 分子型二元氢化物可分三类: 缺电子氢化物 足电子氢化物 富电子氢化物 缺电子 ★ 半导体性质:周期表中 7 种半导体元素 B,Si,Ge,As,Sb,Se和 Te全在 p 区。 特 别需要提醒的是:不能以导电能力判断一种物质是否属于半导体,用作判 据的只能是禁带的宽度。 ★ 等电子物种的相关性 ● 同样有着 12 个电子的 BN 单元可以起到 CC 单元类似的作用: ● 立方氮化硼与金刚石之间具有类似的替代关系,类似的结构导致了类似的性质. 它 硬度接近金刚石,也是一种有效的磨料,特别是用于不适宜用金刚石磨料的场合. ● 石墨和六方氮化硼均为层状结构,两种物质均具有油腻感并用作润滑剂,但石墨是 电的良导体而后者是绝缘体. 13.2 硼 13.2.1 单质硼 B2H CH4 NH3 C6H6 (有机苯) B3N3H6 (无机苯) 金刚石 立方氮化硼 石 墨 六方氮化硼

西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 4 ★ 结构 单质硼有多种同素异形体,而基本结构单元则是 B12 二十面体。 各种不同类型的 晶形硼, 其差别仅在于二十面体连接方式的不同。 ★ 性质 无定形硼比较活泼,室温下即与 F2 反应,与 Cl2, Br2, O2, S 等反应则需加热。 浓 HNO3 或浓 H2SO4 都可以将硼氧化为 H3BO3,硼与碱反应生成偏硼酸盐放出 H2: B(s) + 3 HNO3(aq) H3BO3(aq) + 3 NO2(g) 2 B(s) + 2 NaOH(aq) + 2 H2O(l) 2 NaBO2(aq) + 3 H2(g) ★ 制备 用镁还原 B2O3 可制得单质硼; 将 H2与 BBr3(或 BCl3)的混合气体通过 1 500~1 700 K 的钨丝(或钽丝)可以制得高纯度硼: Δ B2O3(s) + 3 Mg(s) 2 B(s) + 3 MgO(s) 1 500~1 700 K BBr3(g) + 3 H2(g) 2 B(s) + 6 HBr(g) ★ 用途 无定形硼可用于生产硼钢. 硼钢主要用于制造喷气发动机和核反应堆的控制棒。 前一种用途基于其优良的抗冲击性能,后一种用途基于硼吸收中子的能力。 13.2.2 硼酸盐和硼酸 工业上最重要的硼酸盐是四硼酸钠, 它的十水合物(Na2B4O7·10H2O)叫硼砂。 硼酸钠盐的年 耗量约占总硼消耗量的 80%, 其中一半以上用于玻璃、陶瓷和搪瓷工业,其他应用领域包括洗涤 剂组分(过硼酸盐)、微量元素肥料、金属焊剂和纤维素材质的阻燃剂。 硼砂溶于水, 水解使溶液呈强碱性, 化学分析中用作标定标准酸溶液的基准物。 滴定反应 为: Na2B4O7(aq) + 2 HCl(aq) + 5 H2O(l) = 4 H3BO3(aq) + 2 NaCl(aq) 熔化了的硼砂能与某些金属氧化物反应, 生成金属的偏硼酸盐(习惯上叫作硼砂珠)。不同金 属氧化物使硼砂珠显示出不同的颜色, 分析化学应用该性质定性鉴定金属离子。 例如: CoO(s) + Na2B4O7(l) = Co(BO2)2(s, 蓝宝石色) + 2 NaBO2(s) B O O B O O O OH HO HO B B OH 2- B O H O O B O H O B H O B O O O H 2-
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 4 ★ 结构 单质硼有多种同素异形体,而基本结构单元则是 B12 二十面体。 各种不同类型的 晶形硼, 其差别仅在于二十面体连接方式的不同。 ★ 性质 无定形硼比较活泼,室温下即与 F2 反应,与 Cl2, Br2, O2, S 等反应则需加热。 浓 HNO3 或浓 H2SO4 都可以将硼氧化为 H3BO3,硼与碱反应生成偏硼酸盐放出 H2: B(s) + 3 HNO3(aq) H3BO3(aq) + 3 NO2(g) 2 B(s) + 2 NaOH(aq) + 2 H2O(l) 2 NaBO2(aq) + 3 H2(g) ★ 制备 用镁还原 B2O3 可制得单质硼; 将 H2与 BBr3(或 BCl3)的混合气体通过 1 500~1 700 K 的钨丝(或钽丝)可以制得高纯度硼: Δ B2O3(s) + 3 Mg(s) 2 B(s) + 3 MgO(s) 1 500~1 700 K BBr3(g) + 3 H2(g) 2 B(s) + 6 HBr(g) ★ 用途 无定形硼可用于生产硼钢. 硼钢主要用于制造喷气发动机和核反应堆的控制棒。 前一种用途基于其优良的抗冲击性能,后一种用途基于硼吸收中子的能力。 13.2.2 硼酸盐和硼酸 工业上最重要的硼酸盐是四硼酸钠, 它的十水合物(Na2B4O7·10H2O)叫硼砂。 硼酸钠盐的年 耗量约占总硼消耗量的 80%, 其中一半以上用于玻璃、陶瓷和搪瓷工业,其他应用领域包括洗涤 剂组分(过硼酸盐)、微量元素肥料、金属焊剂和纤维素材质的阻燃剂。 硼砂溶于水, 水解使溶液呈强碱性, 化学分析中用作标定标准酸溶液的基准物。 滴定反应 为: Na2B4O7(aq) + 2 HCl(aq) + 5 H2O(l) = 4 H3BO3(aq) + 2 NaCl(aq) 熔化了的硼砂能与某些金属氧化物反应, 生成金属的偏硼酸盐(习惯上叫作硼砂珠)。不同金 属氧化物使硼砂珠显示出不同的颜色, 分析化学应用该性质定性鉴定金属离子。 例如: CoO(s) + Na2B4O7(l) = Co(BO2)2(s, 蓝宝石色) + 2 NaBO2(s) B O O B O O O OH HO HO B B OH 2- B O H O O B O H O B H O B O O O H 2-

西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 5 Cr2O3(s) + 3 Na2B4O7(l) = 2 Cr(BO2)3(s, 绿色) + 6 NaBO2(s) 与化学式 H3BO3 所暗示的不同, 硼酸在水中是个一元酸。 这是因为在 H3BO3 分子中, 未满 8 电子结构的 B 原子能接受 H2O 分子中 O 原子的孤对电子形成配位键,同时将这个 H2O 分子的 一个质子转移给一个溶剂 H2O 分子: B(OH)3(aq) + 2 H2O(l) = [B(OH)4] - (aq) + H3O+ (aq) pKa ○一 = 9.2 pKa ○一值表明 H3BO3 的酸性极弱,用 NaOH 直接滴定时很难观察到滴定终点. 如果滴定前加入多 羟基化合物(如甘露醇、甘油), H3BO3 则与这类化合物反应生成稳定的配合物, 并将 H3O+ 电离出 来,从而使滴定法可用于测定硼含量. OH HO-CH2 O-CH2 - ∕ ∣ ∕ ∣ HO-B + HO-CH2 O-B C(OH)H + H3O + H2O \ ∣ \ ∣ OH HO-CH2 O-CH2 有浓 H2SO4 存在时, H3BO3 与甲醇或乙醇反应生成挥发性硼酸酯. 硼酸酯燃烧发出的绿色火 焰用来鉴定硼酸根的存在. 3 C2H5OH(aq) + H3BO3(aq) = B(OC2H5)3(aq) + 3 H2O(l) H3BO3 在冷水中溶解度很小,在热水中却是易溶的。 这意味着, 可通过水溶液中重结晶的 方法提纯,也说明它含有氢键。 13.2.3 硼的三卤化物 三卤化硼是一类非常重要的化合物。 作为有代表性的路易斯酸, 我们曾经介绍过 BF3 这个 重要的有机反应催化剂。 三卤化硼都是熔点、沸点较低的共价化合物。 BF3 和 BCl3 在通常条 件下是气体,BBr3 和 BI3分别是挥发性液体和固体,性质的这种变化趋势与分子间色散力的变化 趋势相一致。 Some properties of boron halides, BX3 BX3 melting point, t/℃ boiling point, t/℃ △fG○一 m/kJ·mol-1 BF3 BCl3 BBr3 BI3 -127 -107 -46 49 -100 12 91 210 -1112 -339 -232 21 由表可知,除 BI3 以外, 其余 BX3 的△fG○一 m值均为负值. 这意味着, 这三种 BX3 可由卤素与元 素硼直接合成. 不过, BF3 的制备更多采用下述反应: B2O3(s) + 3 CaF2(s) + 6 H2SO4(l) = 2 BF3(g) + 3 [H3O]+ [HSO4] - (soln) + 3 CaSO4(s) 制备 BCl3 可采用元素硼与氯化氢的反应, 或者在还原剂存在下以 B2O3 为起始物的氯化反 应: △ 2 B(s) + 6 HCl(g) 2 BCl3(g) + 3 H2(g) △
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 5 Cr2O3(s) + 3 Na2B4O7(l) = 2 Cr(BO2)3(s, 绿色) + 6 NaBO2(s) 与化学式 H3BO3 所暗示的不同, 硼酸在水中是个一元酸。 这是因为在 H3BO3 分子中, 未满 8 电子结构的 B 原子能接受 H2O 分子中 O 原子的孤对电子形成配位键,同时将这个 H2O 分子的 一个质子转移给一个溶剂 H2O 分子: B(OH)3(aq) + 2 H2O(l) = [B(OH)4] - (aq) + H3O+ (aq) pKa ○一 = 9.2 pKa ○一值表明 H3BO3 的酸性极弱,用 NaOH 直接滴定时很难观察到滴定终点. 如果滴定前加入多 羟基化合物(如甘露醇、甘油), H3BO3 则与这类化合物反应生成稳定的配合物, 并将 H3O+ 电离出 来,从而使滴定法可用于测定硼含量. OH HO-CH2 O-CH2 - ∕ ∣ ∕ ∣ HO-B + HO-CH2 O-B C(OH)H + H3O + H2O \ ∣ \ ∣ OH HO-CH2 O-CH2 有浓 H2SO4 存在时, H3BO3 与甲醇或乙醇反应生成挥发性硼酸酯. 硼酸酯燃烧发出的绿色火 焰用来鉴定硼酸根的存在. 3 C2H5OH(aq) + H3BO3(aq) = B(OC2H5)3(aq) + 3 H2O(l) H3BO3 在冷水中溶解度很小,在热水中却是易溶的。 这意味着, 可通过水溶液中重结晶的 方法提纯,也说明它含有氢键。 13.2.3 硼的三卤化物 三卤化硼是一类非常重要的化合物。 作为有代表性的路易斯酸, 我们曾经介绍过 BF3 这个 重要的有机反应催化剂。 三卤化硼都是熔点、沸点较低的共价化合物。 BF3 和 BCl3 在通常条 件下是气体,BBr3 和 BI3分别是挥发性液体和固体,性质的这种变化趋势与分子间色散力的变化 趋势相一致。 Some properties of boron halides, BX3 BX3 melting point, t/℃ boiling point, t/℃ △fG○一 m/kJ·mol-1 BF3 BCl3 BBr3 BI3 -127 -107 -46 49 -100 12 91 210 -1112 -339 -232 21 由表可知,除 BI3 以外, 其余 BX3 的△fG○一 m值均为负值. 这意味着, 这三种 BX3 可由卤素与元 素硼直接合成. 不过, BF3 的制备更多采用下述反应: B2O3(s) + 3 CaF2(s) + 6 H2SO4(l) = 2 BF3(g) + 3 [H3O]+ [HSO4] - (soln) + 3 CaSO4(s) 制备 BCl3 可采用元素硼与氯化氢的反应, 或者在还原剂存在下以 B2O3 为起始物的氯化反 应: △ 2 B(s) + 6 HCl(g) 2 BCl3(g) + 3 H2(g) △