
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 Chapter 10 Conditional stability constant and complexometric titration 教学要求 1. 了解分析化学中 EDTA 及其螯合物的分析特性; 2. 掌握络合平衡的副反应系数和条件稳定常数的计算; 3. 了解金属离子指示剂的作用原理、指示剂的选择原则及常用的金属离子指示剂 的使用条件; 4. 熟悉络合滴定曲线、化学计量点和滴定突跃; 5. 了解络合滴定的应用及计算。 课时分配(8 学时) 1. EDTA:络合滴定最重要的滴定剂,条件稳定常数(3 学时) 逐级稳定常数,不稳定常数,累积稳定常数,副反应系数,酸效应和酸效应系数, 条件稳定常数 2. 络合滴定原理,滴定干扰的消除 (3 学时) 金属指示剂,络合滴定曲线,突跃,滴定干扰及消除,掩蔽和络合掩蔽剂 3. 络合滴定方式 (2 学时) 返滴定,置换滴定 以络合剂与金属离子间的络合物形成反应为基础的滴定叫络合滴定(complexometric titration or complexometry)。沉淀滴定和络合滴定都看作是酸碱滴定, 即广义酸和广义碱之 间的滴定。 10.1 EDTA:络合滴定最重要的滴定剂 EDTA是乙二胺四乙酸(ethylenediamine tetraacetic acid)的英文缩写,通常用H4Y代表其化 学式。H4Y 本身在水中的溶解度不大(295K 时, 每 100g 水中 溶解 0.02 g), 作为滴定剂常用其二钠盐 Na2H2Y·2H2O(295K 时, 每 100g 水中溶解 11.1 g)。图 10.1 给出了 EDTA 负四价 阴离子(Y4-)的结构, 它以其 2 个氨基氮原子和 4 个羧基氧原 Figure 10.1 The anion of EDTA 第10章 条件稳定常数和络 合滴定
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 Chapter 10 Conditional stability constant and complexometric titration 教学要求 1. 了解分析化学中 EDTA 及其螯合物的分析特性; 2. 掌握络合平衡的副反应系数和条件稳定常数的计算; 3. 了解金属离子指示剂的作用原理、指示剂的选择原则及常用的金属离子指示剂 的使用条件; 4. 熟悉络合滴定曲线、化学计量点和滴定突跃; 5. 了解络合滴定的应用及计算。 课时分配(8 学时) 1. EDTA:络合滴定最重要的滴定剂,条件稳定常数(3 学时) 逐级稳定常数,不稳定常数,累积稳定常数,副反应系数,酸效应和酸效应系数, 条件稳定常数 2. 络合滴定原理,滴定干扰的消除 (3 学时) 金属指示剂,络合滴定曲线,突跃,滴定干扰及消除,掩蔽和络合掩蔽剂 3. 络合滴定方式 (2 学时) 返滴定,置换滴定 以络合剂与金属离子间的络合物形成反应为基础的滴定叫络合滴定(complexometric titration or complexometry)。沉淀滴定和络合滴定都看作是酸碱滴定, 即广义酸和广义碱之 间的滴定。 10.1 EDTA:络合滴定最重要的滴定剂 EDTA是乙二胺四乙酸(ethylenediamine tetraacetic acid)的英文缩写,通常用H4Y代表其化 学式。H4Y 本身在水中的溶解度不大(295K 时, 每 100g 水中 溶解 0.02 g), 作为滴定剂常用其二钠盐 Na2H2Y·2H2O(295K 时, 每 100g 水中溶解 11.1 g)。图 10.1 给出了 EDTA 负四价 阴离子(Y4-)的结构, 它以其 2 个氨基氮原子和 4 个羧基氧原 Figure 10.1 The anion of EDTA 第10章 条件稳定常数和络 合滴定
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 子与金属离子配位形成六齿配位的螯合物。EDTA 在络合滴定中得到广泛应用, 是基于与金 属离子形成的螯合物具有以下特点: 1. 普遍性 由于结构中存在6个可以提供孤对电子的配位原子, EDTA几乎能与所有 金属离子形成稳定的螯合物。 2. 组成确定 大多数金属离子的配合物中, 金属与 EDTA 按 1:1 配位, 计算十分方 便。 3. 可溶性 EDTA 与金属离子形成的配合物易溶于水。 4. 稳定性高 EDTA 与大多数金属离子形成的螯合物很稳定(表 10.1)。 Table 10.1 Stability constants for some Mn+- EDTA complex ions (293 K) Mn+ lg K○一f Mn+ lg K○一f Mn+ lg K○一f Na+ Li+ Ba2+ Sr2+ Mg2+ Ca2+ Mn2+ Fe2+ 1.66 2.79 2.76 8.63 8.69 10.69 14.04 14.33 Ce3+ Al3+ Co2+ Cd2+ Zn2+ Pb2+ Y3+ Ni2+ 15.98 16.10 16.31 16.46 16.50 18.04 18.09 18.67 Cu2+ Hg2+ Cr3+ Th4+ Fe3+ V3+ Bi3+ 18.80 21.80 23.00 23.20 25.10 25.90 27.94 10.2 条件稳定常数 10.2.1 条件稳定常数的概念 EDTA 滴定金属离子的反应为: Mn+ + Y4- [MY]n-4 (10.1) 为书写方便,通常略去离子(包括络离子)的电荷: M + Y MY 反应的标准平衡常数(即络合物 MY 的稳定常数)为: {c(MY)/mol·dm-3} K○一 f (MY) = —————————————— (10.2) {c(M)/mol·dm-3}{c(Y)/mol·dm-3} 式(10.1)这个路易斯酸碱反应是进行滴定的反应,式(10.2)的稳定常数是滴定反应的标准 平衡常数。由表 10.1 中给出的标准平衡常数数据可以看出,除 NaY3-、LiY3-和 BaY2-外,其 余络离子的数值都很大。这一事实意味着,大多数金属离子的络合物形成反应可以定量完成, 可以用作滴定反应。 问题在于,滴定并不在标准平衡常数所要求的条件下进行。不同的滴定条件下还可能 存在某些副反应, 副反应的存在使稳定常数不再是标准平衡常数, 将其叫作条件稳定常数 (conditional stability constant)。一个络合物形成反应能否用作滴定反应,是由条件稳定常数
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 子与金属离子配位形成六齿配位的螯合物。EDTA 在络合滴定中得到广泛应用, 是基于与金 属离子形成的螯合物具有以下特点: 1. 普遍性 由于结构中存在6个可以提供孤对电子的配位原子, EDTA几乎能与所有 金属离子形成稳定的螯合物。 2. 组成确定 大多数金属离子的配合物中, 金属与 EDTA 按 1:1 配位, 计算十分方 便。 3. 可溶性 EDTA 与金属离子形成的配合物易溶于水。 4. 稳定性高 EDTA 与大多数金属离子形成的螯合物很稳定(表 10.1)。 Table 10.1 Stability constants for some Mn+- EDTA complex ions (293 K) Mn+ lg K○一f Mn+ lg K○一f Mn+ lg K○一f Na+ Li+ Ba2+ Sr2+ Mg2+ Ca2+ Mn2+ Fe2+ 1.66 2.79 2.76 8.63 8.69 10.69 14.04 14.33 Ce3+ Al3+ Co2+ Cd2+ Zn2+ Pb2+ Y3+ Ni2+ 15.98 16.10 16.31 16.46 16.50 18.04 18.09 18.67 Cu2+ Hg2+ Cr3+ Th4+ Fe3+ V3+ Bi3+ 18.80 21.80 23.00 23.20 25.10 25.90 27.94 10.2 条件稳定常数 10.2.1 条件稳定常数的概念 EDTA 滴定金属离子的反应为: Mn+ + Y4- [MY]n-4 (10.1) 为书写方便,通常略去离子(包括络离子)的电荷: M + Y MY 反应的标准平衡常数(即络合物 MY 的稳定常数)为: {c(MY)/mol·dm-3} K○一 f (MY) = —————————————— (10.2) {c(M)/mol·dm-3}{c(Y)/mol·dm-3} 式(10.1)这个路易斯酸碱反应是进行滴定的反应,式(10.2)的稳定常数是滴定反应的标准 平衡常数。由表 10.1 中给出的标准平衡常数数据可以看出,除 NaY3-、LiY3-和 BaY2-外,其 余络离子的数值都很大。这一事实意味着,大多数金属离子的络合物形成反应可以定量完成, 可以用作滴定反应。 问题在于,滴定并不在标准平衡常数所要求的条件下进行。不同的滴定条件下还可能 存在某些副反应, 副反应的存在使稳定常数不再是标准平衡常数, 将其叫作条件稳定常数 (conditional stability constant)。一个络合物形成反应能否用作滴定反应,是由条件稳定常数
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 决定的。溶液酸度是影响滴定的最重要的条件, 本章只介绍不同酸度条件下的条件稳定常 数。 10.2.2 EDTA 的酸效应 1. EDTA 的离解平衡 EDTA(H4Y)在高酸度溶液中以 H6Y2+的形式存在, 多出的两个 质子分别键合于两个氨基 N 原子上(注意, N 原子上有孤对电子)。六元酸 H6Y2+在水溶液中 存在六级电离平衡: H6Y2+(aq) + H2O(l) H3O+ + H5Y+ (aq) H5Y+ (aq) + H2O(l) H3O+ + H4Y(aq) H4Y(aq) + H2O(l) H3O+ + H3Y- (aq) H3Y- (aq) + H2O(l) H3O+ + H2Y2-(aq) H2Y2-(aq) + H2O(l) H3O+ + HY3-(aq) HY3-(aq) + H2O(l) H3O+ + Y4-(aq) K○一 1 = 10-0.9 K○一 2 = 10-1.6 K○一 3 = 10-2.07 K○一 4 = 10-2.75 K○一 5 = 10-6.42 K○一 6 = 10-10.34 上述电离平衡表明, EDTA 在水溶液中总是以 H6Y2+,H5Y+ ,H4Y,H3Y- , H2Y2-,HY3- 和 Y4-等 7 种型体存在。各型体浓度随溶液 pH 值变化而变化, 您可以想象, c(H6Y2+)随 pH 值 升高而下降, c(Y4+)随 pH 值升高而上升, 其他 5 种形体的浓度随 pH 值升高先升后降。图 8.2 中我们看到过 H2C2O4 类似的变化趋势。 2. EDTA 的酸效应和酸效应系数 Y4-与 H3O+ 离子发生如下反应: Y4-(aq) + H3O+ (aq) HY3-(aq) + H2O(l) (10.3) 该副反应消耗了部分 Y4-离子, 导致 EDTA 参加主反应(10.1)的能力下降, 这一现象叫作 EDTA 的酸效应。酸效应的大小用酸效应系数 a(EDTA)衡量: c(EDTA) a(EDTA) = ————— c(Y4-) 式中 c(EDTA)是平衡系统中未参与配位的 EDTA 各型体浓度之和,c(Y4-)是 Y4-离子的平衡浓 度。酸效应系数只与溶液的酸度有关, 溶液的酸度越高(c(Y4-)值越小), 酸效应系数越大。表 10.2 给出不同 pH 溶液中的 lg a(EDTA)。 Table 10.2 lg a(EDTA) values as a function of pH pH lg a(EDTA) pH lg a(EDTA) 0.0 1.0 2.0 3.0 4.0 5.0 6.0 23.64 18.01 13.51 10.60 8.44 6.60 4.65 7.0 8.0 9.0 10.0 11.0 12.0 3.32 2.26 1.29 0.45 0.07 0.00
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 决定的。溶液酸度是影响滴定的最重要的条件, 本章只介绍不同酸度条件下的条件稳定常 数。 10.2.2 EDTA 的酸效应 1. EDTA 的离解平衡 EDTA(H4Y)在高酸度溶液中以 H6Y2+的形式存在, 多出的两个 质子分别键合于两个氨基 N 原子上(注意, N 原子上有孤对电子)。六元酸 H6Y2+在水溶液中 存在六级电离平衡: H6Y2+(aq) + H2O(l) H3O+ + H5Y+ (aq) H5Y+ (aq) + H2O(l) H3O+ + H4Y(aq) H4Y(aq) + H2O(l) H3O+ + H3Y- (aq) H3Y- (aq) + H2O(l) H3O+ + H2Y2-(aq) H2Y2-(aq) + H2O(l) H3O+ + HY3-(aq) HY3-(aq) + H2O(l) H3O+ + Y4-(aq) K○一 1 = 10-0.9 K○一 2 = 10-1.6 K○一 3 = 10-2.07 K○一 4 = 10-2.75 K○一 5 = 10-6.42 K○一 6 = 10-10.34 上述电离平衡表明, EDTA 在水溶液中总是以 H6Y2+,H5Y+ ,H4Y,H3Y- , H2Y2-,HY3- 和 Y4-等 7 种型体存在。各型体浓度随溶液 pH 值变化而变化, 您可以想象, c(H6Y2+)随 pH 值 升高而下降, c(Y4+)随 pH 值升高而上升, 其他 5 种形体的浓度随 pH 值升高先升后降。图 8.2 中我们看到过 H2C2O4 类似的变化趋势。 2. EDTA 的酸效应和酸效应系数 Y4-与 H3O+ 离子发生如下反应: Y4-(aq) + H3O+ (aq) HY3-(aq) + H2O(l) (10.3) 该副反应消耗了部分 Y4-离子, 导致 EDTA 参加主反应(10.1)的能力下降, 这一现象叫作 EDTA 的酸效应。酸效应的大小用酸效应系数 a(EDTA)衡量: c(EDTA) a(EDTA) = ————— c(Y4-) 式中 c(EDTA)是平衡系统中未参与配位的 EDTA 各型体浓度之和,c(Y4-)是 Y4-离子的平衡浓 度。酸效应系数只与溶液的酸度有关, 溶液的酸度越高(c(Y4-)值越小), 酸效应系数越大。表 10.2 给出不同 pH 溶液中的 lg a(EDTA)。 Table 10.2 lg a(EDTA) values as a function of pH pH lg a(EDTA) pH lg a(EDTA) 0.0 1.0 2.0 3.0 4.0 5.0 6.0 23.64 18.01 13.51 10.60 8.44 6.60 4.65 7.0 8.0 9.0 10.0 11.0 12.0 3.32 2.26 1.29 0.45 0.07 0.00

西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 10.2.3 与酸效应有关的条件稳定常数 由表 10.2 可知,pH≥12.0 时, a(EDTA) = 1, 即 c(Y4-) = c(EDTA)/1 = c(EDTA) 或者说, 平衡系统中存在的 EDTA 几乎全部以 Y4-这种型体存在。 当 pH 值低于 12.0 时,表 10.1 中的稳定常数数据已不再反映实际平衡状态, 显然需要寻 求特定 pH 条件下的平衡常数了。这种在特定 pH 条件下的平衡常数就是一种条件平衡常数, 符号为 K(MY’)。“’”加在 Y 的右上角, 表示相关的副反应是 Y 发生的副反应(见反应 10.3), 而不是金属离子 M 发生的副反应。 K(MY’)与 K○一 f(MY)的关系为: 1 K(MY’) = K○一 f(MY) × ————— (10.4) a(EDTA) 或 lgK(MY’) = lgK○一 f(MY)-lga(EDTA) (10.5) 【例题 10.1】由 BiY- 的标准稳定常数计算 pH=0.0 时的条件稳定常数 lgK(BiY’)。 解答: 由表 10.1 和表 10.2 查得: lg K一○f (BiY) = 27.94, lga(EDTA) = 23.64 代入式(10.5)得:lgK(BiY’) = 27.94 - 23.64 = 4.30 4. EDTA 的酸效应曲线 上例的计算表明, 酸度升高至一定程度时, 表 10.1 中稳定性 最大的络合物 BiY- 也变得如此不稳定, 以致不再能用 EDTA 滴定 Bi3+。为了适于滴定, 只能 让 K(MY’)等于或者高于某一最小值。 反应能否用于滴定不但与条件平衡常数有关,而且与被滴定金属离子的浓度有关。通 常将式(10.6)作为 EDTA 准确滴定单一金属离子的判别式: lg[{c(M)/mol·dm-3}·K(MY’)]≥6.0 (10.6) 式中的 c(M)代表被滴定金属离子的浓度。如果 c(M) = 0.01 mol·dm-3,上述判别式可写为: lgK(MY’)≥8.0 (10.7) 该式的含义是,滴定浓度为 0.01 mol·dm-3 的金属离子时,条件稳定常数的最小值为 8.0。 尽管 K(MY’)的最小值对所有金属离子的滴定都相同,但与之对应的 pH 值却各不不同。 由式(10.5)和式(10.7)可计算相应的 lga(EDTA),进而由表 10.2 查得能用于进行滴定的最低 pH 值。 【例题 10.2】 试计算 EDTA 络合滴定法滴定 Zn2+离子的最低 pH 值。 解答: (1) 将表 10.1 中查得的 lgK○一f(MY)值和条件式(10.7)限定的 lgK(MY’)值代入式(10.5)得: 8.0 = 16.5-lga(EDTA) lga(EDTA) = 16.5-8.0 = 8.5 (2) 由表 10.2 查得对应的 pH 值约为 4.0。这意味着, pH 值低于 4.0 时, 不能用 EDTA 准确滴定 Zn2+离子。 以最低 pH 值对 lgK○一 f(MY)或对 lga(EDTA)作图, 得到的曲线叫酸效应曲线或林邦曲线
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 10.2.3 与酸效应有关的条件稳定常数 由表 10.2 可知,pH≥12.0 时, a(EDTA) = 1, 即 c(Y4-) = c(EDTA)/1 = c(EDTA) 或者说, 平衡系统中存在的 EDTA 几乎全部以 Y4-这种型体存在。 当 pH 值低于 12.0 时,表 10.1 中的稳定常数数据已不再反映实际平衡状态, 显然需要寻 求特定 pH 条件下的平衡常数了。这种在特定 pH 条件下的平衡常数就是一种条件平衡常数, 符号为 K(MY’)。“’”加在 Y 的右上角, 表示相关的副反应是 Y 发生的副反应(见反应 10.3), 而不是金属离子 M 发生的副反应。 K(MY’)与 K○一 f(MY)的关系为: 1 K(MY’) = K○一 f(MY) × ————— (10.4) a(EDTA) 或 lgK(MY’) = lgK○一 f(MY)-lga(EDTA) (10.5) 【例题 10.1】由 BiY- 的标准稳定常数计算 pH=0.0 时的条件稳定常数 lgK(BiY’)。 解答: 由表 10.1 和表 10.2 查得: lg K一○f (BiY) = 27.94, lga(EDTA) = 23.64 代入式(10.5)得:lgK(BiY’) = 27.94 - 23.64 = 4.30 4. EDTA 的酸效应曲线 上例的计算表明, 酸度升高至一定程度时, 表 10.1 中稳定性 最大的络合物 BiY- 也变得如此不稳定, 以致不再能用 EDTA 滴定 Bi3+。为了适于滴定, 只能 让 K(MY’)等于或者高于某一最小值。 反应能否用于滴定不但与条件平衡常数有关,而且与被滴定金属离子的浓度有关。通 常将式(10.6)作为 EDTA 准确滴定单一金属离子的判别式: lg[{c(M)/mol·dm-3}·K(MY’)]≥6.0 (10.6) 式中的 c(M)代表被滴定金属离子的浓度。如果 c(M) = 0.01 mol·dm-3,上述判别式可写为: lgK(MY’)≥8.0 (10.7) 该式的含义是,滴定浓度为 0.01 mol·dm-3 的金属离子时,条件稳定常数的最小值为 8.0。 尽管 K(MY’)的最小值对所有金属离子的滴定都相同,但与之对应的 pH 值却各不不同。 由式(10.5)和式(10.7)可计算相应的 lga(EDTA),进而由表 10.2 查得能用于进行滴定的最低 pH 值。 【例题 10.2】 试计算 EDTA 络合滴定法滴定 Zn2+离子的最低 pH 值。 解答: (1) 将表 10.1 中查得的 lgK○一f(MY)值和条件式(10.7)限定的 lgK(MY’)值代入式(10.5)得: 8.0 = 16.5-lga(EDTA) lga(EDTA) = 16.5-8.0 = 8.5 (2) 由表 10.2 查得对应的 pH 值约为 4.0。这意味着, pH 值低于 4.0 时, 不能用 EDTA 准确滴定 Zn2+离子。 以最低 pH 值对 lgK○一 f(MY)或对 lga(EDTA)作图, 得到的曲线叫酸效应曲线或林邦曲线
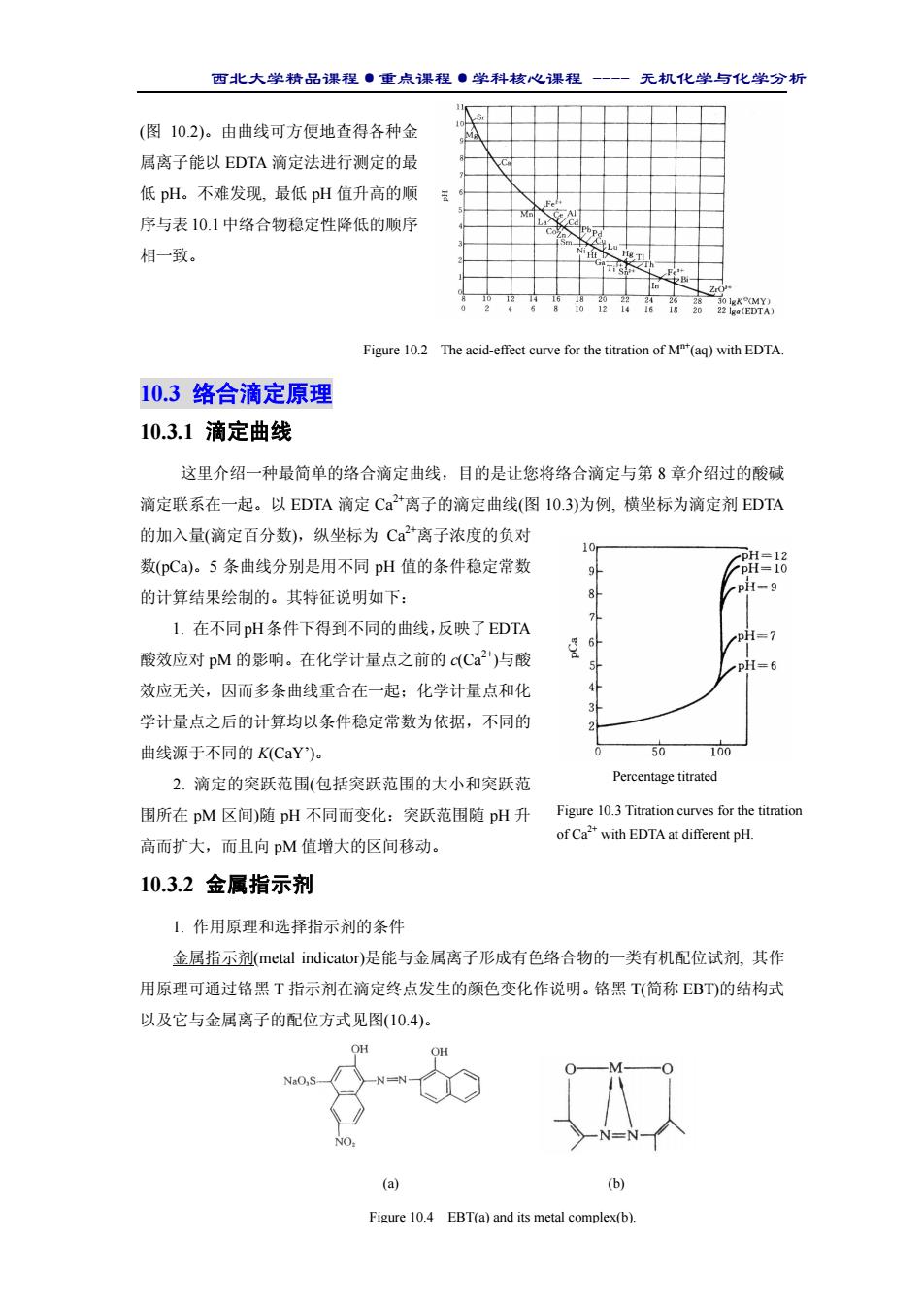
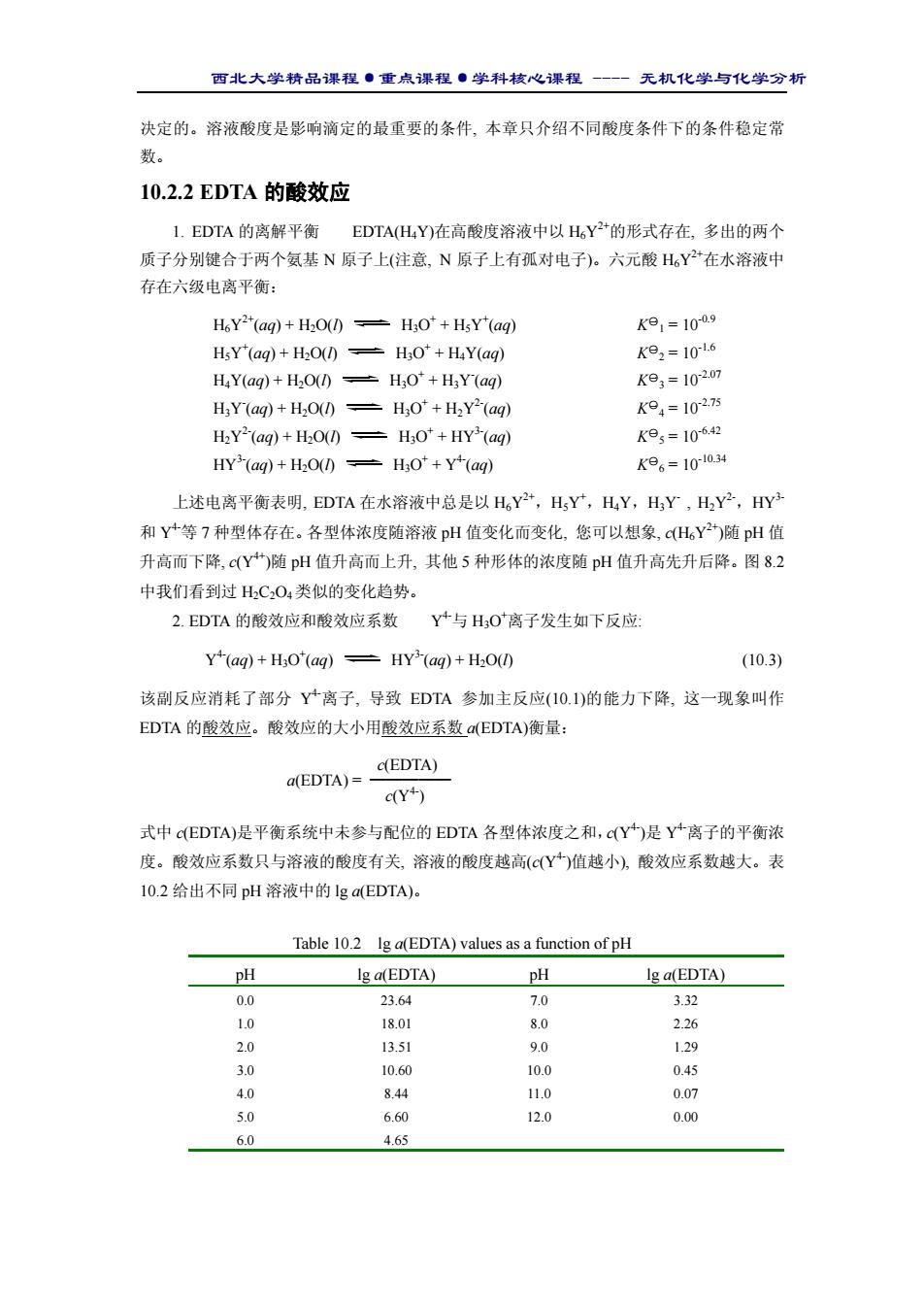
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 (图 10.2)。由曲线可方便地查得各种金 属离子能以 EDTA 滴定法进行测定的最 低 pH。不难发现, 最低 pH 值升高的顺 序与表10.1中络合物稳定性降低的顺序 相一致。 Figure 10.2 The acid-effect curve for the titration of Mn+(aq) with EDTA. 10.3 络合滴定原理 10.3.1 滴定曲线 这里介绍一种最简单的络合滴定曲线,目的是让您将络合滴定与第 8 章介绍过的酸碱 滴定联系在一起。以 EDTA 滴定 Ca2+离子的滴定曲线(图 10.3)为例, 横坐标为滴定剂 EDTA 的加入量(滴定百分数),纵坐标为 Ca2+离子浓度的负对 数(pCa)。5 条曲线分别是用不同 pH 值的条件稳定常数 的计算结果绘制的。其特征说明如下: 1. 在不同pH条件下得到不同的曲线,反映了EDTA 酸效应对 pM 的影响。在化学计量点之前的 c(Ca2+)与酸 效应无关,因而多条曲线重合在一起;化学计量点和化 学计量点之后的计算均以条件稳定常数为依据,不同的 曲线源于不同的 K(CaY’)。 2. 滴定的突跃范围(包括突跃范围的大小和突跃范 围所在 pM 区间)随 pH 不同而变化:突跃范围随 pH 升 高而扩大,而且向 pM 值增大的区间移动。 10.3.2 金属指示剂 1. 作用原理和选择指示剂的条件 金属指示剂(metal indicator)是能与金属离子形成有色络合物的一类有机配位试剂, 其作 用原理可通过铬黑 T 指示剂在滴定终点发生的颜色变化作说明。铬黑 T(简称 EBT)的结构式 以及它与金属离子的配位方式见图(10.4)。 Percentage titrated Figure 10.3 Titration curves for the titration of Ca2+ with EDTA at different pH. (a) (b) Figure 10.4 EBT(a) and its metal complex(b)
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 (图 10.2)。由曲线可方便地查得各种金 属离子能以 EDTA 滴定法进行测定的最 低 pH。不难发现, 最低 pH 值升高的顺 序与表10.1中络合物稳定性降低的顺序 相一致。 Figure 10.2 The acid-effect curve for the titration of Mn+(aq) with EDTA. 10.3 络合滴定原理 10.3.1 滴定曲线 这里介绍一种最简单的络合滴定曲线,目的是让您将络合滴定与第 8 章介绍过的酸碱 滴定联系在一起。以 EDTA 滴定 Ca2+离子的滴定曲线(图 10.3)为例, 横坐标为滴定剂 EDTA 的加入量(滴定百分数),纵坐标为 Ca2+离子浓度的负对 数(pCa)。5 条曲线分别是用不同 pH 值的条件稳定常数 的计算结果绘制的。其特征说明如下: 1. 在不同pH条件下得到不同的曲线,反映了EDTA 酸效应对 pM 的影响。在化学计量点之前的 c(Ca2+)与酸 效应无关,因而多条曲线重合在一起;化学计量点和化 学计量点之后的计算均以条件稳定常数为依据,不同的 曲线源于不同的 K(CaY’)。 2. 滴定的突跃范围(包括突跃范围的大小和突跃范 围所在 pM 区间)随 pH 不同而变化:突跃范围随 pH 升 高而扩大,而且向 pM 值增大的区间移动。 10.3.2 金属指示剂 1. 作用原理和选择指示剂的条件 金属指示剂(metal indicator)是能与金属离子形成有色络合物的一类有机配位试剂, 其作 用原理可通过铬黑 T 指示剂在滴定终点发生的颜色变化作说明。铬黑 T(简称 EBT)的结构式 以及它与金属离子的配位方式见图(10.4)。 Percentage titrated Figure 10.3 Titration curves for the titration of Ca2+ with EDTA at different pH. (a) (b) Figure 10.4 EBT(a) and its metal complex(b)