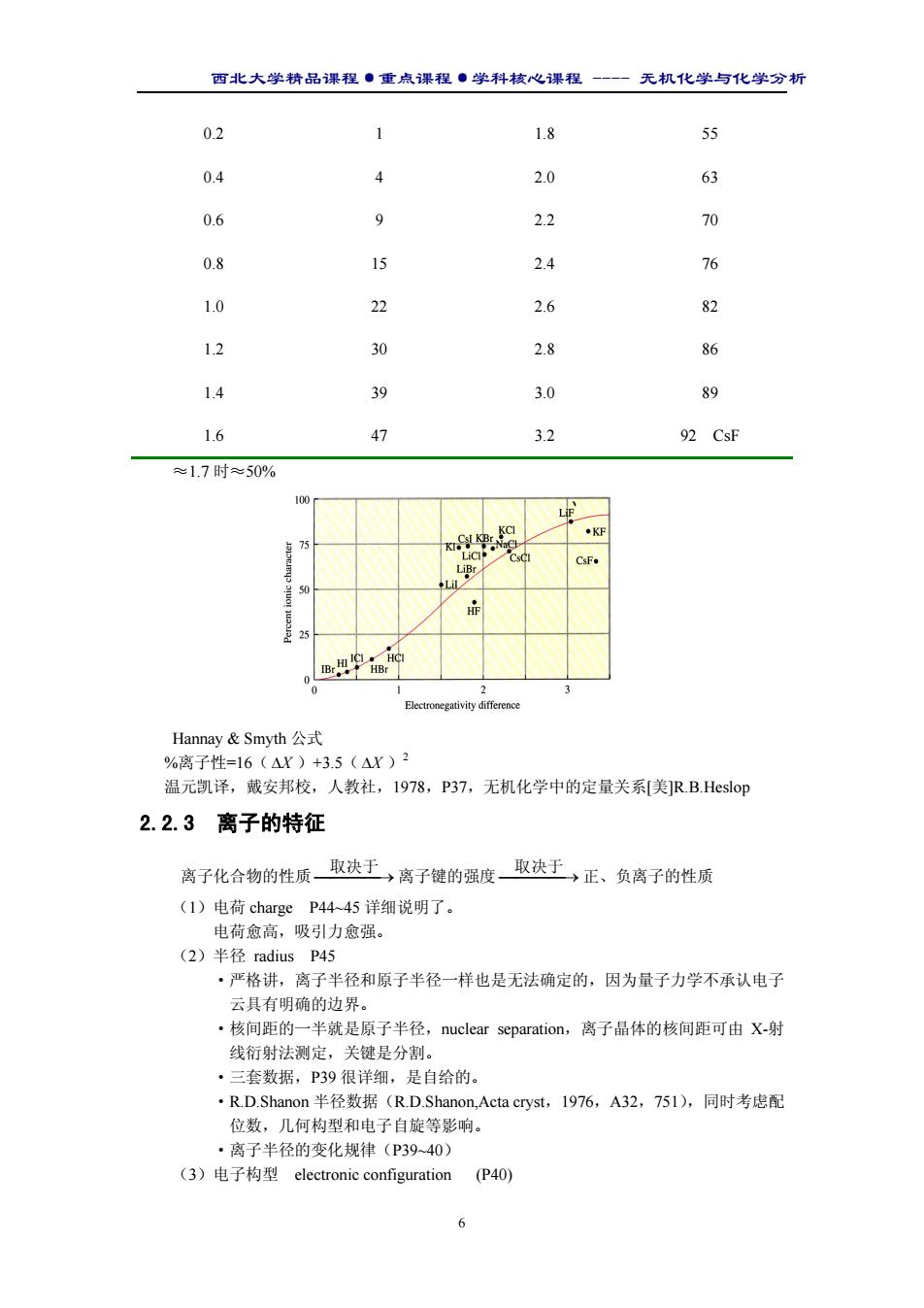
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 6 0.2 1 1.8 55 0.4 4 2.0 63 0.6 9 2.2 70 0.8 15 2.4 76 1.0 22 2.6 82 1.2 30 2.8 86 1.4 39 3.0 89 1.6 47 3.2 92 CsF ≈1.7 时≈50% Hannay & Smyth 公式 %离子性=16( ∆X )+3.5( ∆X )2 温元凯译,戴安邦校,人教社,1978,P37,无机化学中的定量关系[美]R.B.Heslop 2.2.3 离子的特征 离子化合物的性质 → 取决于 离子键的强度 → 取决于 正、负离子的性质 (1)电荷 charge P44~45 详细说明了。 电荷愈高,吸引力愈强。 (2)半径 radius P45 ·严格讲,离子半径和原子半径一样也是无法确定的,因为量子力学不承认电子 云具有明确的边界。 ·核间距的一半就是原子半径,nuclear separation,离子晶体的核间距可由 X-射 线衍射法测定,关键是分割。 ·三套数据,P39 很详细,是自给的。 ·R.D.Shanon 半径数据(R.D.Shanon,Acta cryst,1976,A32,751),同时考虑配 位数,几何构型和电子自旋等影响。 ·离子半径的变化规律(P39~40) (3)电子构型 electronic configuration (P40)
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 6 0.2 1 1.8 55 0.4 4 2.0 63 0.6 9 2.2 70 0.8 15 2.4 76 1.0 22 2.6 82 1.2 30 2.8 86 1.4 39 3.0 89 1.6 47 3.2 92 CsF ≈1.7 时≈50% Hannay & Smyth 公式 %离子性=16( ∆X )+3.5( ∆X )2 温元凯译,戴安邦校,人教社,1978,P37,无机化学中的定量关系[美]R.B.Heslop 2.2.3 离子的特征 离子化合物的性质 → 取决于 离子键的强度 → 取决于 正、负离子的性质 (1)电荷 charge P44~45 详细说明了。 电荷愈高,吸引力愈强。 (2)半径 radius P45 ·严格讲,离子半径和原子半径一样也是无法确定的,因为量子力学不承认电子 云具有明确的边界。 ·核间距的一半就是原子半径,nuclear separation,离子晶体的核间距可由 X-射 线衍射法测定,关键是分割。 ·三套数据,P39 很详细,是自给的。 ·R.D.Shanon 半径数据(R.D.Shanon,Acta cryst,1976,A32,751),同时考虑配 位数,几何构型和电子自旋等影响。 ·离子半径的变化规律(P39~40) (3)电子构型 electronic configuration (P40)

西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 7 正离子随元素在周期表的不同位置而不同。 a. 8 电子和 2 电子构型(稀有气体构型) b. 18 电子构型(拟稀有气体构型)11~14 例 c. 18 +2 电子构型(含惰性电子对的构型)13~15 保留 s 电子 d. 不规则构型(9~17 电子构型) 2.3 共价键理论 2.3.1 电子对键的相关概念(P47~48) 1916 年 Lewis G N 提出 • 共享电子对——共价键(covalent bond) 键级 bond order 共价单键 single covalent bond 键数 bond number 共价双键 double covalent bond 共价叁键 triple covalent bond 两个原子间最多是三重键 • 配位共价键(由键合的一方原子提供电子对) coordinate covalent bond coordination 给予体原子 donor atom 接受体原子 acceptor atom 非极性共价键 non polar covalent bond 极性共价键 polar covalent bond + δ 和 − δ 解释 电负性原子 electronegative atom 电正性原子 electropositive atom 2.3.2 路易斯结构式(P48-49) ●基本书写步骤(P42) 例 2.1, 2.2 ●原子的形式电荷(formal charge) 形式电荷=(该原子的价电子数)-(孤对中的电子数)-(共用电子数/2) 目的:选择能量低的路易斯结构式: 例:指出下列化合物合理的结构是哪一种?不合理结构错在哪里? . . . . . . . . . . a. N2O N = N = O : N — N ≡ O : : N ≡ N — O : . . . . . . . . . . 不稳定,O 的电负性比 N 大,这样的对称结构 有可能使电趋向 O 原子, 势能高,不稳定 . . . . . . . . . . • 不稳定,O 的电负性比 N 大,这样的对称结构有 可能趋向 O 原子,势能 高,不稳定 同左 较稳定,合理
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 7 正离子随元素在周期表的不同位置而不同。 a. 8 电子和 2 电子构型(稀有气体构型) b. 18 电子构型(拟稀有气体构型)11~14 例 c. 18 +2 电子构型(含惰性电子对的构型)13~15 保留 s 电子 d. 不规则构型(9~17 电子构型) 2.3 共价键理论 2.3.1 电子对键的相关概念(P47~48) 1916 年 Lewis G N 提出 • 共享电子对——共价键(covalent bond) 键级 bond order 共价单键 single covalent bond 键数 bond number 共价双键 double covalent bond 共价叁键 triple covalent bond 两个原子间最多是三重键 • 配位共价键(由键合的一方原子提供电子对) coordinate covalent bond coordination 给予体原子 donor atom 接受体原子 acceptor atom 非极性共价键 non polar covalent bond 极性共价键 polar covalent bond + δ 和 − δ 解释 电负性原子 electronegative atom 电正性原子 electropositive atom 2.3.2 路易斯结构式(P48-49) ●基本书写步骤(P42) 例 2.1, 2.2 ●原子的形式电荷(formal charge) 形式电荷=(该原子的价电子数)-(孤对中的电子数)-(共用电子数/2) 目的:选择能量低的路易斯结构式: 例:指出下列化合物合理的结构是哪一种?不合理结构错在哪里? . . . . . . . . . . a. N2O N = N = O : N — N ≡ O : : N ≡ N — O : . . . . . . . . . . 不稳定,O 的电负性比 N 大,这样的对称结构 有可能使电趋向 O 原子, 势能高,不稳定 . . . . . . . . . . • 不稳定,O 的电负性比 N 大,这样的对称结构有 可能趋向 O 原子,势能 高,不稳定 同左 较稳定,合理