
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 1 第十四章 p 区元素(二) Chapter 14 p Block (2) 教学要求 1.了解 16-18 族元素的特点; 2.了解重点元素的存在、制备和用途; 3. 掌握重点元素硫、卤素的单质及其化合物的性质,会用结构理论和热力学解释它们的某 些化学现象; 4. 了解第 1 个稀有气体化合物的诞生及其对化学发展的贡献。 课时分配(6 学时) 1. 16-18 族元素概述:(1 学时) 2. 工业资源、单质的制备和用途:(1 学时) 3. 过氧化氢和臭氧:(1 学时) 4. 硫的重要化合物:(1 学时) 5. 卤素:(1 学时) 6. 稀有气体:(1 学时) 16/VI 17/VII 18/VIII
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 1 第十四章 p 区元素(二) Chapter 14 p Block (2) 教学要求 1.了解 16-18 族元素的特点; 2.了解重点元素的存在、制备和用途; 3. 掌握重点元素硫、卤素的单质及其化合物的性质,会用结构理论和热力学解释它们的某 些化学现象; 4. 了解第 1 个稀有气体化合物的诞生及其对化学发展的贡献。 课时分配(6 学时) 1. 16-18 族元素概述:(1 学时) 2. 工业资源、单质的制备和用途:(1 学时) 3. 过氧化氢和臭氧:(1 学时) 4. 硫的重要化合物:(1 学时) 5. 卤素:(1 学时) 6. 稀有气体:(1 学时) 16/VI 17/VII 18/VIII

西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 2 本章介绍硫属元素(chalcogens)、卤素(halogens)和稀有气体(noble gases) 三族元素。 对第 16 族元素的讨论重点放在氧和硫, 考虑到前面和后面章节多处涉及氧和含氧化合物, 对氧而言本章 只讨论过氧化氢和臭氧。 同样, 由于许多章节涉及卤素和卤化物,本章对卤族的讨论重点放在 卤素互化物、拟卤素以及卤素单质和卤素化合物的性质变化趋势上。到目前为止, 稀有气体元素 的化合物只有与氟和氧形成的化合物,然而,氟化学的研究导致稀有气体化合物的发现。 14.1 第 16 族、第 17 族和第 18 族概述 ★ 钋和另外两个元素(锗和锑)的成键状况更接近非金属。如果同时考虑到 116 号元素的性 质迄今几乎尚未被研究的事实, 第 16 族至第 18 族元素当中就没有一个属于真正的金属 元素了。 ★ 作为非金属, 三族元素以高电离能和高电子亲和能为特征。 ★ 表中给出的信息还表明 , 三族元素中不少成员形成多种氧化态。 Some properties of group 16 to group 18 elements Element First ionization energy I1/kJ·mol-1 Electronegativity a χ Covalent radius rcov/pm Ionic radiusb rion/pm Common Oxidation states O S Se Te Po F Cl Br I At He Ne Ar Kr Xe Rn 1 320 1 005 947 875 1 687 1 257 1 146 1 015 2 378 2 087 1 527 1 357 1 177 1 043 3.44 2.44 2.55 2.10 3.98 3.16 2.96 2.66 2.6 73 102 117 135 77 117 122 140 175 75 110 122 143 152 124 170 184 207 117 167 182 206 - - - - - -2, -1, 0 -2, 0, +4, +6 -2, 0, +4, +6 -2, 0, +4, +6 -2, 0, +2, +4, +6 -1, 0 -1, 0, +1, +3, +5, +7 -1, 0, +1, +3, +5, +7 -1, 0, +1, +3, +5, +7 0 0 0 0, +2 0, +2, +4, +6, +8 a in Pauling scale. b E2- for group 16 elements, E- for group 17 elements. 14.2 氧 14.2.1 存在、提取和用途 ★ 存在 氧(O2)占大气组成的 21%。 难以计数的化合物中含有氧, 地壳质量的 49%是由含 氧化合物(如水,石灰石,砂子,硅酸盐,铝土矿,赤铁矿等)组成的。 ★ 提取 大气是工业上制取N2和O2的最重要的资源. 不论是当今工业规模的空气深冷精馏
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 2 本章介绍硫属元素(chalcogens)、卤素(halogens)和稀有气体(noble gases) 三族元素。 对第 16 族元素的讨论重点放在氧和硫, 考虑到前面和后面章节多处涉及氧和含氧化合物, 对氧而言本章 只讨论过氧化氢和臭氧。 同样, 由于许多章节涉及卤素和卤化物,本章对卤族的讨论重点放在 卤素互化物、拟卤素以及卤素单质和卤素化合物的性质变化趋势上。到目前为止, 稀有气体元素 的化合物只有与氟和氧形成的化合物,然而,氟化学的研究导致稀有气体化合物的发现。 14.1 第 16 族、第 17 族和第 18 族概述 ★ 钋和另外两个元素(锗和锑)的成键状况更接近非金属。如果同时考虑到 116 号元素的性 质迄今几乎尚未被研究的事实, 第 16 族至第 18 族元素当中就没有一个属于真正的金属 元素了。 ★ 作为非金属, 三族元素以高电离能和高电子亲和能为特征。 ★ 表中给出的信息还表明 , 三族元素中不少成员形成多种氧化态。 Some properties of group 16 to group 18 elements Element First ionization energy I1/kJ·mol-1 Electronegativity a χ Covalent radius rcov/pm Ionic radiusb rion/pm Common Oxidation states O S Se Te Po F Cl Br I At He Ne Ar Kr Xe Rn 1 320 1 005 947 875 1 687 1 257 1 146 1 015 2 378 2 087 1 527 1 357 1 177 1 043 3.44 2.44 2.55 2.10 3.98 3.16 2.96 2.66 2.6 73 102 117 135 77 117 122 140 175 75 110 122 143 152 124 170 184 207 117 167 182 206 - - - - - -2, -1, 0 -2, 0, +4, +6 -2, 0, +4, +6 -2, 0, +4, +6 -2, 0, +2, +4, +6 -1, 0 -1, 0, +1, +3, +5, +7 -1, 0, +1, +3, +5, +7 -1, 0, +1, +3, +5, +7 0 0 0 0, +2 0, +2, +4, +6, +8 a in Pauling scale. b E2- for group 16 elements, E- for group 17 elements. 14.2 氧 14.2.1 存在、提取和用途 ★ 存在 氧(O2)占大气组成的 21%。 难以计数的化合物中含有氧, 地壳质量的 49%是由含 氧化合物(如水,石灰石,砂子,硅酸盐,铝土矿,赤铁矿等)组成的。 ★ 提取 大气是工业上制取N2和O2的最重要的资源. 不论是当今工业规模的空气深冷精馏

西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 3 还是正在研究中的膜分离技术,总能同时得到 N2 和 O2.。 ★ 用途 O2 对生命的重要性尽人皆知, 生物体通过呼吸将其转化 CO2. 氧的工业用途主要 是炼钢,生产 1 t 钢约需消耗 1 t 氧. 14.2.2 过氧化氢 过氧化氢因 H2O2 分子中含有过氧键(O-O)而得名, 俗称双氧水。 ★ 实验室制法 ★ 工业上利用过二硫酸铵(由硫酸氢铵电解氧化得到)水解生产H2O2的方法现在仍然没有被 完全淘汰: 电解氧化 H2O 2 (NH4)HSO4(aq) (NH4)2S2O8(aq) 2 (NH4)HSO4(aq) + H2O2(aq) - H2 但当今大多采用钯催化的蒽二酚氧化法。后一种方法生产的 H2O2 已占世界年产量的 95%以上: The catalytic cycle used in the industrial manufacture of hydrogen peroxide. 给出相关的催化循环。 乙基蒽二酚氧化过程中将 O2 转化为 H2O2, 氧化产物在钯(或镍)的催化反 应中被还原为乙基蒽二酚。 反应循环往复, 总结果是由 H2 和 O2 生成 H2O2。 过氧化氢是最重要的是无机过氧化物,世界年产量估计超过 1×106 t (以纯 H2O2 计). 纯过氧 O O H H 95o 52’ 96o 52’ 93o 51’ OH HO R +H2(钯催化剂) +O2 O O R H2O2 ● 实验室法 BaO2 + 2 HCl BaCl2 + H2O2 BaO2 + H2SO4(稀) BaSO4 + H2O2 ( 6 ~ 8 % 的水溶液) NaO2 + 2 H2O 2 NaOH + H2O2
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 3 还是正在研究中的膜分离技术,总能同时得到 N2 和 O2.。 ★ 用途 O2 对生命的重要性尽人皆知, 生物体通过呼吸将其转化 CO2. 氧的工业用途主要 是炼钢,生产 1 t 钢约需消耗 1 t 氧. 14.2.2 过氧化氢 过氧化氢因 H2O2 分子中含有过氧键(O-O)而得名, 俗称双氧水。 ★ 实验室制法 ★ 工业上利用过二硫酸铵(由硫酸氢铵电解氧化得到)水解生产H2O2的方法现在仍然没有被 完全淘汰: 电解氧化 H2O 2 (NH4)HSO4(aq) (NH4)2S2O8(aq) 2 (NH4)HSO4(aq) + H2O2(aq) - H2 但当今大多采用钯催化的蒽二酚氧化法。后一种方法生产的 H2O2 已占世界年产量的 95%以上: The catalytic cycle used in the industrial manufacture of hydrogen peroxide. 给出相关的催化循环。 乙基蒽二酚氧化过程中将 O2 转化为 H2O2, 氧化产物在钯(或镍)的催化反 应中被还原为乙基蒽二酚。 反应循环往复, 总结果是由 H2 和 O2 生成 H2O2。 过氧化氢是最重要的是无机过氧化物,世界年产量估计超过 1×106 t (以纯 H2O2 计). 纯过氧 O O H H 95o 52’ 96o 52’ 93o 51’ OH HO R +H2(钯催化剂) +O2 O O R H2O2 ● 实验室法 BaO2 + 2 HCl BaCl2 + H2O2 BaO2 + H2SO4(稀) BaSO4 + H2O2 ( 6 ~ 8 % 的水溶液) NaO2 + 2 H2O 2 NaOH + H2O2
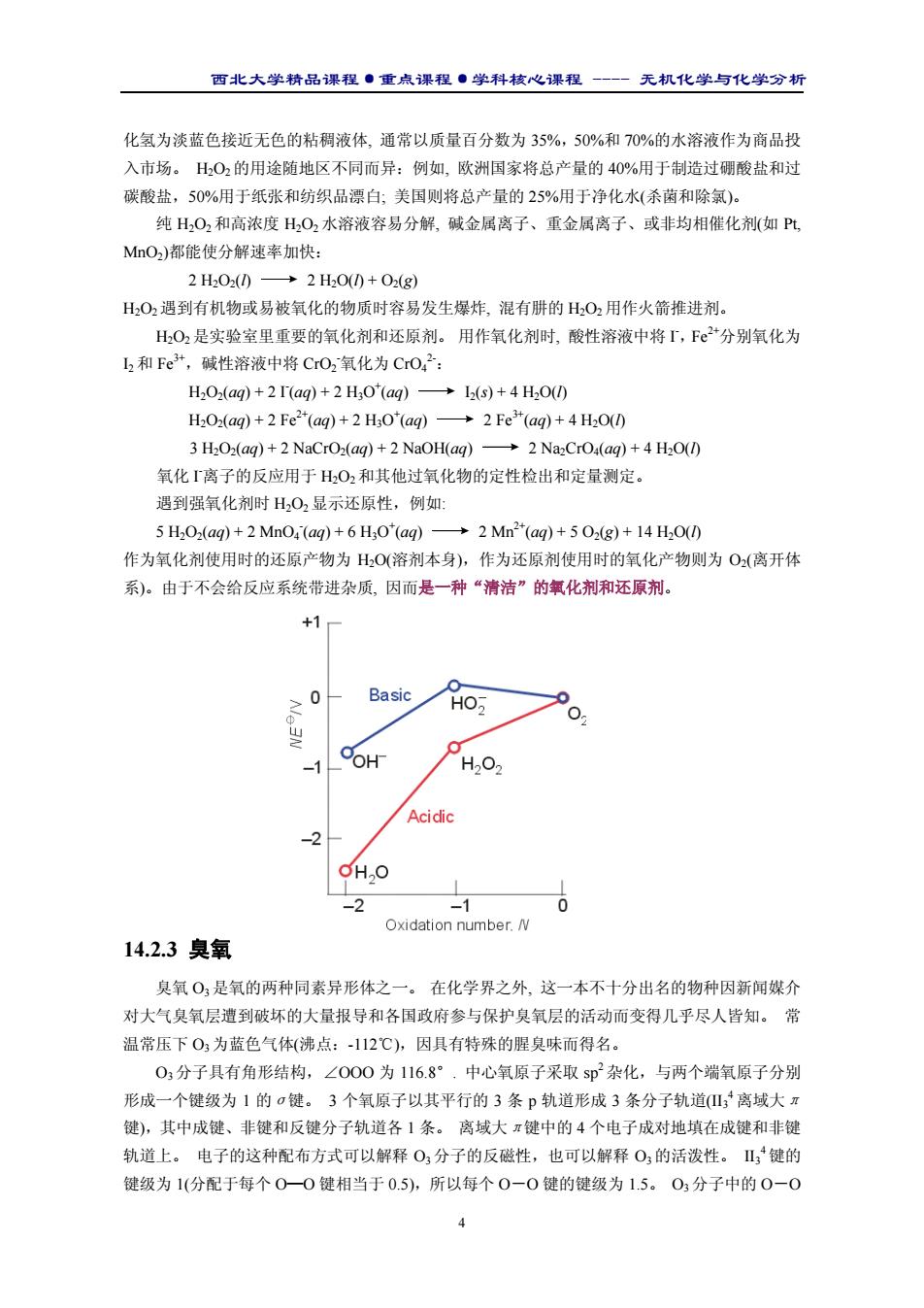
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 4 化氢为淡蓝色接近无色的粘稠液体, 通常以质量百分数为 35%,50%和 70%的水溶液作为商品投 入市场。 H2O2 的用途随地区不同而异:例如, 欧洲国家将总产量的 40%用于制造过硼酸盐和过 碳酸盐,50%用于纸张和纺织品漂白; 美国则将总产量的 25%用于净化水(杀菌和除氯)。 纯 H2O2和高浓度 H2O2 水溶液容易分解, 碱金属离子、重金属离子、或非均相催化剂(如 Pt, MnO2)都能使分解速率加快: 2 H2O2(l) 2 H2O(l) + O2(g) H2O2 遇到有机物或易被氧化的物质时容易发生爆炸, 混有肼的 H2O2 用作火箭推进剂。 H2O2 是实验室里重要的氧化剂和还原剂。 用作氧化剂时, 酸性溶液中将 I - ,Fe2+分别氧化为 I2 和 Fe3+,碱性溶液中将 CrO2 - 氧化为 CrO4 2-: H2O2(aq) + 2 I- (aq) + 2 H3O+ (aq) I2(s) + 4 H2O(l) H2O2(aq) + 2 Fe2+(aq) + 2 H3O+ (aq) 2 Fe3+(aq) + 4 H2O(l) 3 H2O2(aq) + 2 NaCrO2(aq) + 2 NaOH(aq) 2 Na2CrO4(aq) + 4 H2O(l) 氧化 I - 离子的反应用于 H2O2 和其他过氧化物的定性检出和定量测定。 遇到强氧化剂时 H2O2 显示还原性,例如: 5 H2O2(aq) + 2 MnO4 - (aq) + 6 H3O+ (aq) 2 Mn2+(aq) + 5 O2(g) + 14 H2O(l) 作为氧化剂使用时的还原产物为 H2O(溶剂本身),作为还原剂使用时的氧化产物则为 O2(离开体 系)。由于不会给反应系统带进杂质, 因而是一种“清洁”的氧化剂和还原剂。 14.2.3 臭氧 臭氧 O3 是氧的两种同素异形体之一。 在化学界之外, 这一本不十分出名的物种因新闻媒介 对大气臭氧层遭到破坏的大量报导和各国政府参与保护臭氧层的活动而变得几乎尽人皆知。 常 温常压下 O3 为蓝色气体(沸点:-112℃),因具有特殊的腥臭味而得名。 O3 分子具有角形结构,∠OOO 为 116.8°. 中心氧原子采取 sp 2 杂化,与两个端氧原子分别 形成一个键级为 1 的σ键。 3 个氧原子以其平行的 3 条 p 轨道形成 3 条分子轨道(II3 4离域大π 键),其中成键、非键和反键分子轨道各 1 条。 离域大π键中的 4 个电子成对地填在成键和非键 轨道上。 电子的这种配布方式可以解释 O3 分子的反磁性,也可以解释 O3 的活泼性。 II3 4键的 键级为 1(分配于每个 O—O 键相当于 0.5),所以每个 O-O 键的键级为 1.5。 O3 分子中的 O-O
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 4 化氢为淡蓝色接近无色的粘稠液体, 通常以质量百分数为 35%,50%和 70%的水溶液作为商品投 入市场。 H2O2 的用途随地区不同而异:例如, 欧洲国家将总产量的 40%用于制造过硼酸盐和过 碳酸盐,50%用于纸张和纺织品漂白; 美国则将总产量的 25%用于净化水(杀菌和除氯)。 纯 H2O2和高浓度 H2O2 水溶液容易分解, 碱金属离子、重金属离子、或非均相催化剂(如 Pt, MnO2)都能使分解速率加快: 2 H2O2(l) 2 H2O(l) + O2(g) H2O2 遇到有机物或易被氧化的物质时容易发生爆炸, 混有肼的 H2O2 用作火箭推进剂。 H2O2 是实验室里重要的氧化剂和还原剂。 用作氧化剂时, 酸性溶液中将 I - ,Fe2+分别氧化为 I2 和 Fe3+,碱性溶液中将 CrO2 - 氧化为 CrO4 2-: H2O2(aq) + 2 I- (aq) + 2 H3O+ (aq) I2(s) + 4 H2O(l) H2O2(aq) + 2 Fe2+(aq) + 2 H3O+ (aq) 2 Fe3+(aq) + 4 H2O(l) 3 H2O2(aq) + 2 NaCrO2(aq) + 2 NaOH(aq) 2 Na2CrO4(aq) + 4 H2O(l) 氧化 I - 离子的反应用于 H2O2 和其他过氧化物的定性检出和定量测定。 遇到强氧化剂时 H2O2 显示还原性,例如: 5 H2O2(aq) + 2 MnO4 - (aq) + 6 H3O+ (aq) 2 Mn2+(aq) + 5 O2(g) + 14 H2O(l) 作为氧化剂使用时的还原产物为 H2O(溶剂本身),作为还原剂使用时的氧化产物则为 O2(离开体 系)。由于不会给反应系统带进杂质, 因而是一种“清洁”的氧化剂和还原剂。 14.2.3 臭氧 臭氧 O3 是氧的两种同素异形体之一。 在化学界之外, 这一本不十分出名的物种因新闻媒介 对大气臭氧层遭到破坏的大量报导和各国政府参与保护臭氧层的活动而变得几乎尽人皆知。 常 温常压下 O3 为蓝色气体(沸点:-112℃),因具有特殊的腥臭味而得名。 O3 分子具有角形结构,∠OOO 为 116.8°. 中心氧原子采取 sp 2 杂化,与两个端氧原子分别 形成一个键级为 1 的σ键。 3 个氧原子以其平行的 3 条 p 轨道形成 3 条分子轨道(II3 4离域大π 键),其中成键、非键和反键分子轨道各 1 条。 离域大π键中的 4 个电子成对地填在成键和非键 轨道上。 电子的这种配布方式可以解释 O3 分子的反磁性,也可以解释 O3 的活泼性。 II3 4键的 键级为 1(分配于每个 O—O 键相当于 0.5),所以每个 O-O 键的键级为 1.5。 O3 分子中的 O-O

西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 5 键长(127.8 pm)大于 O2 分子中的 O-O 键长(120.8 pm),因而显示比 O2 更高的活泼性。 O3 事实上是个吸能物种,常温下可缓慢分解为 O2: 3/2 O2(g) O3(g) △fH○一 m = + 142.7 kJ·mol-1 2 O3(g) 3 O2(g) 臭氧能将 I - 迅速而定量地氧化至 I2,该反应被用来测定 O3 的含量: O3(g) + 2I- (aq) + H2O(l) I2(s) + O2(g) + 2 OH- (aq) 臭氧的氧化性被用于漂白、除臭、杀菌和处理含酚、苯等工业废水和含 CN- 离子的电镀工业 废液. 14.3 硫 14.3.1 存在、提取和用途 硫在自然界以化合态和单质两种形态出现。 重要的化合态 有如黄铁矿(FeS2), 某些有色金属(如铜、镍、铅、锌、钴)的 硫化物矿, 石膏(CaSO4·2H2O)和芒硝(Na2SO4·10H2O)等硫 酸盐矿,矿物燃料(如石油、天然气和煤)中与氢和碳化合的无 机和有机化合物。 单质形态的硫出现在火山喷发形成的沉积中: 火山喷发过程中, 地下硫化物与高温水蒸气作用生成 H2S,H2S 再与 SO2或 O2 反应生成单质硫: 2 H2S(g) + SO2(g) 3 S(s) + 2 H2O(g) 2 H2S(g) + O2(g) 2 S(s) + 2 H2O(g) 由化合态硫大规模生产单质硫经由如下主要途径,其中第一条途径正在变得越来越重要。 1. H2S 的氧化: 以天然气、石油炼气和炼焦炉气中的 H2S 为原料,主要反应为:
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 5 键长(127.8 pm)大于 O2 分子中的 O-O 键长(120.8 pm),因而显示比 O2 更高的活泼性。 O3 事实上是个吸能物种,常温下可缓慢分解为 O2: 3/2 O2(g) O3(g) △fH○一 m = + 142.7 kJ·mol-1 2 O3(g) 3 O2(g) 臭氧能将 I - 迅速而定量地氧化至 I2,该反应被用来测定 O3 的含量: O3(g) + 2I- (aq) + H2O(l) I2(s) + O2(g) + 2 OH- (aq) 臭氧的氧化性被用于漂白、除臭、杀菌和处理含酚、苯等工业废水和含 CN- 离子的电镀工业 废液. 14.3 硫 14.3.1 存在、提取和用途 硫在自然界以化合态和单质两种形态出现。 重要的化合态 有如黄铁矿(FeS2), 某些有色金属(如铜、镍、铅、锌、钴)的 硫化物矿, 石膏(CaSO4·2H2O)和芒硝(Na2SO4·10H2O)等硫 酸盐矿,矿物燃料(如石油、天然气和煤)中与氢和碳化合的无 机和有机化合物。 单质形态的硫出现在火山喷发形成的沉积中: 火山喷发过程中, 地下硫化物与高温水蒸气作用生成 H2S,H2S 再与 SO2或 O2 反应生成单质硫: 2 H2S(g) + SO2(g) 3 S(s) + 2 H2O(g) 2 H2S(g) + O2(g) 2 S(s) + 2 H2O(g) 由化合态硫大规模生产单质硫经由如下主要途径,其中第一条途径正在变得越来越重要。 1. H2S 的氧化: 以天然气、石油炼气和炼焦炉气中的 H2S 为原料,主要反应为: