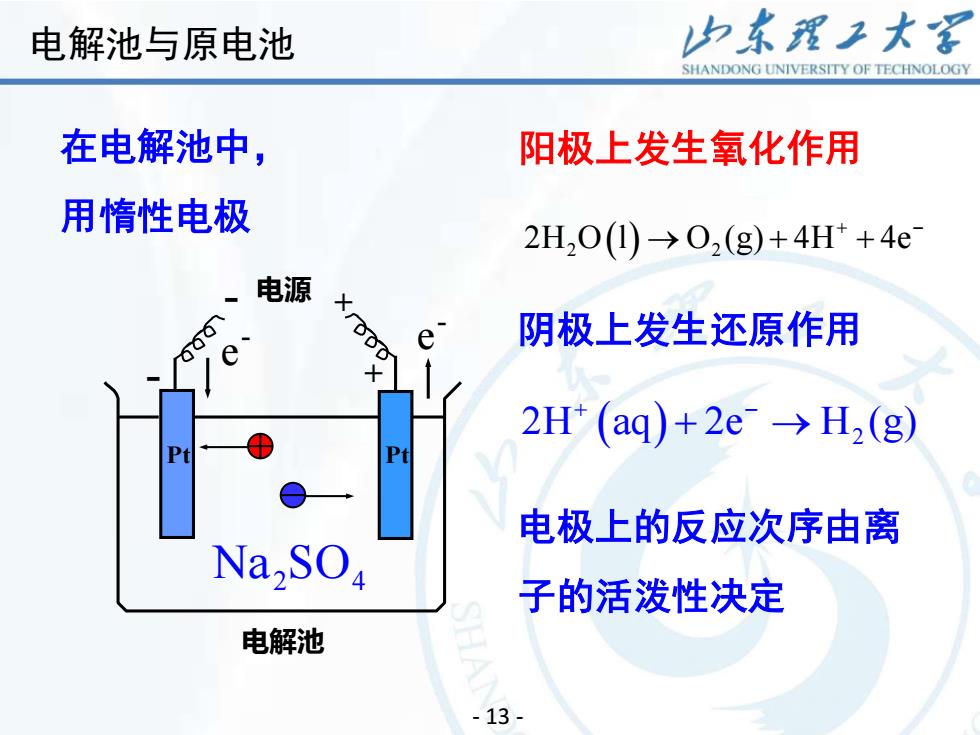
山东理工大客电解池与原电池SHANDONGUNIVERSITYOFTECHNOLOGY在电解池中,阳极上发生氧化作用用情性电极2H,0(1) →02(g)+4H+ +4e电源Xg阴极上发生还原作用ee十2H* (aq)+2e~ →H,(g)PtPt电极上的反应次序由离Na,SO子的活泼性决定电解池- 13 -
17 - 13 - 阳极上发生氧化作用 阴极上发生还原作用 在电解池中, 用惰性电极 - 电源 + 电解池 + Pt - e - e - Pt Na SO2 4 2H O l O (g) 4H 4e 2 2 ( ) → + ++ − 2H aq 2e H (g) ( ) 2 + − + → 电极上的反应次序由离 子的活泼性决定 电解池与原电池
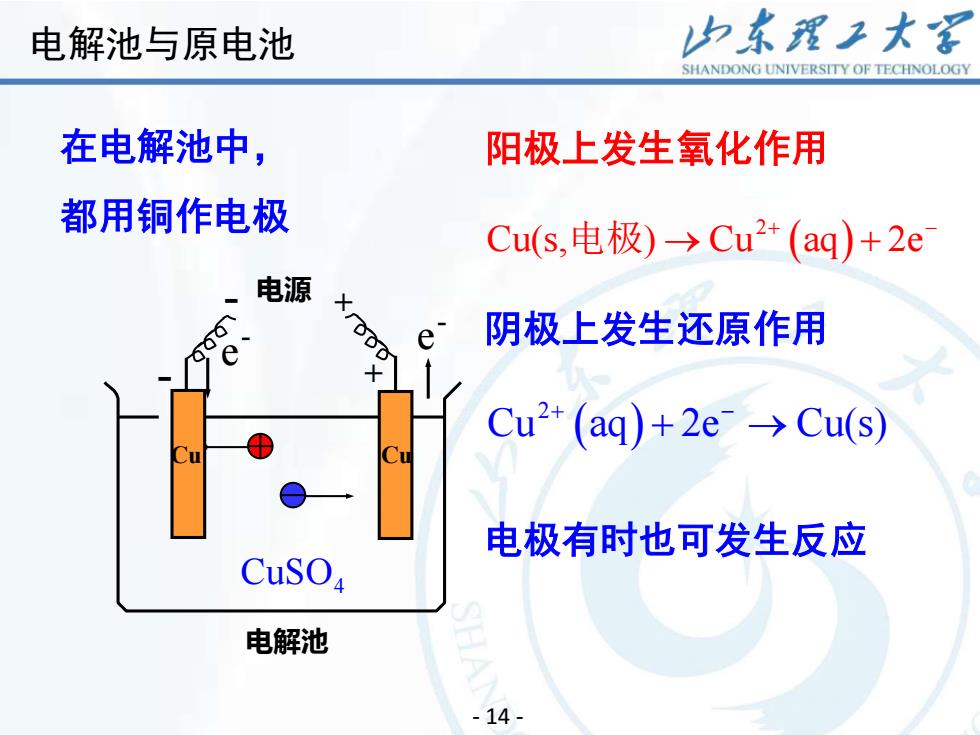
山东理工大客电解池与原电池SHANDONGUNIVERSITYOFTECHNOLOGY在电解池中,阳极上发生氧化作用都用铜作电极Cu(s,电极)→Cu2+(aq)+2e电源X16阴极上发生还原作用ee+Cu2+ (aq)+ 2e- →Cu(s)Cu电极有时也可发生反应CusO电解池14
18 - 14 - 阳极上发生氧化作用 阴极上发生还原作用 在电解池中, 都用铜作电极 - 电源 + 电解池 + Cu - e - e - Cu CuSO4 ( ) 2 Cu aq 2e Cu(s) + − + → 电极有时也可发生反应 ( ) 2 Cu(s, ) Cu aq 2e 电极 → + + − 电解池与原电池

山东理工大客Faraday电解定律SHANDONGUNIVERSITYOFTECHNOLOGYFaraday归纳了多次实验结果,于1833年总结出了电解定律1.在电极界面上发生化学变化物质的质量与通入的电荷量成正比。众2.通电于若干个电解池串联的线路中,当所取的基本粒子的荷电数相同时,在各个电极上发生反应的物质,其物质的量相同,析出物质的质量与其摩尔质量成正比15
19 - 15 - Faraday 归纳了多次实验结果,于1833年总 结出了电解定律 1. 在电极界面上发生化学变化物质的质量与通 入的电荷量成正比。 2. 通电于若干个电解池串联的线路中,当所取 的基本粒子的荷电数相同时,在各个电极上发生反 应的物质,其物质的量相同,析出物质的质量与其 摩尔质量成正比。 Faraday电解定律

山东理工大客Faraday电解定律SHANDONGUNIVERSITYOFTECHNOLOGY人们把在数值上等于1mol元电荷的电量称为Faraday常数。已知元电荷电量e为1.6022 × 10-19 CF=Le= 6.022 ×1023 mol ×1.602 2 ×10-19 C= 96 484.6 C ·mol-1~ 96 500 C·mol-1- 16 -
20 - 16 - 人们把在数值上等于1 mol元电荷的电量称为 Faraday常数。 已知元电荷电量 e 为 19 1.6022 10 C − F L e = 23 19 6.022 10 mol 1.602 2 10 C − = 1 96 484.6 C mol− = 1 96 500 C mol− Faraday电解定律

山东理工大客Faraday电解定律SHANDONGUNIVERSITYOFTECHNOLOGY如果在电解池中发生如下反应:Mz+ + z+e-→ M(s)电子得失的计量系数为Z+,欲从阴极上沉积,需通入的电出1 mol M(s),即反应进度为1 mol 时,量为 QQ(s=l) = z+eL= z+F时需通入的电量为若反应进度为O(s) = z+F5若通入任意电量O时,阴极上沉积出金属B的物质的量nB和质量mB分别为:- 17 -
21 - 17 - 电子得失的计量系数为 z+,欲从阴极上沉积 出1 mol M(s),即反应进度为1 mol 时,需通入的电 量为 Q M e M(s) z z + − + + → Q z eL z F ( 1) + + = = = Q z F ( ) + = 如果在电解池中发生如下反应: 若反应进度为 时需通入的电量为 若通入任意电量Q时,阴极上沉积出金属B的 物质的量 nB 和质量 mB 分别为: Faraday电解定律