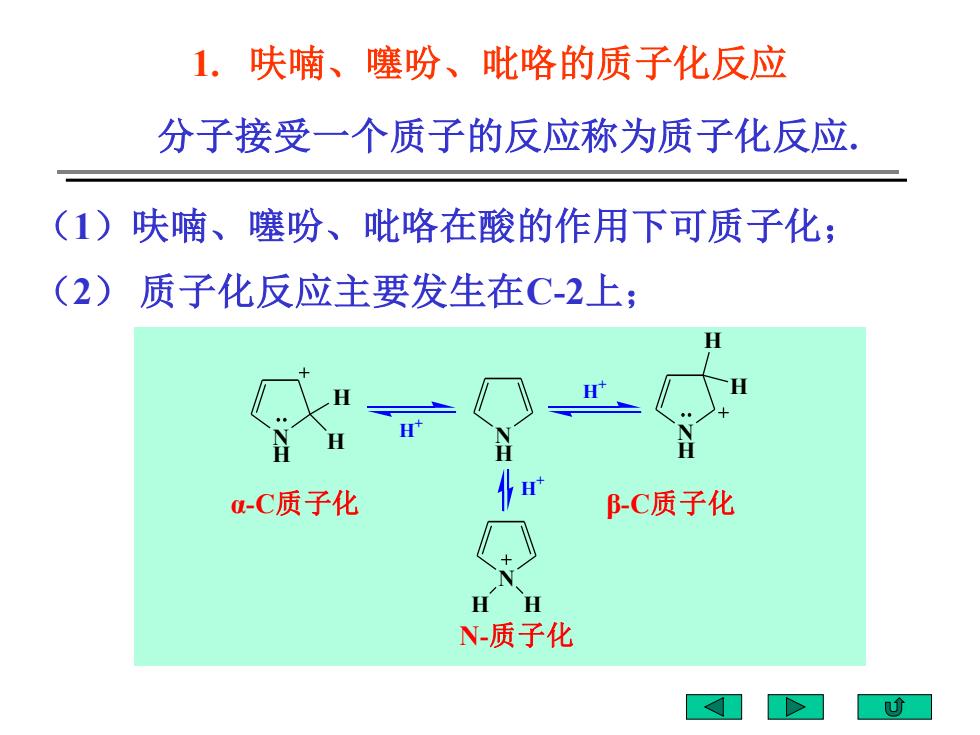
1.呋喃、噻吩、吡咯的质子化反应 分子接受一个质子的反应称为质子化反应. (1)呋喃、噻吩、吡咯在酸的作用下可质子化; (2)质子化反应主要发生在C-2上; H H -C质子化 BC质子化 H H N-质子化
1. 呋喃、噻吩、吡咯的质子化反应 分子接受一个质子的反应称为质子化反应. (1)呋喃、噻吩、吡咯在酸的作用下可质子化; (2) 质子化反应主要发生在C-2上; N H H H N H N H H H N H H H + H + H + α-C质子化 β-C质子化 N-质子化
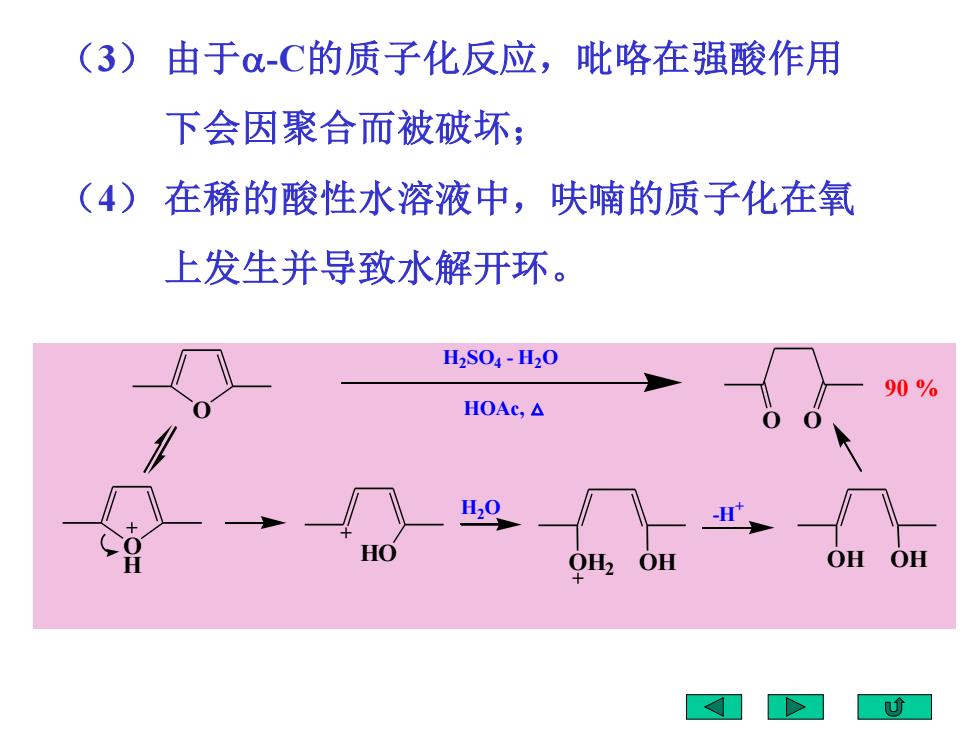
(3)由于o-C的质子化反应,吡咯在强酸作用 下会因聚合而被破坏; (4)在稀的酸性水溶液中,呋喃的质子化在氧 上发生并导致水解开环。 l2S04-H20 90% HOAc,A H20 HO OH2 OH OH OH
(3) 由于-C的质子化反应,吡咯在强酸作用 下会因聚合而被破坏; (4) 在稀的酸性水溶液中,呋喃的质子化在氧 上发生并导致水解开环。 O O H HO OH2 OH OH OH O O H2SO4 - H2O HOAc, △ 90 % H2O -H +
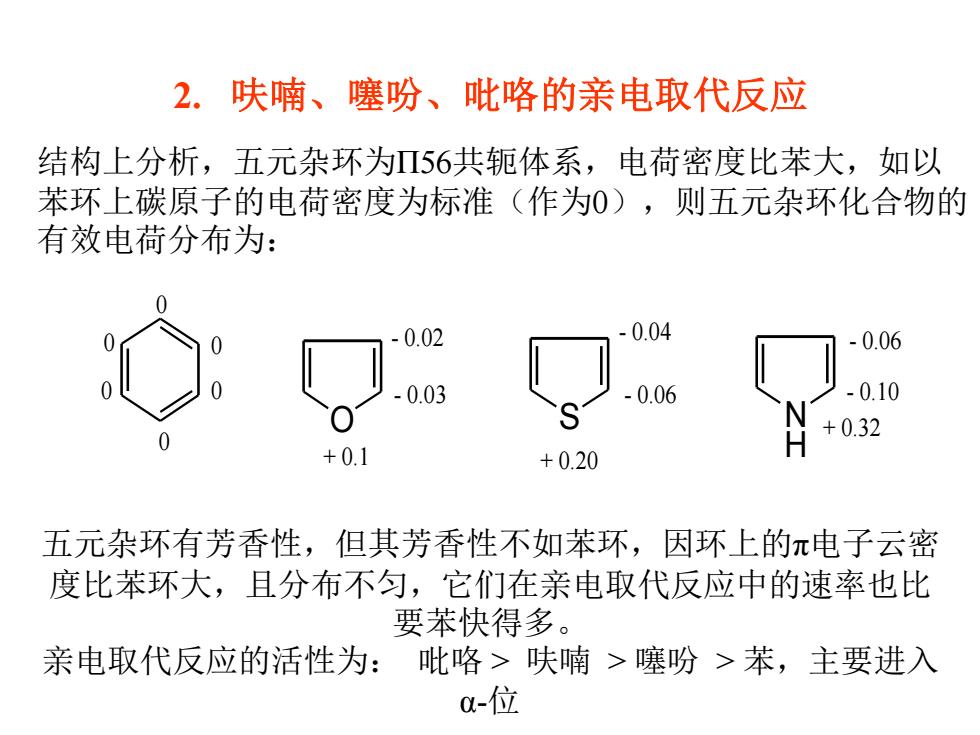
2.呋喃、噻吩、吡咯的亲电取代反应 结构上分析,五元杂环为56共轭体系,电荷密度比苯大,如以 苯环上碳原子的电荷密度为标准(作为0),则五元杂环化合物的 有效电荷分布为: 0.02 0.04 -0.06 0.03 -0.06 -0.10 +0.32 +0.1 +0.20 五元杂环有芳香性,但其芳香性不如苯环,因环上的π电子云密 度比苯环大,且分布不匀,它们在亲电取代反应中的速率也比 要苯快得多。 亲电取代反应的活性为: 吡咯>呋喃>噻吩>苯,主要进入 0-位
2. 呋喃、噻吩、吡咯的亲电取代反应 结构上分析,五元杂环为Π56共轭体系,电荷密度比苯大,如以 苯环上碳原子的电荷密度为标准(作为0),则五元杂环化合物的 有效电荷分布为: O S N H 0 0 0 0 0 0 + 0.1 - 0.03 - 0.02 + 0.20 - 0.06 - 0.04 + 0.32 - 0.10 - 0.06 五元杂环有芳香性,但其芳香性不如苯环,因环上的π电子云密 度比苯环大,且分布不匀,它们在亲电取代反应中的速率也比 要苯快得多。 亲电取代反应的活性为: 吡咯 > 呋喃 > 噻吩 > 苯,主要进入 α-位
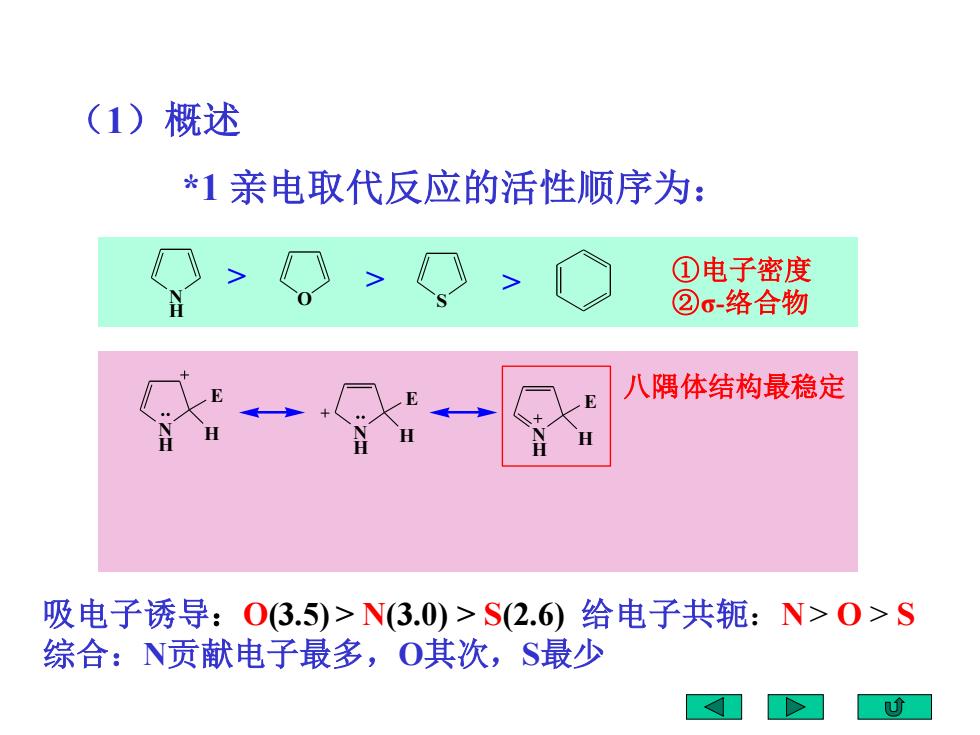
(1) 概述 *1亲电取代反应的活性顺序为: ①电子密度 ②6-络合物 八隅体结构最稳定 H 吸电子诱导:03.5)>N(3.0)>S(2.6)给电子共轭:N>0>S 综合:N贡献电子最多,O其次,S最少
*1 亲电取代反应的活性顺序为: 吸电子诱导:O(3.5) > N(3.0) > S(2.6) 给电子共轭:N > O > S 综合:N贡献电子最多,O其次,S最少 N O H S > > > N H E H N H E H N H E H ①电子密度 ②σ-络合物 八隅体结构最稳定 (1)概述

*2取代反应主要发生在-C上; *3吡咯、呋喃对酸及氧化剂比较敏感,选择试 剂时需要注意; *4 噻吩、吡咯的芳香性较强,所以易取代而不易 加成;呋喃的芳香性较弱,虽然也能与大多数 亲电试剂发生亲电取代,但在强亲核试剂存在 下,能发生亲核加成。 离域能: 噻吩:121.3kJmo1 吡咯:87.8 kJmol1 呋喃:66.9 kJ-mol
*2 取代反应主要发生在α-C上; *3 吡咯、呋喃对酸及氧化剂比较敏感,选择试 剂时需要注意; *4 噻吩、吡咯的芳香性较强,所以易取代而不易 加成;呋喃的芳香性较弱,虽然也能与大多数 亲电试剂发生亲电取代,但在强亲核试剂存在 下,能发生亲核加成。 离域能:噻吩:121.3 kJ·mol-1 吡咯:87.8 kJ·mol -1 呋喃:66.9 kJ·mol -1