
第11章 电化学基础
第11章 电化学基础

11.1氧化还原反应 1.1.1氧化值和氧化态 氧化值 有电子得失或电子转移的反应,被称为氧 化还原反应。 Cu(aq)+Zn(s)-Zn (aq)+Cu( 得失电子 H2(g)+Cl,(g)=2HCI (g 电子偏移 氧化值:是指某元素的一个原子的荷电数,该荷电数是 假定把每一化学键中的电子指定给电负性更大的原子而求 得的
11.1.1氧化值和氧化态 氧化值:是指某元素的一个原子的荷电数,该荷电数是 假定把每一化学键中的电子指定给电负性更大的原子而求 得的。 有电子得失或电子转移的反应,被称为氧 化还原反应。 Cu (aq) Zn(s) Zn (aq) Cu(s) 2 2 + + 得失电子 + + H2 (g)+Cl2(g) 2HCl(g) 电子偏移 氧化值 11.1氧化还原反应

确定氧化值的规则: ①单质中,元素的氧化值为零。 ②在单原子离子中,元素的氧化值等于该离子所带的 电荷数。 ③在大多数化合物中,氢的氧化值为+1:只有在金 属氢化物中氢的氧化值为-1。 ④通常,氧在化合物中的氧化值为-2;但是在过氧化 物中,氧的氧化值为-1,在氟的氧化物中,如OF2和OF2 中,氧的氧化值分别为+2和+1
确定氧化值的规则: ①单质中,元素的氧化值为零。 ②在单原子离子中,元素的氧化值等于该离子所带的 电荷数 。 ③在大多数化合物中,氢的氧化值为 +1;只有在金 属氢化物中氢的氧化值为 -1。 ④通常,氧在化合物中的氧化值为-2;但是在过氧化 物中,氧的氧化值为-1,在氟的氧化物中,如OF2 和O2F2 中,氧的氧化值分别为+2和+1

11.1.2氧化还原半反应式 11.1.3氧化还原方程式的配平 配平原则: ①电荷守恒:氧化剂得电子数等于还原剂 失电子数。 ②质量守恒:反应前后各元素原子总数相 等
配平原则: ① 电荷守恒:氧化剂得电子数等于还原剂 失电子数。 ② 质量守恒:反应前后各元素原子总数相 等。 11.1.3氧化还原方程式的配平 11.1.2氧化还原半反应式
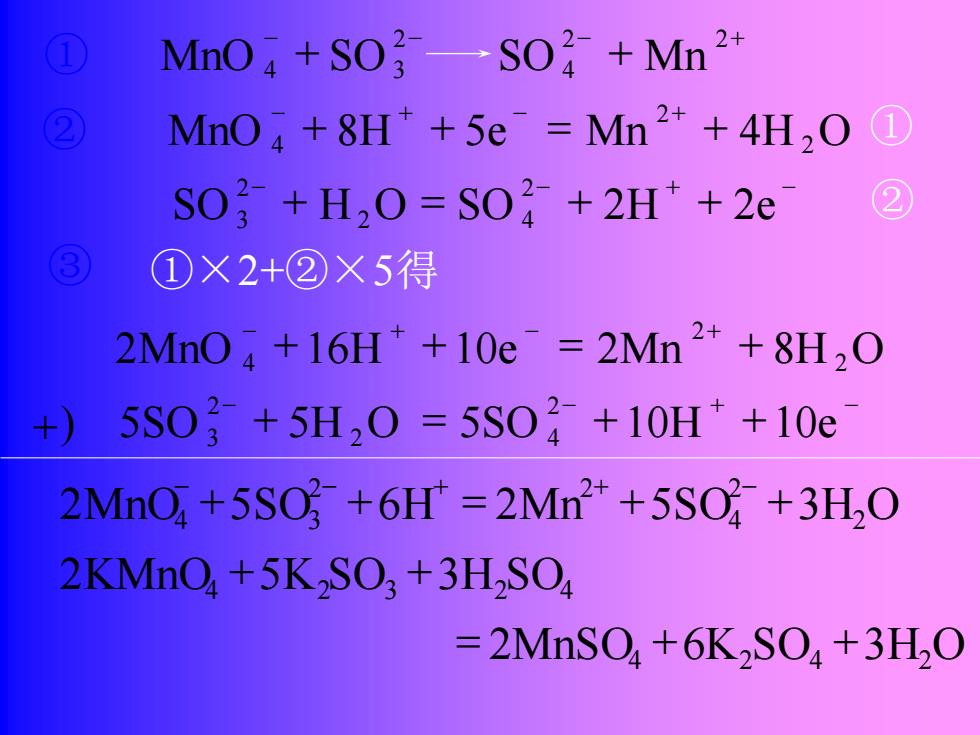
MnO+SO?SO2 +Mn 2* MnO+8H*+5e Mn2*+4H,O 1 S0+H20=S04+2H+2e 2 ①×2+②×5得 2Mn04+16H+10e=2Mn2++8H20 5S02+5H,0=5S02+10H++10e 2MnO+5S0+6H*=2Mn2*+5S0 +3H2O 2KMnO+5K,SO;+3H2SO =2MnSO+6K,SO+3H,O
+) 2 4 - - + - 5SO + 5H O = 5SO + 10H +10e 2 2 3 - + - + 2MnO + 16H + 10e = 2Mn + 8H 2O 2 4 - + - + ② MnO + 8H + 5e = Mn + 4H 2O 2 4 ① - - + - SO + H O = SO + 2H + 2e 2 2 4 2 3 ② ③ ①×2+②×5得 = 2MnSO4 +6K2SO4 +3H2O 2MnO 5SO 6H 2Mn 5SO 3H2O 2 4 2 2 4 3 + + = + + - - + + - - - - + ① MnO + SO SO + Mn 2 2 4 2 4 3 2KMnO4 5K SO3 3H SO2 4 + + 2