
第七章氨基酸代谢 大脑产生异常抑制。这可能是肝性脑病发生的原因之一。 CH,NH, CHaNH CHNH H-C-OH H-C-OH OH 苯乙胺 苯乙醇胺 略胺 B-羟略胺 2.氨的生成未被吸收的氨基酸在肠道细菌作用下,通过脱氨基作用生成氨(ammonia),这是肠道 氨的重要来源之一。此外,肠道氨的另一来源是血液中的尿素渗入肠道,经肠道细菌尿素酶水解而生成 氨。肠道内产生的氨可进入血液,成为血氨的来源之一。降低肠道的pH,可减少氨的吸收。 3。其他有害物质的生成除胺类和氨外,通过腐败作用还可产生其他有害物质,如:酪氨酸可产生 苯酚、甲苯酚:色氨酸可产生吲引哚、甲基吲哚,导致粪便臭味;半胱氨酸可分解产生H,S,导致消化吸收不 良、腹胀等。 正常情况下,腐败作用产生的有害物质大部分随粪便排出体外,只有小部分被吸收进入血液,经肝 的生物转化而解毒,故不会发生中毒现象。但习惯性便秘、肠梗阻、蛋白质食用过量或消化吸收障碍者」 腐败产物吸收增加,严重时可产生中毒现象。 二、组织蛋白质的降解 虽然机体依靠食物蛋白质补充氨基酸,但机体内游离氨基酸并非全部来自食物蛋白质。在人体的 生命活动中,体内蛋白质处于不断合成与降解的动态平衡。所以,机体内游离氨基酸也包含由体内组织 蛋白质降解产生的氨基酸。 正常情况下,成人体内的蛋白质每天约有1%一2%被隆解其中主要是肌肉蛋白质。在特殊生理 情况下的组织,如妊娠期间的子宫、严重饥饿和长期大量体能消耗下的骨酪肌组织等,其组织蛋白质会 发生快速降解。蛋白质降解产生的氨基酸,大约75%~80%又被重新利用合成新的蛋白质,其余 20%~25%机体不予储存,全部进入氨基酸代谢库,参加氨基酸的分解与转化代谢 (一)蛋白质降解速率 所有生命体的蛋白质都在不断更新。体内的任何一种蛋白质都不会长期存在而不被降解,也就 是说体内的任何蛋白质都会被降解。蛋白质降解速率可用半寿期(half life,ta)表示,即指蛋白质降 解到其原浓度一半所需要的时间。蛋白质降解速率随生理需要而变化,在各种蛋白质之间有很大差 异。细胞内必要的结构蛋白寿命都比较长,而负责细胞特殊应变的调节蛋白寿命往往比较短。例 如.肝中大部分蛋白质的t,为1~8天,人血浆蛋白质的约为10天,结缔组织中的一些蛋白质的 t可达180天以上,眼晶体蛋白质的2更长。体内许多关键酶的都很短,如HMG-CoA还原酶的 为0.5~2小时。有些调控基因表达和细胞间信息传递的蛋白因子的t仅在分秒之间。细胞内 蛋白质寿命与其结构相关。通常认为在蛋白质N端特定区域的氨基酸序列中包含了决定其半寿期 的结构信号。 (二)真核细胞蛋白质降解途径 细胞内蛋白质的降解也是通过一系列蛋白酶和肽酶完成的。蛋白质被蛋白酶水解成肽,肽被肽酶 降解成游离氨基酸。但是,这些酶不能任意水解细胞内的蛋白质,否则细胞会被迅速破坏。细胞内蛋白 质的降解是主动调节的过程。真核细胞内蛋白质的降解主要有两条途径:一条是蛋白质通过不依赖 ATP的溶酶体途径降解,另一条是蛋白质通过依赖ATP的泛素-蛋白南体途径降解 1.不依赖ATP的溶酶体途径 溶酶体是细胞内的消化器官,含有多种酸性蛋白水解酶,又称组织 蛋白酶。这些酶对所降解蛋白质选择性较差。此途径主要降解外源性蛋白、膜蛋白和胞内长寿命蛋白。 187

第二篇物质代谢及其调节 蛋白质通过此途径降解,不需要消耗ATP 根据完成生理功能的不同阶段,溶酶体可分为初级溶酶体、次级溶酶体和残体。初级溶酶体由高尔 基体分泌形成,含有多种水解酶原,当其他物质进入溶酶体或溶酶体破裂时酶才被激活。除组织蛋白酶 外,初级溶酶体还含有磷脂酶、核酸酶、磷酸酶、硫酸酯酶等多种酸性水解酶,反应的最适pH5左右。次 级溶酶体是正在进行或完成消化作用的消化泡,含有水解酶和相应底物,自噬溶酶体消化来自细胞自身 的各种组分,异噬溶酶体消化外源物质。残体又称后溶酶体,已经失去酶活性,仅留未消化的残渣。残 体可以通过外排作用排出细胞,也可以留在细胞内逐年增多。具有摄人胞外物质能力的细胞,可以通过 内吞作用摄入胞外蛋白质,由溶酶体的组织蛋白酶将其降解。溶酶体也可以清除细胞自身无用的生物 大分子、衰老细胞器等,即自体吞噬,并将其降解。 2.依赖ATP的泛素蛋白酶体途径泛素-蛋白酶体途径广泛存在于细胞核和胞质内,主要降解异 常蛋白质和短寿命蛋白质。整个降解过程在碱性(H7.8)条件下进行。此途径需要泛素、蛋白酶体和 ATP的参与. 泛素(ubiquitin,Ub)是种由76个氨基酸残基组成的小分子蛋白质.分子量为8.5kDa.因其广 存在于真核细胞而得名。泛素介导的蛋白质降解过程是一个复杂的过程。首先泛素与被选择降解的 蛋白形成共价连接,使其带上泛素标记并被激活,然后蛋白酶体(proteasome)特异性识别泛素标记的蛋 白质并将其降解,泛素的这种标记作用称为泛素化。粑蛋白的泛素化包括三种酶参与的3步反应,并消 耗ATP(图7-4)。一种蛋白质的降解需进行 多次泛煮化反应.形成聚多素裤。泛素错 w-&-+s- ATP AMP+PPI 如同贴在靶蛋白上的“死亡”标签。标签有长 有短,酵母细胞中一般是4聚泛素链,哺乳动 物中一般为6或7聚泛素链。其后,聚泛素化 HS Ea HS-E Ub- -5-E 蛋白质在蛋白酶体降解,产生一些7~9个氨 基酸残基组成的寡肽,寡肽进一步水解生成 氨基酸。 -S-Ea Ea 蛋白酶体是1个26S的蛋白质复合物,由 围74蛋白质降解的泛素化反应 1个20S的核心颗粒和2个19S的调节颗粒 Ub:泛素:E,:泛素激活酶:E:泛素结合酶:E:泛素蛋白连 组成。核心颗粒是由4个环(2个a环和2个 接酶 B环)组成的圆柱体,中心是空腔。2个α环 分别位于圆柱体的上下两端,2个B环则夹在2个a环之间。每个a环由7个α亚基组成,每个B环由 7个B亚基组成。核心顺粒是蛋白酶体的水解核心,活性位点位于2个B环上,B环7个亚基中有3个 亚基具有蛋白酶活性,可催化不同蛋白质降解。2个19S的调节颗粒分别位于柱形核心颗粒的两端,形 成空心圆柱的帽盖。每个调节颗粒由18个亚基组成,其中某些亚基识别、结合待降解的聚泛素化蛋白 质,有6个亚基具有ATP酶活性,与蛋白质的去折叠、解聚合有关。 三、营养非必需氨基酸的体内合成 人体可以通过不同代谢途径合成营养非必需氨基酸,其碳骨架主要来自糖酵解和三羧酸循环的中 间代谢产物,少数由营养必需氨基酸生成。合成流程短。 (一)谷氨酸的合成 -铜戊二酸是三酸酸循环的中间产物,也是合成谷氨酸的重要原料。在L-谷氨酸脱氢酶催化下,α 酮戊二酸氨化并还原生成谷氨酸。此反应不仅催化谷氨酸的合成,还构成了许多其他氨基酸合成途径 中关键性的一步。 (二)丙氨酸和天冬氨酸的合成 丙酮酸通过转氨基作用生成丙氨酸,草酰乙酸通过转氨基作用生成天冬氨酸 二者均可从谷氨酸获 188
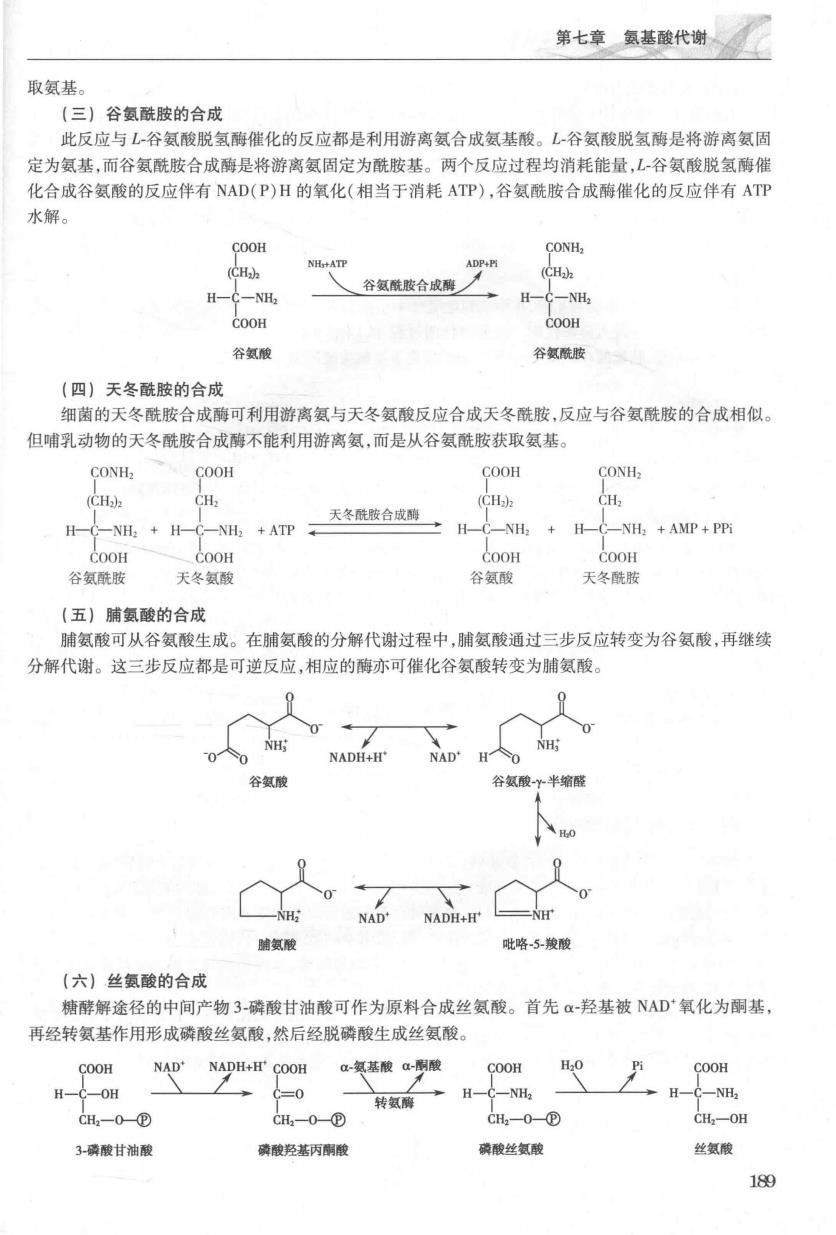
第七章氨基酸代谢 取氨基 (三)谷氨酰胺的合成 此反应与L谷氨酸脱氢酶催化的反应都是利用游离氨合成氨基酸。L谷氨酸脱氢酶是将游离氨固 定为氨基,而谷氨酰胺合成薄是将游离氨固定为酰胺基。两个反应过程均消耗能量,L-谷氨酸脱氢酶性 化合成谷氨酸的反应伴有NAD(P)H的氧化(相当于消耗ATP),谷氨酰胺合成酶催化的反应伴有ATP 水解。 COOH CONH (CH) (CH H-C-NH H-C-NH COOH COOH 谷氨酸 谷氨酰胺 (四】天冬酷胺的合成 细菌的天冬酰胺合成酶可利用游离氨与天冬氨酸反应合成天冬酰胺,反应与谷氨酰胺的合成相似。 但哺乳动物的天冬酰胺合成酶不能利用游离氨,而是从谷氨酰胺获取氨基。 CONH COOH COOH CONH (CH) CH (CH) 天冬酰胺合成酶 H-NH+H-C-NH+ATP H-C-NH +H-C-NH+AMP+P COoH 00 COOH Coon 谷氨酰胺 天冬氨酸 谷氨酸 天冬酰 (五)脯氨酸的合成 脯氨酸可从谷氨酸生成。在脯氨酸的分解代谢过程中,脯氨酸通过三步反应转变为谷氨酸,再继续 分解代谢。这三步反应都是可逆反应,相应的酶亦可催化谷氨酸转变为脯氨酸 NH:0 NADH+H' NH: 半缩 氨酸 毗略5骏酸 (六)丝氨酸的合成 糖酵解途径的中间产物3磷酸甘油酸可作为原料合成丝氨酸。首先α羟基被NAD氧化为酮基 再经转氨基作用形成磷酸丝氨酸,然后经脱磷酸生成丝氨酸。 COOH NADNADH+H'COOH-氨基酸a酸 COOH C-OH 转氨→H一一NH, C-NH CH2一0@ CH一0① CH0② CH,-OH 3-磷酸甘油酸 磷酸羟基丙酮酸 膜酸丝氨酸 丝氨酸 189

第二篇物质代谢及其调节 (七)甘氨酸的合成 肝细胞胞质中有甘氨酸转氨酶,能催化氨基从谷氨酸转移到乙醛酸从而合成甘氨酸。此外,还 有两条甘氨酸合成途径:一条是由胆碱合成甘氨酸,另一条是由丝氨酸在羟甲基转移酶催化下合成 甘氨酸。 NH, H0-CH一H-C0OHH,是甲基转移猜一NN-0H一FH+H,N一CH一0OOH 丝氨酸 N3N0甲烯四氢叶酸 甘氨酸 (八)半胱氨酸的合成 甲硫氨酸是营养必需氨基酸,在甲硫氨酸循环中生成同型半胱氨酸。同型半胱氨酸可重新甲基化 生成甲硫氨酸,也可进人分解代谢。在分解代谢过程中,同型半胱氨酸与丝氨酸经胱硫醚B合酶的催 化缩合成胱硫醚,胱硫醚在胱硫醚Y裂解酶的催化下水解生成同型丝氨酸和半胱氨酸。 00H COOH COOH COOH NH:-:H COOH COOH H-NH2 H-(-NH2 (CH22 (CHa)2 CHz-OH CHa-S-(CHa) CHz-SH 丝氨酸 同型半胱氨 胱硫脒 半酰氨酸 同型丝氨酸 (九)酪氨酸的合成 苯丙氨酸在苯丙氨酸羟化酶的催化下可生成酪氨酸。此反应不可逆。苯丙氨酸羟化酶主要存在于 肝组织,是一种加单氧酶,辅酶是四氢生物蝶呤。苯丙氨酸是营养必需氨基酸。食物中有足量苯丙氨酸 时,不需提供酪氨酸。食物中酪氨酸含量充足时,可以减少苯丙氨酸向酪氨酸的转变。 COOH COOH H C-NH> 苯丙氨酸羟化→ H-C-NH: +0 苯丙氨酸 NADP NADPH+H' 酪氨酸 四、氨基酸代谢库 食物蛋白质经消化而被吸收的氨基酸(外源性氨基酸)与体内组织蛋白质降解产生的氨基酸以及 体内合成的非必需氨基酸(内源性氨基酸)混合在一起,分布于体内各处,参与体内氨基酸的代谢,称为 氨基酸代谢库(amino acid metabolic pool)。怎基酸代谢库通常以游离氨基酸总量计算.由于氨基酸不 能自由通过细胞膜,所以在体内的分布是不均一的,肌肉中的氨基酸占代谢库的50%以上,肝中约占 10%,肾中占4%,血浆中占1%~6%。消化吸收的大多数氨基酸,如丙氨酸和芳香族氨基酸等主要在 肝中分解,而支链氨基酸主要在骨骼肌中分解。 体内氨基酸的主要功能是合成蛋白质和多肽,也可转变成其他含氮化合物。正常人尿中排出的氨 基酸极少,每日约1g左右。由于各种氨基酸具有共同的结构特点,因而代谢途径有共同之处。但不同 氨基酸由于结构的差异,代谢方式也有各自不同之处。体内氨基酸代谢的概况见图7-5。 190

第七卓氨基酸代湖 非必需氨基 食物蛋白质消化吸收 →a-啊酸 脱氨基作用 组织蛋白质分解 →NH,→尿素 合成 脱骏作用类+60, 体会 代谢转变、其他含氯化合物(眼吟、密啶等】 图75氨基酸代谢概况 第三节氨基酸的一般代谢 氨基酸具有共同的结构特点,因而它们的代谢途径有共同之处。氨基和α酮酸是氨基酸最具代表 性的共性结构,本节主要讨论氨基酸的脱氨基作用、体内氨的代谢以及氨基酸骨架α酮酸的代谢。 一、氨基酸的脱氨基作用 氨基酸脱去氨基生成氨及相应的α-酮酸的过程,称为氨基酸脱氨基作用。这是氨基酸的主要分钢 代谢途径。氨基酸的脱氨基作用在体内大多数组织中均可进行。氨基酸可以通过多种方式脱去氨基, 例如转氨基、氧化脱氨基和联合脱氨基等,其中以联合脱氨基最为重要。 (一)转氨基作用 1.转复基作用与转氨酶转复基作用(transamination)是指在转氨酶(transaminase)催化下,a-氨其 酸的氨基转移到α酮酸的酮基碳原子上,结果是原来的氨基酸脱去氨基生成了相应的α-酮酸,而原来 的α-酮酸则转变成相应的氨基酸。 R R2 H-C-NHz COOH COOH COOH 这是一种体内普遍存在的脱氨基方式,但在转氨基作用中没有游离氨的生成。转氨基作用的平衡 常数接近于1,反应可逆。因此,转氨基作用既是氨基酸的分解代谢过程,也是体内某些氨基酸(营养非 必需氨基酸)合成的重要途径。除赖氨酸、苏氨酸、脯氨酸及羟脯氨酸外,体内大多数氨基酸都可以参 与转氨基作用。除了α-氨基外,氨基酸侧链末端的氨基,如鸟氨酸的8氨基也可通过转氨基作用而 脱去 转氨酶也称为氨基转移酶(aminotransferase),广泛分布于体内各组织中,具有底物专一性,不同氨 基酸与α酮酸之间的转氨基作用只能由专一的转氨酶催化。体内存在着多种转氨酶,其中以L谷氨酸 和a-酮酸的转氨酶最为重要,例如,谷丙转氨酶(glutamic pyruvic transaminase,GPT)又称丙氨酸转氨酶 (alanine transaminase,ALT)和谷草转氨酶(glutamic oxaloacetic transaminase,C0T)又称天冬氨酸转氨酶 (aspartate transaminase,AST),在氨基酸代谢中最为活跃,它们在体内广泛存在,但在各组织中含量不同 (表7-2)。 191