
本报告期内国家局共批准境外生产药品再注册申请99件,其中中 药天然药物4件,化学药品88件,生物制品7件。详见附表1川。 10.国家局受理药品补充中请审批情况 本报告期内国家局共批准药品补充申请1193作,其中中药天然药 物102件,化学药品887件,生物制品204件;共批准备案申请156 件,其中中药天然药物4件,化学药品119件,生物制品33件。详见 附表12. 11.省局受理/接收事项审批情况 本报告期内全国各省(区,市)局共批准通过药品上市后变更备案 4777件,其中中药天然药物2696件,化学药品1993件,生物制品88 作。详见附表13. 12.接药品管理的体外诊断试剂上市中请的审批情况 本报告期内国家局共批准按药品管理的体外诊断试剂上市申请0 件.详见附表14 13.按药品管理的体外珍断试剂再注册及补充中请的审批情况 本报告期内国家局共批准按药品管理的体外诊断试剂再注册申请 0件,补充申请2件.详见附表15. 14.批准创新药上市情况 本报告期内国家局共批准创新药上市品种8个,其中中药天然药物 0个,化学药品4个,生物制品4个,详见附表16. 15.批准创新药临床试脸情况 本报告期内国家局共批准创新药临床品种266个,其中药天然药物 9个,化学药品183个,生物制品74个,详见附表17. (三)国产、进口药品批准文号情况 截至2021年3月底,共有国产药品批准文号149519件,其中中药
3 本报告期内国家局共批准境外生产药品再注册申请 99 件,其中中 药天然药物 4 件,化学药品 88 件,生物制品 7 件。详见附表 11。 10. 国家局受理药品补充申请审批情况 本报告期内国家局共批准药品补充申请 1193 件,其中中药天然药 物 102 件,化学药品 887 件,生物制品 204 件;共批准备案申请 156 件,其中中药天然药物 4 件,化学药品 119 件,生物制品 33 件。详见 附表 12。 11. 省局受理/接收事项审批情况 本报告期内全国各省(区、市)局共批准通过药品上市后变更备案 4777 件,其中中药天然药物 2696 件,化学药品 1993 件,生物制品 88 件。详见附表 13。 12. 按药品管理的体外诊断试剂上市申请的审批情况 本报告期内国家局共批准按药品管理的体外诊断试剂上市申请 0 件。详见附表 14。 13. 按药品管理的体外诊断试剂再注册及补充申请的审批情况 本报告期内国家局共批准按药品管理的体外诊断试剂再注册申请 0 件,补充申请 2 件。详见附表 15。 14. 批准创新药上市情况 本报告期内国家局共批准创新药上市品种 8 个,其中中药天然药物 0 个,化学药品 4 个,生物制品 4 个。详见附表 16。 15. 批准创新药临床试验情况 本报告期内国家局共批准创新药临床品种 266 个,其中药天然药物 9 个,化学药品 183 个,生物制品 74 个。详见附表 17。 (三)国产、进口药品批准文号情况 截至 2021 年 3 月底,共有国产药品批准文号 149519 件,其中中药
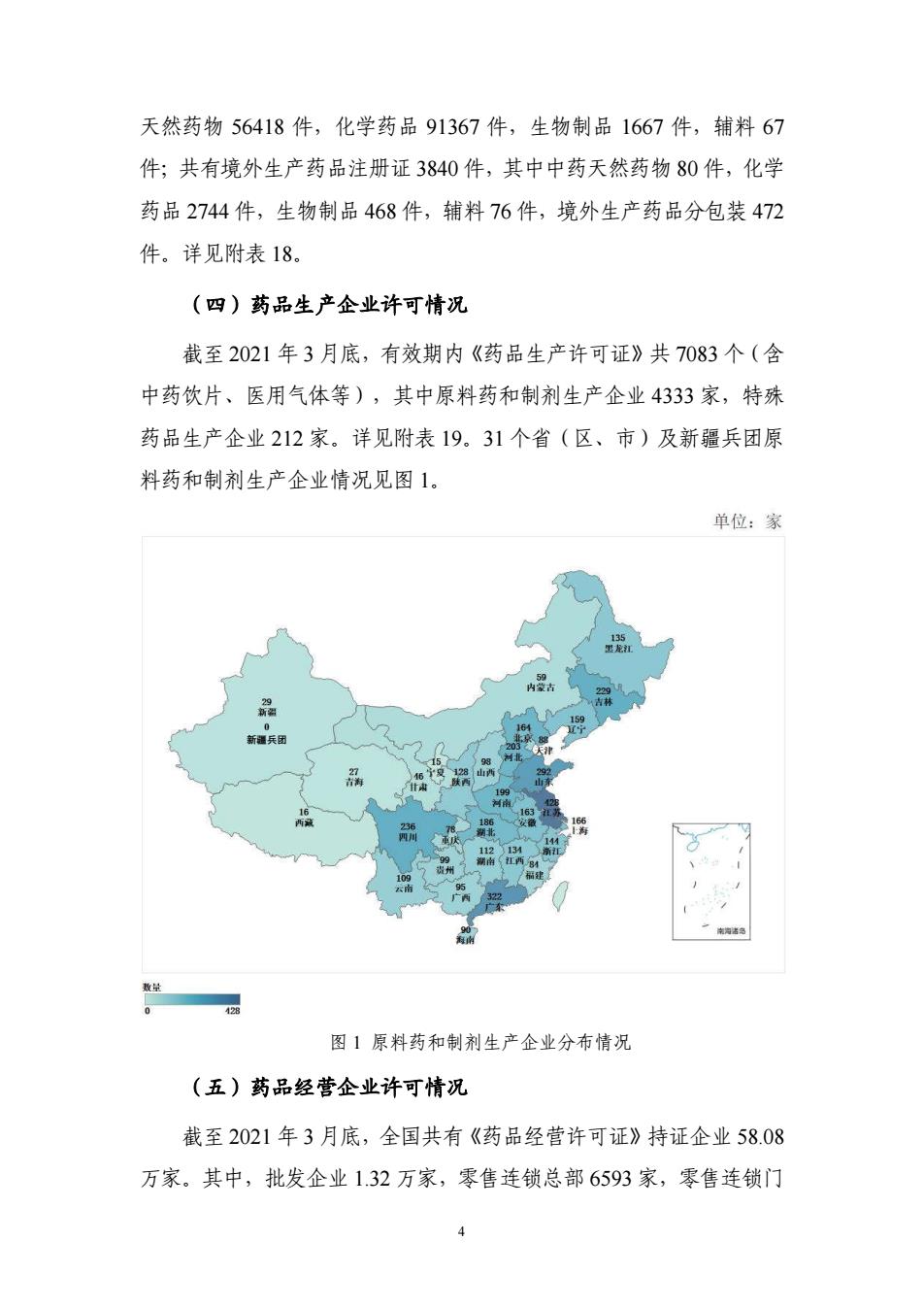
天然药物56418件,化学药品91367件,生物制品1667件,辅料67 件:共有境外生产药品注册证3840件,其中中药天然药物80件,化学 药品2744件,生物制品468件,辅料76件,境外生产药品分包装472 作。详见附表18。 (四)药品生产企业许可情况 截至2021年3月底,有效期内《药品生产许可证》共7083个(含 中药饮片、医用气体等),其中原料药和制剂生产企业4333家,特殊 药品生产企业212家。详见附表19.31个省(区,市)及新最兵团原 料药和制剂生产企业情况见图1. 单位:家 图」原料药和制荆生产全业分布情况 (五)药品经营企业许可情况 截至2021年3月底,全国共有《药品经营许可证》持证企业58.08 万家.其中,批发企业132万家,零售连锁总都6593家,零售连锁门
4 天然药物 56418 件,化学药品 91367 件,生物制品 1667 件,辅料 67 件;共有境外生产药品注册证 3840 件,其中中药天然药物 80 件,化学 药品 2744 件,生物制品 468 件,辅料 76 件,境外生产药品分包装 472 件。详见附表 18。 (四)药品生产企业许可情况 截至 2021 年 3 月底,有效期内《药品生产许可证》共 7083 个(含 中药饮片、医用气体等),其中原料药和制剂生产企业 4333 家,特殊 药品生产企业 212 家。详见附表 19。31 个省(区、市)及新疆兵团原 料药和制剂生产企业情况见图 1。 图 1 原料药和制剂生产企业分布情况 (五)药品经营企业许可情况 截至 2021 年 3 月底,全国共有《药品经营许可证》持证企业 58.08 万家。其中,批发企业 1.32 万家,零售连锁总部 6593 家,零售连锁门 0 新疆兵团
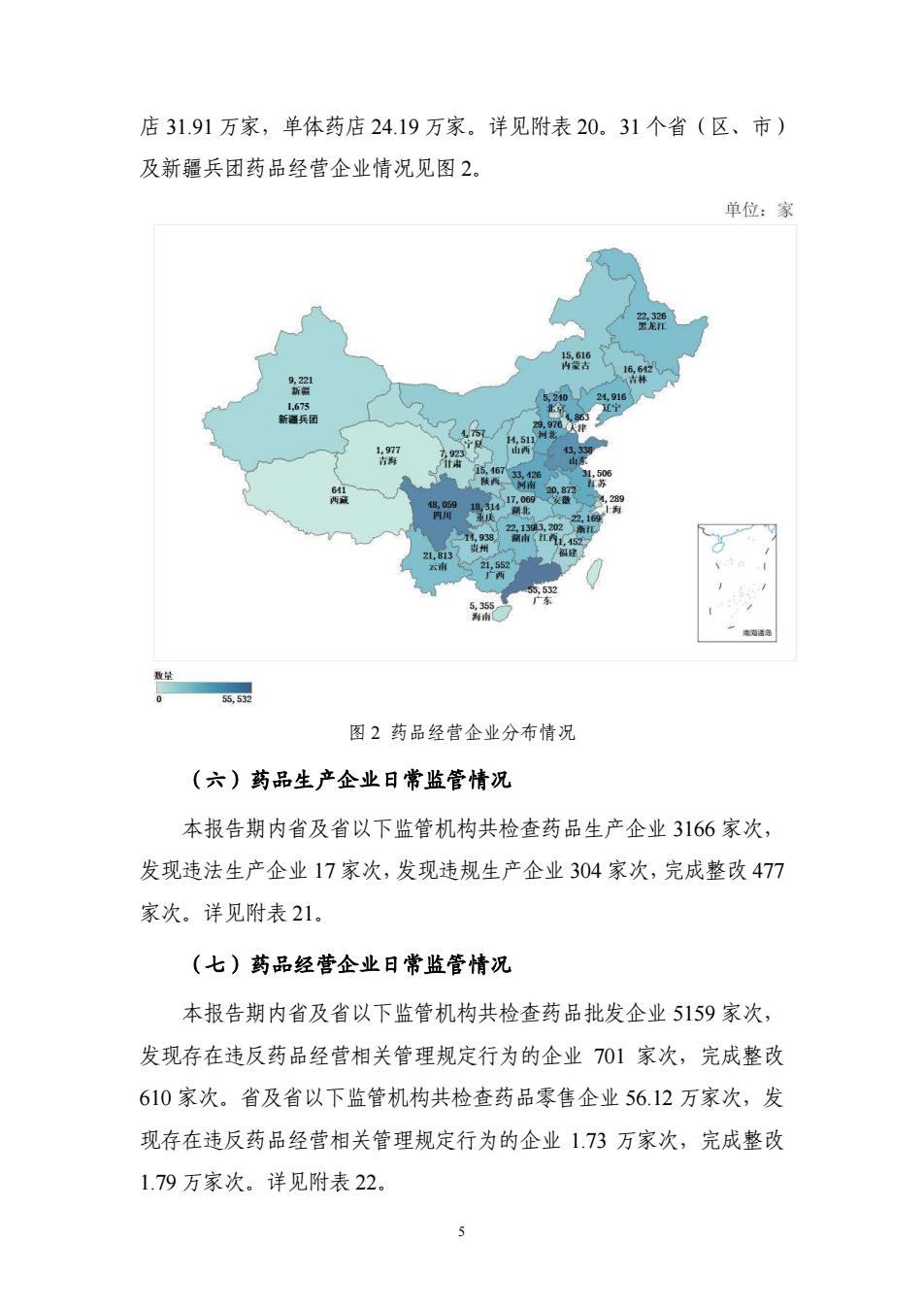
店31.91万家,单体药店24.19万家.详见附表20.31个省(区、市) 及新疆兵团药品经营企业情况见图2, 单位:家 图2药品经管企业分布情况 (六)药品生产企业日常监管情况 本报告期内省及省以下监管机构共检查药品生产企业3166家次, 发现违法生产企业17家次,发现违规生产企业304家次,完成整改477 家次。详见附表21. (七)药品经营全业日常监管情况 本掇告期内省及省以下监管机构共检查药品批发企业5159家次, 发现存在违反药品经营相关管理规定行为的企业701家次,完成整改 610家次。省及省以下监管机构共检查药品零售企业56.12万家次,发 现存在违反药品经营相关管理规定行为的企业173万家次,完成整改 1.79万家次。详见附表22
5 店 31.91 万家,单体药店 24.19 万家。详见附表 20。31 个省(区、市) 及新疆兵团药品经营企业情况见图 2。 图 2 药品经营企业分布情况 (六)药品生产企业日常监管情况 本报告期内省及省以下监管机构共检查药品生产企业 3166 家次, 发现违法生产企业 17 家次,发现违规生产企业 304 家次,完成整改 477 家次。详见附表 21。 (七)药品经营企业日常监管情况 本报告期内省及省以下监管机构共检查药品批发企业 5159 家次, 发现存在违反药品经营相关管理规定行为的企业 701 家次,完成整改 610 家次。省及省以下监管机构共检查药品零售企业 56.12 万家次,发 现存在违反药品经营相关管理规定行为的企业 1.73 万家次,完成整改 1.79 万家次。详见附表 22。 1,675 新疆兵团

(入)互联网药品信息服务机构审批情况 截至2021年3月底,各省(区、市)审批互联网药品信息服务机 构18489家.详见附表23. (九)地方药品抽检情况 本报告期内各省(区、市)共检验药品9481批次,不合格51批次, 不合格率0.54%.详见附表24. (十)进口药品检验情况 本报告期内中检院及19个口岸药检所对涉及39个国家或地区的 1881批次、34.21亿美元的申请进口药品进行了检验,检验药品批次数 同比增加27.96%(去年同期1470批次),金颛数同比增加62.90%(去 年同期21亿美元),检验不合格39批次,占总批次的2.07%,不合格 药品金额达467.87万关元.进口药品检验情况详见附表25-27. (十一)药品案件查处情况 本报告期内全国共查处药品违法案件769%件,案件货值金额共计 9644.67万元。罚款金额共1872823万元,没收违法所得5533.72万元, 责令关闭10家,捣毁制很售假窝点18个,责令停产停业86家(包括 生产企业6家和经营企业80家),吊销许可证8件(均为经营许可证), 移送司法机关80件。 查处药品案件数量排在前5位的省份依次为四川、山东、安微、河 北、河南。从货值划分来看,货值10万元以下的案件有7632作,占药 品案件总数的99.17%:货值10万元至20万元的案件有28件,占比 036%;货值20万元至50万元的案件有14件,占比0.18%:货值50 万元至1000万元的案件有21件,占比0.27%:货值1000万元至1亿 元的案件有1件,由福建查处;本报告期内未查处1亿元以上的药品类 6
6 (八)互联网药品信息服务机构审批情况 截至 2021 年 3 月底,各省(区、市)审批互联网药品信息服务机 构 18489 家。详见附表 23。 (九)地方药品抽检情况 本报告期内各省(区、市)共检验药品 9481 批次,不合格 51 批次, 不合格率 0.54%。详见附表 24。 (十)进口药品检验情况 本报告期内中检院及 19 个口岸药检所对涉及 39 个国家或地区的 1881 批次、34.21 亿美元的申请进口药品进行了检验,检验药品批次数 同比增加 27.96%(去年同期 1470 批次),金额数同比增加 62.90%(去 年同期 21 亿美元)。检验不合格 39 批次,占总批次的 2.07%,不合格 药品金额达 467.87 万美元。进口药品检验情况详见附表 25~27。 (十一) 药品案件查处情况 本报告期内全国共查处药品违法案件 7696 件,案件货值金额共计 9644.67 万元。罚款金额共 18728.23 万元,没收违法所得 5533.72 万元, 责令关闭 10 家,捣毁制假售假窝点 18 个,责令停产停业 86 家(包括 生产企业 6 家和经营企业 80 家),吊销许可证 8 件(均为经营许可证), 移送司法机关 80 件。 查处药品案件数量排在前 5 位的省份依次为四川、山东、安徽、河 北、河南。从货值划分来看,货值 10 万元以下的案件有 7632 件,占药 品案件总数的 99.17%;货值 10 万元至 20 万元的案件有 28 件,占比 0.36%;货值 20 万元至 50 万元的案件有 14 件,占比 0.18%;货值 50 万元至 1000 万元的案件有 21 件,占比 0.27%;货值 1000 万元至 1 亿 元的案件有 1 件,由福建查处;本报告期内未查处 1 亿元以上的药品类

案件。 从违法主体来看,药品生产企业案件有193件,占全部药品案件数 的2.51%:经营企业案件5516件,占比71.67%;医疗机构案件有1703 作,占比22.13%;其他主体案件有284件,占比369%. 生产销售假劣药品方面,共查处生产销售和使用假劣药案件1841 作(其中通过互联网销售假劣药案件5件),货值金额2122.82万元, 罚款6634.73万元,移送司法机关51件.详见附表28. 二、医疗器械监督管理 (一)医疗器械行政受理情况 本报告期内,全国共完成第一类医疗器械备案7453件,其中,境 内第一类医疗器械备案T264件,进口第一类医疗器械备案189件,全 国共受理首次注册申请4123件,其中,境内第二类首次注册医疗器械 3560件,境肉第三类首次注册医疗器械377件,进口首次注册医疗器 械(含港澳台)186件。全国共受理延续注册申请3862件,其中,境 内第二类医疗器械延续注册申请2460件,境内第三类医疗器械延续注 册申请516件,进口医疗器械(含港澳台)延续注册申请886件.详见 附表29. (二)医疗器械产品注册情况 本报告期内,全国共批准各类医疗器械首次注册3358件,延续注 册4380件,其中,批准境内第二类医疗器械首次注册3028件,境内第 三类医疗器械首次注册228件,进口医疗器械(含港澳台)首次注册102 件;批准境内第二类医疗器械延续注册2739件,境内第三类医疗器械 延续注册619件,进口医疗器械(含港澳台)延续注册1022件 截至2021年3月底,全国累计共有境内第一类医疗器械备案
7 案件。 从违法主体来看,药品生产企业案件有 193 件,占全部药品案件数 的 2.51%;经营企业案件 5516 件,占比 71.67%;医疗机构案件有 1703 件,占比 22.13%;其他主体案件有 284 件,占比 3.69%。 生产销售假劣药品方面,共查处生产销售和使用假劣药案件 1841 件(其中通过互联网销售假劣药案件 5 件),货值金额 2122.82 万元, 罚款 6634.73 万元,移送司法机关 51 件。详见附表 28。 二、医疗器械监督管理 (一)医疗器械行政受理情况 本报告期内,全国共完成第一类医疗器械备案 7453 件,其中,境 内第一类医疗器械备案 7264 件,进口第一类医疗器械备案 189 件。全 国共受理首次注册申请 4123 件,其中,境内第二类首次注册医疗器械 3560 件,境内第三类首次注册医疗器械 377 件,进口首次注册医疗器 械(含港澳台)186 件。全国共受理延续注册申请 3862 件,其中,境 内第二类医疗器械延续注册申请 2460 件,境内第三类医疗器械延续注 册申请 516 件,进口医疗器械(含港澳台)延续注册申请 886 件。详见 附表 29。 (二)医疗器械产品注册情况 本报告期内,全国共批准各类医疗器械首次注册 3358 件,延续注 册 4380 件。其中,批准境内第二类医疗器械首次注册 3028 件,境内第 三类医疗器械首次注册 228 件,进口医疗器械(含港澳台)首次注册 102 件;批准境内第二类医疗器械延续注册 2739 件,境内第三类医疗器械 延续注册 619 件,进口医疗器械(含港澳台)延续注册 1022 件。 截至 2021 年 3 月底,全国累计共有境内第一类医疗器械备案