
、生化实验基本技术(一)光谱光度分析技术利用各种化学物质一一包括原子、基团、分子及高分化合物,所具有的发射、吸收或散射光谱谱系(带、线)的特征来确定其性质、结构及含量的技术,称为光谱光度分析技术(spectrmspectrophotometryanalysistechnology)。光属于电磁波,由连续的、波长渐变的谱线组成。肉眼可见的部分称为可见光,分光后,具有红、橙、黄、绿、兰及紫色彩。红光波长较长、紫光波长较短。红外光及紫外光均为肉眼不可见。如表1所示,如果两种光按一定比例混合后,可以得到白光,这两种光称为互补色光。表1波长与色泽及其互补色泽的关系色泽近似波长范围(nm)互补色泽10~200远紫外(不可见)200~400近紫外(不可见)绿紫400~430蓝黄430~460青橙红460~490490~570绿紫红黄蓝570~600橙青600~630红蓝绿630~780(2.5~50)X103红外(不可见)(50~300)×103远红外(不可见)物质分子内部具有(1)电子运动能量(2)分子振动能量及(3)分子转动能量三种能级。这些能级的跃迁可决定物质对光谱的吸收波长。而影响能级跃迁,主要决定于分子内部的双键数目、未共享电子对的共轭状态和几何排列以及饱和基对它们围绕状态。主要的基团及特有的吸收峰如表2.表2主要发色基团的吸收峰基因吸收波长nm基因吸收波长nm乙烯基175亚硝酸基230乙炔基基210160羧基330180~320硫铜基硝酸基270亚硝基300光谱是复合光经色散后的单色光按一定顺序排成一幅光的色谱。光谱光度分析技术,即是在物质分子结构与光谱特征密切相关的基础上建立起来的。按原理,又可分为:(1)吸收光谱分析;(2)发射光谱分析;(3)散射光谱分析三大类,简述于后。1.吸收光谱分析(1)透光度与吸光度1
1 一、生化实验基本技术 (一)光谱光度分析技术 利用各种化学物质-包括原子、基团、分子及高分化合物,所具有的发射、吸收或散射 光谱谱系(带、线)的特征来确定其性质、结构及含量的技术,称为光谱光度分析技术(spectrm spectrophotometry analysis technology)。 光属于电磁波,由连续的、波长渐变的谱线组成。肉眼可见的部分称为可见光,分光后, 具有红、橙、黄、绿、兰及紫色彩。红光波长较长、紫光波长较短。红外光及紫外光均为肉 眼不可见。 如表 1 所示,如果两种光按一定比例混合后,可以得到白光,这两种光称为互补 色光。 表 1 波长与色泽及其互补色泽的关系 ───────────────────────────── 近似波长范围(nm) 色 泽 互补色泽 ───────────────────────────── 10~200 远紫外(不可见) 一 200~400 近紫外(不可见) 一 400~430 紫 绿 430~460 蓝 黄 460~490 青 橙红 490~570 绿 紫红 570~600 黄 蓝 600~630 橙 青 630~780 红 蓝绿 (2.5~50)×103 红外(不可见) 一 (50~300)×103 远红外(不可见) 一 ───────────────────────────── 物质分子内部具有⑴电子运动能量⑵分子振动能量及⑶分子转动能量三种能级。这些能 级的跃迁可决定物质对光谱的吸收波长。而影响能级跃迁,主要决定于分子内部的双键数目、 未共享电子对的共轭状态和几何排列以及饱和基对它们围绕状态。主要的基团及特有的吸收 峰如表 2. 表 2 主要发色基团的吸收峰 ───────────────────────── 基因 吸收波长 nm 基因 吸收波长 nm ───────────────────────── 乙烯基 175 亚硝酸基 230 乙炔基 160 腈 基 210 羧 基 180~320 硫铜基 330 硝酸基 270 亚硝基 300 ───────────────────────── 光谱是复合光经色散后的单色光按一定顺序排成一幅光的色谱。光谱光度分析技术,即 是在物质分子结构与光谱特征密切相关的基础上建立起来的。按原理,又可分为:⑴吸收光 谱分析;⑵发射光谱分析;⑶散射光谱分析三大类,简述于后。 1.吸收光谱分析 ⑴透光度与吸光度
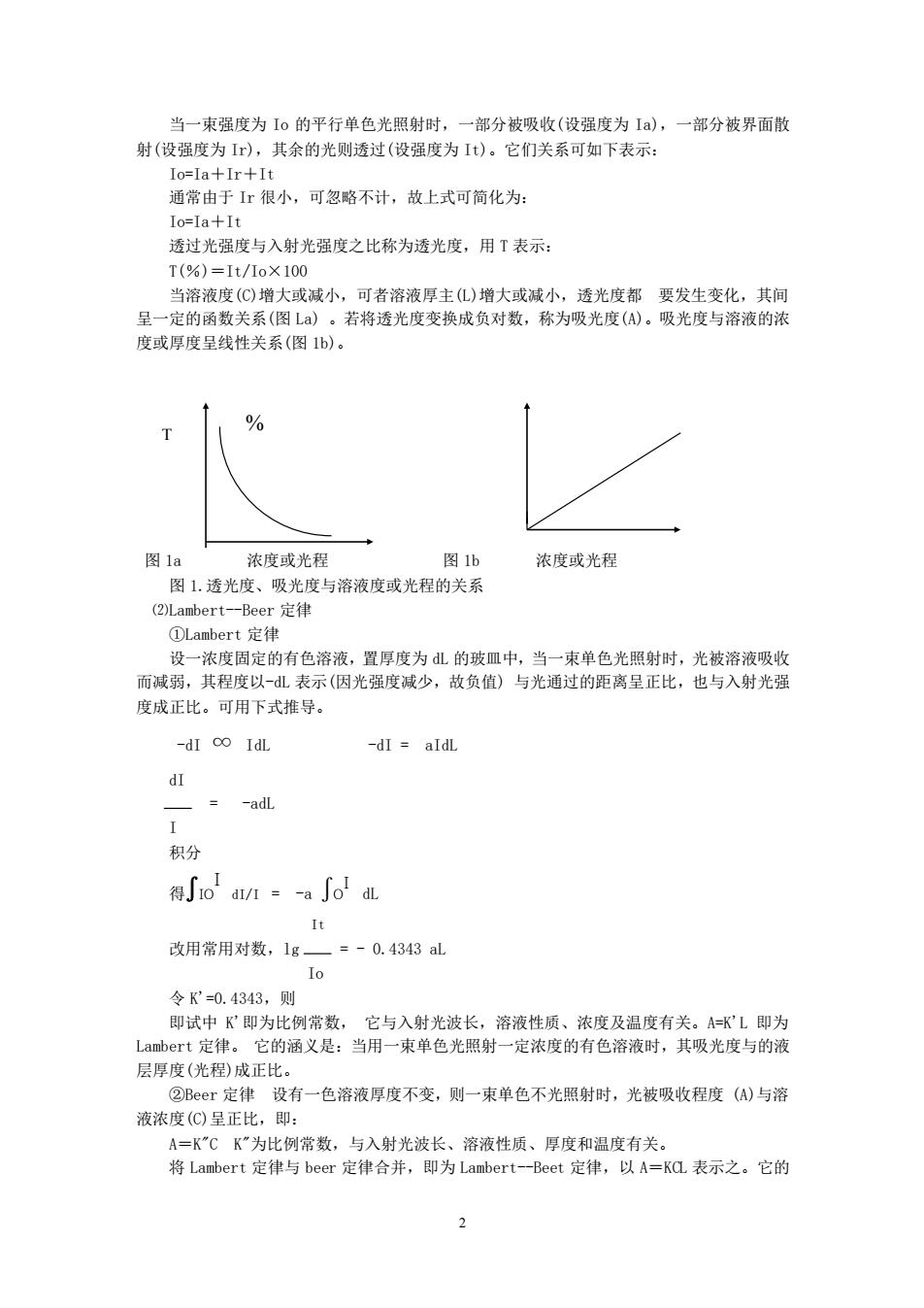
当一束强度为Io的平行单色光照射时,一部分被吸收(设强度为Ia),一部分被界面散射(设强度为Ir),其余的光则透过(设强度为It)。它们关系可如下表示:Io=Ia+Ir+It通常由于Ir很小,可忽略不计,故上式可简化为:Io=Ia+It透过光强度与入射光强度之比称为透光度,用T表示:T(%)=It/10X100当溶液度(C)增大或减小,可者溶液厚主(L)增大或减小,透光度都要发生变化,其间呈一定的函数关系(图La)。若将透光度变换成负对数,称为吸光度(A)。吸光度与溶液的浓度或厚度呈线性关系(图1b)。%T图1b图1a浓度或光程浓度或光程图1.透光度、吸光度与溶液度或光程的关系(2)Lambert--Beer定律①Lambert定律设一浓度固定的有色溶液,置厚度为L的玻皿中,当一束单色光照射时,光被溶液吸收而减弱,其程度以-dL表示(因光强度减少,故负值)与光通过的距离呈正比,也与入射光强度成正比。可用下式推导。-dI IdL-dI = aldLdI-adL-I积分得Jio dl/I =- -a Jol aIt改用常用对数,1g=-0.4343aL1o令K'=0.4343,则即试中K即为比例常数,它与入射光波长,溶液性质、浓度及温度有关。A=KL即为Lambert定律。它的涵义是:当用一束单色光照射一定浓度的有色溶液时,其吸光度与的液层厚度(光程)成正比。②Beer定律设有一色溶液厚度不变,则一束单色不光照射时,光被吸收程度(A)与溶液浓度(C)呈正比,即:A=K"CK”为比例常数,与入射光波长、溶液性质、厚度和温度有关。将Lambert定律与beer定律合并,即为Lambert--Beet定律,以A=KCL表示之。它的2
2 当一束强度为 Io 的平行单色光照射时,一部分被吸收(设强度为 Ia),一部分被界面散 射(设强度为 Ir),其余的光则透过(设强度为 It)。它们关系可如下表示: Io=Ia+Ir+It 通常由于 Ir 很小,可忽略不计,故上式可简化为: Io=Ia+It 透过光强度与入射光强度之比称为透光度,用 T 表示: T(%)=It/Io×100 当溶液度(C)增大或减小,可者溶液厚主(L)增大或减小,透光度都 要发生变化,其间 呈一定的函数关系(图 La)•。若将透光度变换成负对数,称为吸光度(A)。吸光度与溶液的浓 度或厚度呈线性关系(图 1b)。 图 1a 浓度或光程 图 1b 浓度或光程 图 1.透光度、吸光度与溶液度或光程的关系 ⑵Lambert-Beer 定律 ①Lambert 定律 设一浓度固定的有色溶液,置厚度为 dL 的玻皿中,当一束单色光照射时,光被溶液吸收 而减弱,其程度以-dL 表示(因光强度减少,故负值)•与光通过的距离呈正比,也与入射光强 度成正比。可用下式推导。 -dI ∞ IdL -dI = aIdL dI = -adL I 积分 得∫IO I dI/I = -a ∫O I dL It 改用常用对数,lg = - 0.4343 aL Io 令 K'=0.4343,则 即试中 K'即为比例常数, 它与入射光波长,溶液性质、浓度及温度有关。A=K'L 即为 Lambert 定律。 它的涵义是:当用一束单色光照射一定浓度的有色溶液时,其吸光度与的液 层厚度(光程)成正比。 ②Beer 定律 设有一色溶液厚度不变,则一束单色不光照射时,光被吸收程度•(A)与溶 液浓度(C)呈正比,即: A=K"C K"为比例常数,与入射光波长、溶液性质、厚度和温度有关。 将 Lambert 定律与 beer 定律合并,即为 Lambert-Beet 定律,以 A=KCL 表示之。它的 T %

涵义是:当一束单色光照射有色溶液时,其吸光度与溶液的浓度和厚度的乘积成正比。值得注意的是:溶液的厚度和浓度须在一定范围内,Lambert--Beer定律方才成立。当溶液的厚度固定为1cm时,对于某有色溶液在特定波长时的K值即为消光系数。(3)仪器简介常用吸收光谱仪器的工作原理可由图2示意尺1125346说明:1.光源2.透镜3.狭缝4.色散器5.比色血6.光电管及倍增管7.检流汁图2吸收光谱仪工作原理示图各类型仪器主要有:①光电比色计:如581型、GBS型等。是用滤色片滤去不需要的光谱而获得近似单色光(谱带较宽),如红光、绿光和蓝光。以光电池接受透过光。②可见光分光光度计,以卤钨灯为光源,具有色散系统(棱镜分光),以光电管接收透过光并经放大后再输入检流计。以721型最为普及。(3)紫外分光光度计:以氛灯作为光源,如核酸分析仪。必须使用石英比色皿。紫外与可见光两种光学系统组合在一起。如751、753、79、80型等。以光栅分光、数字显字吸光度(A)、透光度(T)并可转换成浓度(C)。有的还可附设打印系统。③半自动、全自动生化分析仪:从进样检测到发报告以及清洗均为微机控制程序。③原子吸收分光光度计:在燃气或高温条件下,样品原子化。其吸收特定波长的谱线后,原子跃迁到激发态。(激发态原子返迁回基态时,又放出电磁波。)吸收光量的多少与原子化的程度或样品的浓度有关。原子吸收分光光度计较普通分光光度计灵敏,主要用于检测微量元素。2.发射光谱分析主要有火焰激发光谱分析和荧光光谱分析。(1)火焰激发光谱分析原理:火焰使雾化样本产生原子化,外层电子跃迁到较高能级。此为激发态原子,极不稳定,返迁回基态后,发射出特定的谱线,其强弱与样本中该元素的浓度相关。火焰光度法主要用于人体常量元素,如K、Na、Ca的检测。仪器:火焰光度计(2)荧光不度分析法原理:荧光物质在紫光到紫外光谱激发下发出波长较长的谱线(多为红色)发生荧光其强弱与样本中荧光物质的浓度成正比。仪器:荧光光度计、荧光分光光度计。最近国外研制出时间分辨免疫荧光光度技术和相应的设备,把荧光检测技术推上一新的高度。(3)化学发光法采用化学发光仪检测化学反应中发出的光信号。3.散射、透射光谱分析原理:光线通过悬浊的介质溶液时,同时会发生反射、散射及透射现象,散射光强度与溶液中混悬颗粒的量成正比,测量散射光强度用以分析样本中的待测成分,称散射光谱分析。使用仪器为浊度计。如激光浊度计。3
3 涵义是:当一束单色光照射有色溶液时,其吸光度与溶液的浓度和厚度的乘积成正比。 值得注意的是:溶液的厚度和浓度须在一定范围内,Lambert-Beer 定律方才成立。 当溶液的厚度固定为 1cm 时,对于某有色溶液在特定波长时的 K 值即为消光系数。 ⑶仪器简介 常用吸收光谱仪器的工作原理可由图 2 示意 1 2 3 4 5 6 7 说明:1.光源 2.透镜 3.狭缝 4.色散器 5.比色皿 6.光电管及倍增管 7.检流汁 图 2 吸收光谱仪工作原理示图 各类型仪器主要有: ①光电比色计:如 581 型、GBS 型等。是用滤色片滤去不需要的光谱而获得近似单色光(谱 带较宽),如红光、绿光和蓝光。以光电池接受透过光。 ②可见光分光光度计,以卤钨灯为光源,具有色散系统(棱镜分光),以光电管接收透过 光并经放大后再输入检流计。以 721 型最为普及。 ⑶紫外分光光度计:以氘灯作为光源,如核酸分析仪。必须使用石英比色皿。 ④紫外与可见光两种光学系统组合在一起。如 751、753、79、80 型等。以光栅分光、数 字显字吸光度(A)、透光度(T)并可转换成浓度(C)。有的还可附设打印系统。 ⑤半自动、全自动生化分析仪:从进样检测到发报告以及清洗均为微机控制程序。 ⑥原子吸收分光光度计:在燃气或高温条件下,样品原子化。其吸收特定波长的谱线后, 原子跃迁到激发态。(激发态原子返迁回基态时,又放出电磁波。)吸收光量的多少与原子化 的程度或样品的浓度有关。原子吸收分光光度计较普通分光光度计灵敏,主要用于检测微量 元素。 2.发射光谱分析 主要有火焰激发光谱分析和荧光光谱分析。 ⑴火焰激发光谱分析 原理:火焰使雾化样本产生原子化,外层电子跃迁到较高能级。此为激发态原子,极不 稳定,返迁回基态后,发射出特定的谱线,其强弱与样本中该元素的浓度相关。火焰光度法 主要用于人体常量元素,如 K +、Na+、Ca2+的检测。 仪器:火焰光度计 ⑵荧光不度分析法 原理:荧光物质在紫光到紫外光谱激发下发出波长较长的谱线(多为红色)发生荧光其强 弱与样本中荧光物质的浓度成正比。 仪器:荧光光度计、荧光分光光度计。最近国外研制出时间分辨免疫荧光光度技术和相 应的设备,把荧光检测技术推上一新的高度。 ⑶化学发光法采用化学发光仪检测化学反应中发出的光信号。 3.散射、透射光谱分析 原理:光线通过悬浊的介质溶液时,同时会发生反射、散射及透射现象,散射光强度与 溶液中混悬颗粒的量成正比,测量散射光强度用以分析样本中的待测成分,称散射光谱分析。 使用仪器为浊度计。如激光浊度计

测量透射光的强度,用以分析样品悬浊程度,为透射分析法。使用仪器为光电比色计和分光光度计。为了提高检测灵敏度,必须清除反射光的影响。故要求待测样品的颗粒直径小于入射波长,小于1/2者更佳。4.结果计算上述任一种分析法,测得结果仅表示相对的光谱学测定值(透光度、吸光度、发射光强度等)要计算成样品中成份的含量。(1)参比法:采用标准品与样品同时检测,计算结果。①单一标准法:采用单一浓度的标准品。原理:根据Beer定律推导出未知样品浓度的计算公式Au/As=Cu/CsCu=Au. Cs/As注:Au、As分别为未知样品和标准品的吸光度:Cu、Cs分别为未知样品和标准品的浓度。上述结果再乘以样品稀释倍数,即可得样品中该成份的实际含量。可写成:Cu=(Au/As).Cs. (V/v)v为样品的实际检测量容积V为所求测的样品的量或容积。②系列标准法实际工作中,由于多种因素(如反应物或试剂的浓度、溶解度及仪器的线性范围等限制),吸光度A与反应物浓度C不完全成正比例。此时,需用系列梯度浓度的标准液、绘制成标准曲线,以确定不同A值范围时的样品含量。制得的标准曲线,若高值范围曲线趋向低平,不宜采用,此高值样品需稀释后重测,否则误差较大。(2)吸光率法①单一呈成分据Lambert--Beer氏定律A=KCL,当L不变时,A与C成正比。此处K值即为该呈色物质的吸光率。运用已知K值(以摩尔吸光率ε),可根据A值计算浓度C。② C=A / 8摩尔吸光率的定义:1摩尔浓度的呈色物质,在一定温度和光径1cm时的吸光度值。在实际工作中,有些实验嫌摩尔吸光率过大,可采用毫摩尔和微摩尔吸光率。其函义类推。例举氰化高铁血红蛋白(HiCN)测定:a.测定注HiCN浓度(mo1/L)=A540/(44X1.0)b.样本HiCN浓度(mo1/L)=A540X251/(44×1.0)注:A540HiCN测定注540nm处吸光度值251样本稀释倍数44HiCN毫摩尔吸光率1.0比色杯光径64458Hb分子量1000毫克转化成克②多种呈色成分共存时的检测及计算设a、b两成分在波长入境1擦时,摩尔吸光分别为εal及8bl:在波长入2时,摩尔吸光值分别是εa2及bl;a和b混合液在入1的吸光度为Al,在入2时的吸光度为A2。那么a、b二成分的各自浓度Ca和Cb。③非呈色成分测定4
4 测量透射光的强度,用以分析样品悬浊程度,为透射分析法。使用仪器为光电比色计和 分光光度计。 为了提高检测灵敏度,必须清除反射光的影响。故要求待测样品的颗粒直径小于入射波 长,小于 1/2 者更佳。 4.结果计算 上述任一种分析法,测得结果仅表示相对的光谱学测定值•(透光度、吸光度、发射光强 度等)要计算成样品中成份的含量。 ⑴参比法:采用标准品与样品同时检测,计算结果。 ①单一标准法:采用单一浓度的标准品。 原理:根据 Beer 定律推导出未知样品浓度的计算公式: Au/As=Cu/Cs Cu=Au.Cs/As 注:Au、As 分别为未知样品和标准品的吸光度; Cu、Cs 分别为未知样品和标准品的浓度。 上述结果再乘以样品稀释倍数,即可得样品中该成份的实际含量。可写成: Cu=(Au/As).Cs.(V/v) v 为样品的实际检测量容积 V 为所求测的样品的量或容积。 ②系列标准法 实际工作中,由于多种因素•(如反应物或试剂的浓度、溶解度及仪器的 线性范围等限制)•,吸光度 A 与反应物浓度 C 不完全成正比例。此时,需用系列梯度浓度的 标准液、绘制成标准曲线,以确定不同 A 值范围时的样品含量。制得的标准曲线,若高值范 围曲线趋向低平,不宜采用,此高值样品需稀释后重测,否则误差较大。 ⑵吸光率法 ① 单一呈成分据 Lambert-Beer 氏定律 A=KCL, 当 L 不变时,•A 与 C 成正比。••此 处 K 值即为该呈色物质的吸光率。运用已知 K 值(以摩尔吸光率ε)•,可根据 A 值计 算浓度 C。 ② C=A /ε 摩尔吸光率的定义:1 摩尔浓度的呈色物质,在一定温度和光径 1cm 时的吸光度值。 在实际工作中,有些实验嫌摩尔吸光率过大,可采用毫摩尔和微摩尔吸光率。其函义类 推。例举氰化高铁血红蛋白(HiCN)测定: a.测定注 HiCN 浓度(mol/L)=A540/(44 × 1.0) b.样本 HiCN 浓度(mol/L)=A540×251/(44 × 1.0) 注:A540 HiCN 测定注 540nm 处吸光度值 251 样本稀释倍数 44 HiCN 毫摩尔吸光率 1.0 比色杯光径 64458Hb 分子量 1000 毫克转化成克 ②多种呈色成分共存时的检测及计算 设 a、b 两成分在波长λ攬 1 攭时,摩尔吸光分别为εa1 及εb1;在波长λ2 时,摩尔 吸光值分别是εa2 及εb1;a 和 b 混合液在λ1 的吸光度为 A1,在λ2 时的吸光度为 A2。那 么 a、b 二成分的各自浓度 Ca 和 Cb。 ③非呈色成分测定

某些非呈色成分,当其具有特定的吸收波长时亦可采用吸光率法测定。如蛋白质(因含酪氨酸、色氨酸和苯丙酸的芳香族结构)和核酸(由嘌呤环和嘧啶环的共轭双键特性而决定)都具有对紫外光的吸收性质。前者吸收峰值为280mm。下列任一经验公式,都可用来计算蛋白质浓度。a.Lowry-Kalchar公式蛋白质(mg/ml)=1.45XA280-0.74XA260b.Warburg-Christian公式蛋白质(mg/ml)=1.55×A280-0.76XA260同样,可根据260mm吸光度值,计算核酸溶液的浓度。含蛋白微量时,不致影响;若含蛋白较多时,影响较大。通常规定:在260mm波长下,每毫升含1微克DNA溶液的吸光度值为0.020:而每毫升含1微克RNA溶液的吸光度值为0.022。由于不同蛋白质的酪氨酸和色氨酸含量差异较大,故不能准确定量,有主张选择200~225mm波段,因为以波段的光吸收主要与肽键有关。其经验公式是:蛋白质(g/L)=144×(A215-A225)此公式适用条件是样品经154mmo1/LNaC1作较高倍数的稀释。(二)层析分析层析(Chromatography),也称色谱。源于本世纪初。将多种植物色素注入吸附柱,经流动洗脱后,呈彩色的谱带排列而称之。然而,无色物质也同样可以在术上分离,故亦称为层析。1.层析原理层析不进利用不同物质的理化性质的差异进行物质分离的技术。层折系统由两个相组成:一是固定相,为固体物质或固定于固体物质上的成分。另一是流动相,为可以流动的物质,当待分离混合物随流动相通过固定相区域时,各级分的理化性质存在差异,与两相相互作用的能力(如吸附、溶解、结合等)不同,在两相中的分配比例不相同,随动相移动时受到阻滞作用不相同,导致前移速度存在有差异,分部收集流出液,即可得到混合样品中的各单一组分。2.层析分类(1)按流动相性状:液相层析和气相层析。(2)按操作方式:柱层析、纸层析和薄层层析。(3)按分离原理:吸附层析、分配层析、离子交换层析、亲和层析和凝胶层析。3.(1)分配层析分配层析是利用混合物在两种或两种以上的溶剂中分配系数不同而使物质分离的方法。相当于一种连续性的溶剂抽提法。例如纸层析,滤纸是载体,水是液相固定相:有机溶剂则为液相流动相。被分离成分在水与有机溶剂间的分配系数不同而移动速度有差别,得以分离。移动速度可用比移值(RF)表示。色斑中心至原点中心距离RF=溶剂前沿至原点中心距离纸层析有垂直和水平二型。垂直型是将滤纸悬起,使流动相向上或向下扩散:水平型是流动相向四周扩散。垂直型较为常用。单向层析:在垂直型层析中,流动相只向一个方向层析。双向层析:分析系数相近的物质,单向层析不易分离。此时,将滤纸快速吹干,转90°方向作第二次层析。双向层析可提高层析分离的效果。5
5 某些非呈色成分, 当其具有特定的吸收波长时亦可采用吸光率法测定。 如蛋白质(因含 酪氨酸、色氨酸和苯丙酸的芳香族结构)•和核酸(由嘌呤环和嘧啶环的共轭双键特性而决定) 都具有对紫外光的吸收性质。前者吸收峰值为 280mm。下列任一经验公式,都可用来计算蛋 白质浓度。 a.Lowry-Kalchar 公式 蛋白质(mg/ml)=1.45×A280-0.74×A260 b.Warburg-Christian 公式 蛋白质(mg/ml)=1.55×A280-0.76×A260 同样, 可根据 260mm 吸光度值,计算核酸溶液的浓度。含蛋白微量时,不致影响;若含 蛋白较多时, 影响较大。通常规定:在 260mm 波长下,每毫升含 1 微克 DNA 溶液的吸光度值 为 0.020;而每毫升含 1 微克 RNA 溶液的吸光度值为 0.022。 由于不同蛋白质的酪氨酸和色氨酸含量差异较大,故不能准确定量,有主张选择 200~ 225mm 波段,因为以波段的光吸收主要与肽键有关。其经验公式是: 蛋白质(g/L)=144×(A215-A225) 此公式适用条件是样品经 154mmol/LNaCl 作较高倍数的稀释。 (二)层析分析 层析(Chromatography),也称色谱。源于本世纪初。将多种植物色素注入吸附柱,经流 动洗脱后,呈彩色的谱带排列而称之。然而,无色物质也同样可以在术上分离,故亦称为层 析。 1.层析原理 层析不进利用不同物质的理化性质的差异进行物质分离的技术。层折系统由两个相组成: 一是固定相,为固体物质或固定于固体物质上的成分。另一是流动相,为可以流动的物质, 当待分离混合物随流动相通过固定相区域时,各级分的理化性质存在差异,与两相相互作用 的能力(如吸附、溶解、结合等)不同,在两相中的分配比例不相同,随动相移动时受到阻滞 作用不相同,导致前移速度存在有差异,分部收集流出液,即可得到混合样品中的各单一组 分。 2.层析分类 (1)按流动相性状:液相层析和气相层析。 (2)按操作方式:柱层析、纸层析和薄层层析。 (3)按分离原理:吸附层析、分配层析、离子交换层析、亲和层析和凝胶层析。 3. (1)分配层析 分配层析是利用混合物在两种或两种以上的溶剂中分配系数不同而使物质分离的方法。 相当于一种连续性的溶剂抽提法。例如纸层析,滤纸是载体,水是液相固定相:有机溶剂则 为液相流动相。被分离成分在水与有机溶剂间的分配系数不同而移动速度有差别,得以分离。 移动速度可用比移值(RF)表示。 色斑中心至原点中心距离 RF= ──────────── 溶剂前沿至原点中心距离 纸层析有垂直和水平二型。垂直型是将滤纸悬起,使流动相向上或向下扩散;水平型是 流动相向四周扩散。垂直型较为常用。 单向层析:在垂直型层析中,流动相只向一个方向层析。 双向层析:分析系数相近的物质,单向层析不易分离。此时,将滤纸快速吹干,转 90° 方向作第二次层析。双向层析可提高层析分离的效果