
8.4紫外光谱(UV) 1.紫外光谱的基本原理 1)紫外光谱的产生(电子跃迁) hc △E=hy △E= 分子吸收紫外光区的电磁辐射,引起电子能级的跃迁即成 键电子或非键电子由基态跃迁到激发态。 <200nm远紫外区;200~400nm近紫外区 2)电子跃迁的类型 有机分子最常见的电子跃迁:6→o元→元n→on→元 跃迁所需能量大小顺序:o→o>n→o>元>π>n→元
8.4 紫外光谱(UV) 1. 紫外光谱的基本原理 1) 紫外光谱的产生(电子跃迁) < 200nm 远紫外区 ; 200 ~ 400nm 近紫外区 分子吸收紫外光区的电磁辐射,引起电子能级的跃迁即成 键电子或非键电子由基态跃迁到激发态。 2) 电子跃迁的类型 有机分子最常见的电子跃迁:→* →* n→* n→* 跃迁所需能量大小顺序: →* > n→* > →* > n→* E=hv E= hc

0¥ 元 E n→元 n π→元 元 0→o oσ和n-→σ跃迁,吸收波长:<200nm(远紫外区): π→π和n-→x跃迁,吸收波长:200400m(近紫外区): ·V检测:共轭烯烃、共轭羰基化合物及芳香化合物
E →* →* n→* n→* * * n →* 和 n→* 跃迁,吸收波长:< 200nm (远紫外区); →* 和 n→* 跃迁,吸收波长: 200~400nm (近紫外区); • UV检测:共轭烯烃、共轭羰基化合物及芳香化合物
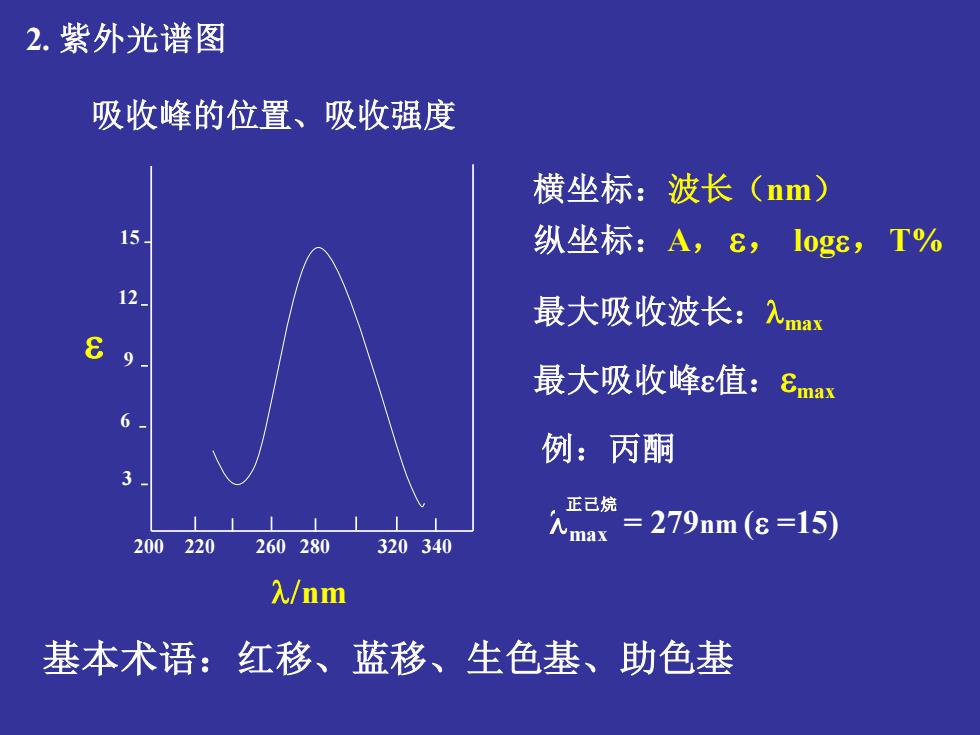
2.紫外光谱图 吸收峰的位置、吸收强度 横坐标:波长(nm) 15 纵坐标:A,£,l0g8,T% 12 最大吸收波长:入ma 最大吸收峰ε值:Smax 6 例:丙酮 正己烷 =279nm(8=15) 200220260280 320340 人max 入/nm 基本术语:红移、蓝移、生色基、助色基
2. 紫外光谱图 吸收峰的位置、吸收强度 3 6 9 12 15 200 220 260 280 320 340 nm 横坐标:波长(nm) 纵坐标:A,, log,T% 最大吸收波长:max 最大吸收峰值:max 例:丙酮 max = 279nm ( =15) 正己烷 基本术语:红移、蓝移、生色基、助色基

红移(向红移动):最大吸收峰波长移向长波。 蓝移(向蓝移动):最大吸收峰波长移向短波。 生色基:产生紫外(或可见)吸收的不饱和基团,如: C=C、C=0、NO2等。 助色基:其本身在紫外或可见光区不显吸收,但当其与 生色基相连时,能使后者吸收峰移向长波或吸收强度增加 (或同时两者兼有),如:-OH、-NH2、C等。 3.各类有机化合物的电子跃迁 1)饱和有机化合物 ① 6-→o跃迁 吸收波长<150nm在远紫外区。 例:CH4入ma=125nm CH3CH3入max=135nm
红移(向红移动):最大吸收峰波长移向长波。 蓝移(向蓝移动):最大吸收峰波长移向短波。 生色基:产生紫外(或可见)吸收的不饱和基团,如: C=C、 C=O、NO2等。 助色基:其本身在紫外或可见光区不显吸收,但当其与 生色基相连时,能使后者吸收峰移向长波或吸收强度增加 (或同时两者兼有),如:-OH、-NH2、Cl等。 3. 各类有机化合物的电子跃迁 1)饱和有机化合物 ① →* 跃迁 吸收波长 < 150nm 在远紫外区。 例:CH4 max= 125nm CH3CH3 max= 135nm

②.n→σ*跃迁 分子中含有杂原子S、N、O、X等饱和化合物。吸 收波长:≤200nm(在远紫外区) 例:CH3OH入ma=183nm(150) CH3CH2OCH2CH3 Amax=188nm 某些含孤对电子的饱和化合物,如:硫醚、二硫化合物、硫 醇、胺、溴化物、碘化物在近繁外区有弱吸收。 例:CH3NH2入max=213nm(600) CH3Br Amax=204nm (200) CH3I入max=258nm(365)
②. n→* 跃迁 分子中含有杂原子 S、N、O、X 等饱和化合物。吸 收波长:< 200nm(在远紫外区) 例:CH3OH max= 183nm(150) CH3CH2OCH2CH3 max= 188nm 某些含孤对电子的饱和化合物,如:硫醚、二硫化合物、硫 醇、胺、溴化物、碘化物在近紫外区有弱吸收。 例:CH3NH2 max= 213nm(600) CH3Br max= 204nm(200) CH3 I max= 258nm(365)