
一、轨道杂化理论的基本要点 同一原子中能量相近的不同类型的原子轨道重 新组合成新的原子轨道,称为原子轨道的杂化,得 到的原子轨道称为杂化轨道。 轨道杂化理论的基本要点是: (1)只有在形成分子的过程中,能量相近的原子 轨道才能进行杂化。 (2)杂化轨道的成键能力比未杂化的原子轨道的 成键能力强。 (3)原子轨道杂化时,轨道的数目不变,但轨道 在空间的伸展方向发生变化。 (4)组合得到的杂化轨道与其他原子形成σ键或 排布孤对电子,而不会以空轨道的形式存在。 (5)中心原子采取的杂化类型决定了杂化轨道分 布形状及所形成的分子的几何构型。 供药学类及医学检验专业用
一、轨道杂化理论的基本要点 同一原子中能量相近的不同类型的原子轨道重 新组合成新的原子轨道,称为原子轨道的杂化,得 到的原子轨道称为杂化轨道。 轨道杂化理论的基本要点是: (1)只有在形成分子的过程中,能量相近的原子 轨道才能进行杂化。 (2)杂化轨道的成键能力比未杂化的原子轨道的 成键能力强。 (3)原子轨道杂化时,轨道的数目不变,但轨道 在空间的伸展方向发生变化。 (4)组合得到的杂化轨道与其他原子形成 σ键或 排布孤对电子,而不会以空轨道的形式存在。 (5)中心原子采取的杂化类型决定了杂化轨道分 布形状及所形成的分子的几何构型
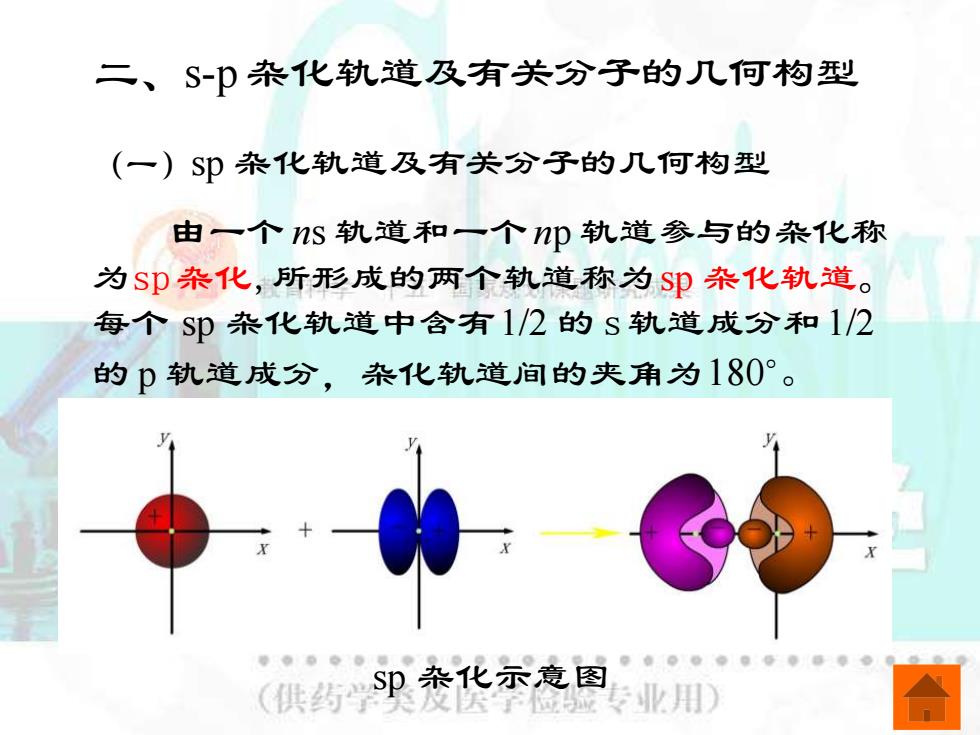
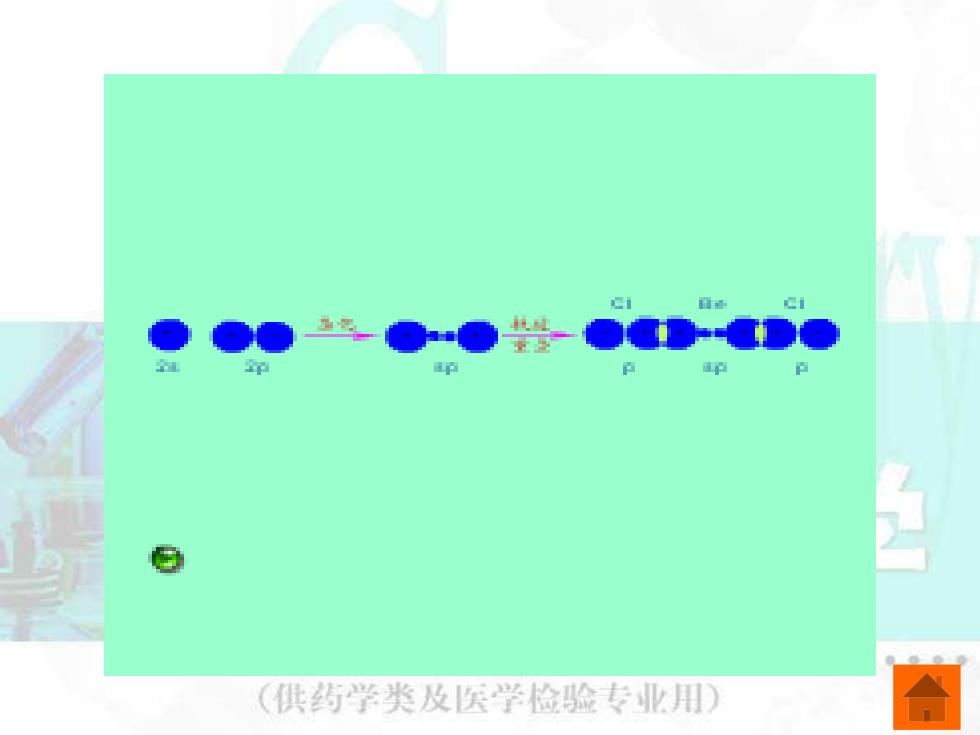
二、 S-p杂化轨道及有关分子的几何构型 (一)Sp杂化轨道及有关分子的几何构型 由一个nS轨道和一个p轨道参与的杂化称 为Sp杂化,所形成的两个轨道称为Sp杂化轨道。 每个Sp杂化轨道中含有1/2的S轨道成分和1/2 的p轨道成分,杂化轨道间的夹角为180°。 (供药Sp杂化示意图 业用
二、s-p 杂化轨道及有关分子的几何构型 (一)sp 杂化轨道及有关分子的几何构型 由一个 ns 轨道和一个np 轨道参与的杂化称 为sp杂化,所形成的两个轨道称为sp 杂化轨道。 每个 sp 杂化轨道中含有1/2 的 s 轨道成分和1/2 的 p 轨道成分,杂化轨道间的夹角为 180。 。 sp 杂化示意图
供药学类及医学俭验专业用

(二)S即杂化轨道及有关分子的几何构型 由一个nS轨道和两个np轨道参与的杂化称为 Sp杂化,所形成的三个杂化轨道称为Sp杂化轨 道。每个SD2杂化轨道中含有1/3的S轨道成分和 2/3的p轨道成分,杂化轨道间的夹角为120°,呈 平面正三角形。学十五国家规划课哪研院成架 (供药sp杂化轨道示意图业用)
(二)sp2 杂化轨道及有关分子的几何构型 由一个ns 轨道和两个np 轨道参与的杂化称为 sp2 杂化,所形成的三个杂化轨道称为 sp2 杂化轨 道。每个sp2 杂化轨道中含有1/3 的 s 轨道成分和 2/3 的 p 轨道成分,杂化轨道间的夹角为120° ,呈 平面正三角形。 sp2 杂化轨道示意图
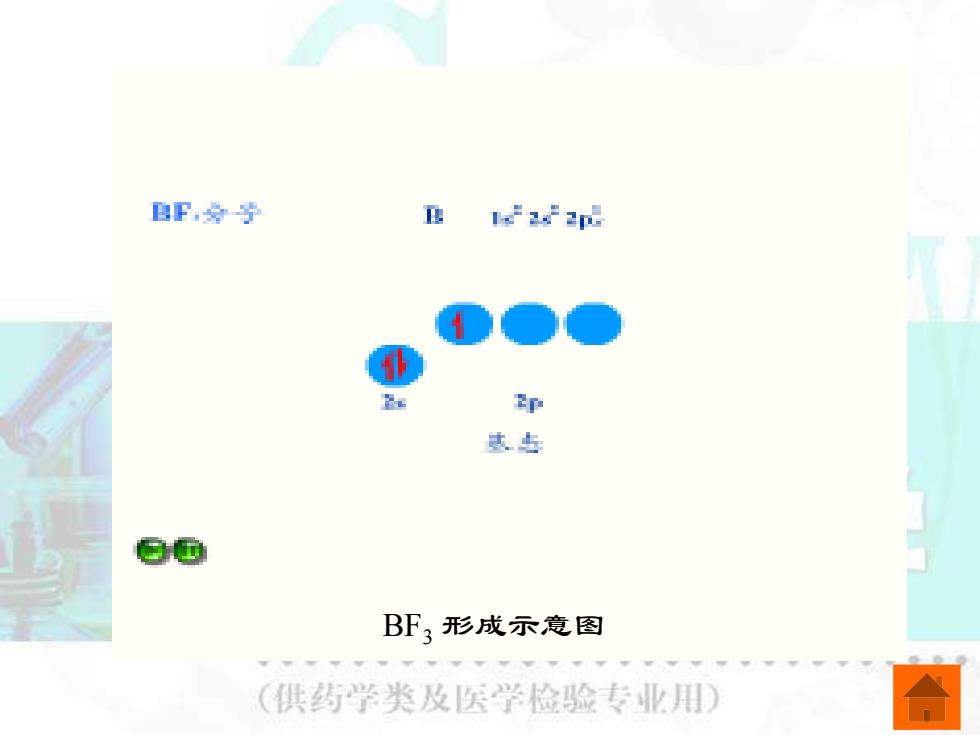
BF经学 B 22 p 味 @面 BF3形成示意图 (供药学类及医学检验专业用
BF3 形成示意图