育科学 国 研究成果 1200 B BF,的几何构型 ● (供药学类及医学检验专业用)
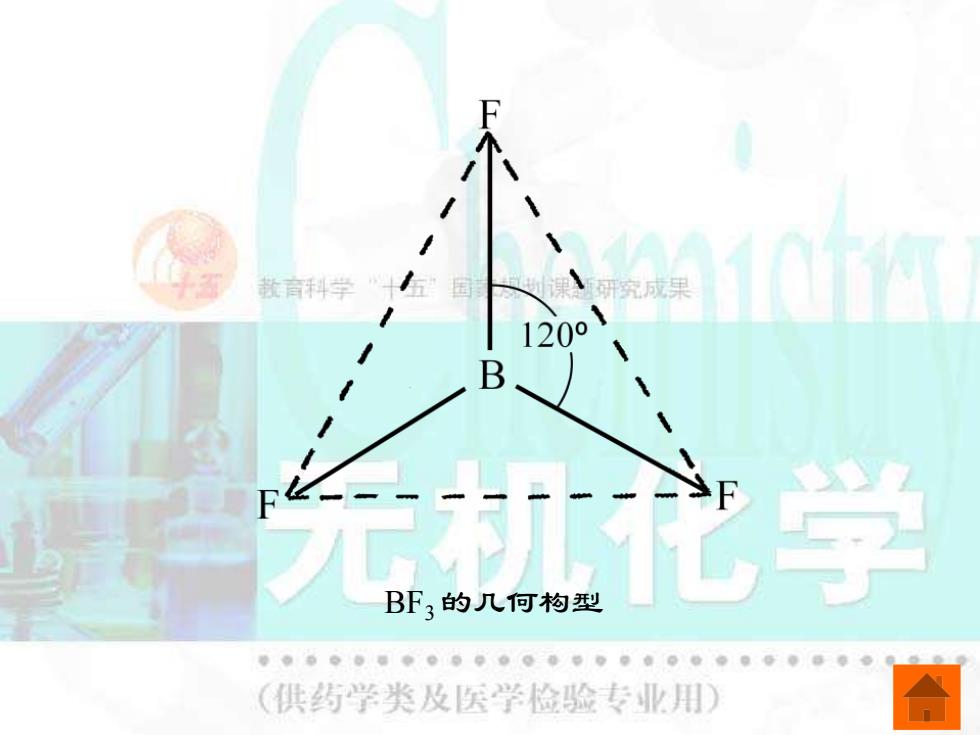
BF3 的几何构型

(三)S即3等性杂化轨道及有关分子的几何构型 由一个nS轨道和三个np轨道参与的杂化称为 Sp3杂化,形成的四个杂化轨道称为Sp3杂化轨道。 每个SD3杂化轨道中含有1/4的S轨道成分和3/4的 p轨道成分,杂化轨道间的夹角为109°28'。 (供约子SD3等性杂化轨道用)
(三)sp3 等性杂化轨道及有关分子的几何构型 由一个ns 轨道和三个 np 轨道参与的杂化称为 sp3 杂化,形成的四个杂化轨道称为 sp3 杂化轨道。 每个 sp3 杂化轨道中含有1/4 的s 轨道成分和 3/4 的 p 轨道成分,杂化轨道间的夹角为 109 28' 。 sp3 等性杂化轨道

Ⅲ经子到成的过量: 是 底岛 (供药学C形成示意国专业用)
CH4 形成示意图

(四)S即3不等性杂化轨道及有关分子的几何构型 对于含孤对电子的中心原子,由于孤对电子要 占据杂化轨道,不参与成键,将使形成的分子的能 量升高。若采用$即等性杂化,则由于孤对电子占 据的S杂化轨道中S成分较少,因此能量较高, 分子的稳定性较低。为了使分子的能量尽可能低, 含孤对电子的中心原子最好采用$即3不等性杂化, 在满足成键杂化轨道有尽可能大的成键能力的前提 下,尽可能增加非键杂化轨道中的S轨道成分和减 小卩轨道成分,并相应减少成键杂化轨道中的S轨 道成分和增大卩轨道成分,使形成的分子的能量比 等性杂化时有所降低。 (供药学类及医学检验专业用
(四)sp3 不等性杂化轨道及有关分子的几何构型 对于含孤对电子的中心原子,由于孤对电子要 占据杂化轨道,不参与成键,将使形成的分子的能 量升高。若采用 sp3 等性杂化,则由于孤对电子占 据的 sp3 杂化轨道中 s 成分较少,因此能量较高, 分子的稳定性较低。为了使分子的能量尽可能低, 含孤对电子的中心原子最好采用 sp3 不等性杂化, 在满足成键杂化轨道有尽可能大的成键能力的前提 下,尽可能增加非键杂化轨道中的 s 轨道成分和减 小 p 轨道成分,并相应减少成键杂化轨道中的 s 轨 道成分和增大p 轨道成分,使形成的分子的能量比 等性杂化时有所降低

基态N的外层电子组态为2s2p3,在H影响 下,N的一个2s轨道和三个2p轨道进行Sp3不等 性杂化,形成四个不等同的S即3杂化轨道。其中三 个S即3成键杂化轨道的能量相等,每个杂化轨道含 0.226S轨道成分和0.774p轨道成分;Sp3非键 杂化中含0.322S轨道成分和0.678p轨道成分。 N用三个各含一个未成对电子的Sp成键杂化轨道 分别与三个H的1S轨道重叠,形成三个N一H键, 孤对电子则占据S成分较高的Sp3非键杂化轨道。 因此NH3的几何构型为三角锥形。 (供药学类及医学检验专业用)
基态 N 的外层电子组态为 2s 22p 3 ,在 H 影响 下,N 的一个 2s 轨道和三个 2p轨道进行 sp3不等 性杂化,形成四个不等同的 sp3 杂化轨道。其中三 个 sp3 成键杂化轨道的能量相等,每个杂化轨道含 0.226 s 轨道成分和 0.774 p 轨道成分;sp3 非键 杂化中含 0.322 s轨道成分和 0.678 p轨道成分。 N 用三个各含一个未成对电子的 sp3成键杂化轨道 分别与三个 H 的 1s 轨道重叠,形成三个 键, 孤对电子则占据 s 成分较高的 sp3 非键杂化轨道。 因此 NH3 的几何构型为三角锥形。 N H−