
四、配位共价键 按共用电子对提供的方式不同,共价键又 可分为正常共价键和配位共价键。 由一个原子单独提供共用电子对而形成的 共价键称为配位共价键。配位键用箭号“>” 表示,箭头方向由提供电子对的原子指向接受 电子对的原子。 形成配位键的条件是: (1)电子对给予体的最外层有孤对电子; (2)电子对接受体的最外层有可接受孤对电 子的空轨道。 (供药学类及医学检验专业用)
四、配位共价键 按共用电子对提供的方式不同,共价键又 可分为正常共价键和配位共价键。 由一个原子单独提供共用电子对而形成的 共价键称为配位共价键。配位键用箭号“→” 表示,箭头方向由提供电子对的原子指向接受 电子对的原子。 形成配位键的条件是: (1)电子对给予体的最外层有孤对电子; (2)电子对接受体的最外层有可接受孤对电 子的空轨道

五、共价键参数 (一)键能 在标准状态下,使单位物质的量的气态分子A-B 解离成气态原子A和原子B所需要的能量称为键解离 能。 款育科学“十五”国家规课题研究成果 对双原子分子,键能等于键解离能。对多原子分 子,键能等于键解离能的平均值。 (二)键长 分子中两个成键原子核间的平距离称为键长。 (供药学类及医学检验专业用
五、共价键参数 (一)键能 在标准状态下,使单位物质的量的气态分子A–B 解离成气态原子 A 和原子 B 所需要的能量称为键解离 能。 对双原子分子,键能等于键解离能。对多原子分 子,键能等于键解离能的平均值。 (二)键长 分子中两个成键原子核间的平衡距离称为键长
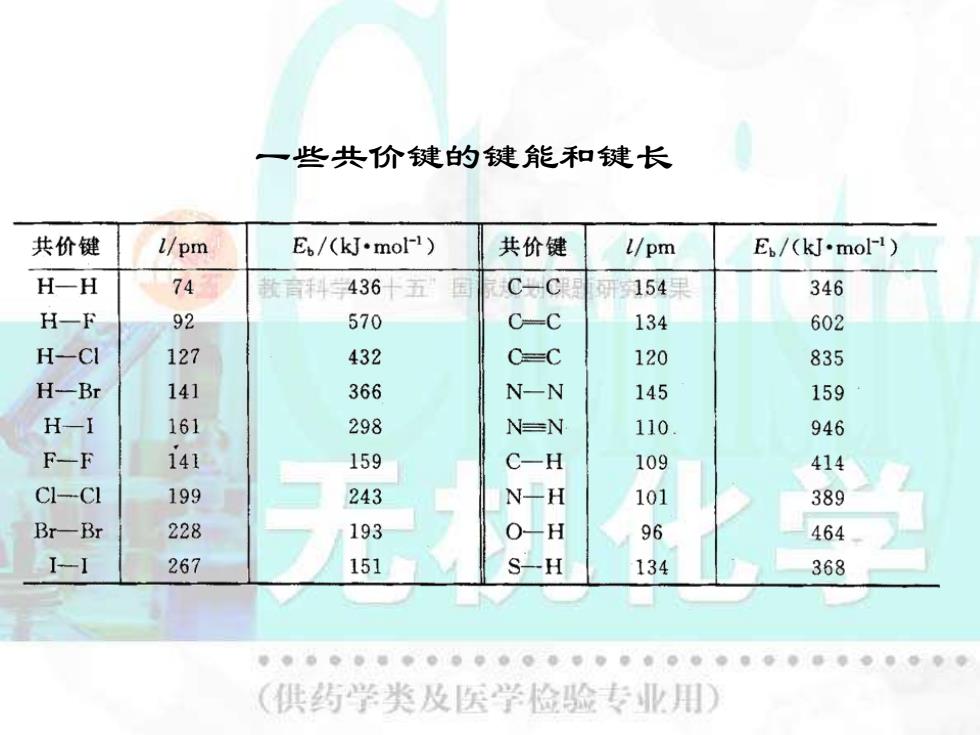
一些共价键的键能和键长 共价键 1/pm Eb/(kJ·mol-1) 共价健 l/pm E/(kJ.mol-1) H-H 74 款言斗436十五 国 C-C 研154果 346 H-F 92 570 C-C 134 602 H-CI 127 432 C=C 120 835 H-Br 141 366 N-N 145 159 H-I 161 298 N=N 110 946 F-F 141 159 C-H 109 414 CI-CI 199 243 N-H 101 389 Br-Br 228 193 O-H 96 464 1-1 267 151 S-H 134 368 ● (供药学类及医学检验专业用)
一些共价键的键能和键长

(三)键角 在多原子分子中,键与键之间的夹角称为键角。 (四)键的极性 按共用电子对是否发生偏移,共价键可分为非极 性共价键和极性共价键。 当两个相同原子以共价键结合时,两个原子对共 用电子对的吸引能力相同,共用电子对不偏向于任何 一个原子。这种共价键称为非极性共价键。 当两个不同元素的原子以共价键结合时,共用电 子对偏向于电负性较大的原子。电负性较大的原子带 部分负电荷,而电负性较小的原子带部分正电荷,正、 负电荷中心不重合。这种共价键称为极性共价键。 共价键的极性与成键两原子的电负性差有关,电 负性差越大,共价馋的根性就想大。业
(三)键角 在多原子分子中,键与键之间的夹角称为键角。 (四)键的极性 按共用电子对是否发生偏移,共价键可分为非极 性共价键和极性共价键。 当两个相同原子以共价键结合时,两个原子对共 用电子对的吸引能力相同,共用电子对不偏向于任何 一个原子。这种共价键称为非极性共价键。 当两个不同元素的原子以共价键结合时,共用电 子对偏向于电负性较大的原子。电负性较大的原子带 部分负电荷,而电负性较小的原子带部分正电荷,正、 负电荷中心不重合。这种共价键称为极性共价键。 共价键的极性与成键两原子的电负性差有关,电 负性差越大,共价键的极性就越大

第二节轨道杂化理论 一、轨道杂化理论的基本要点 二、$-p杂化轨道及有关分子的几何构型 三、d-$p杂化轨道及有关分子的几何构型
第二节 轨道杂化理论 一、轨道杂化理论的基本要点 二、s-p 杂化轨道及有关分子的几何构型 三、d-s-p 杂化轨道及有关分子的几何构型