
第二类导体又称离子导体,如电解质溶液、熔融电解质等第二类导体的特点是:A. 正、负离子作反向移动而导电,导电总量分别由正、负离子分担B.电解质溶液的连续导电过程必须在电化学装置中实现而且总是伴随有电化学反应和化学能与电能相互转换发生。C.温度升高,电阻下降6
6 第二类导体又称离子导体,如电解质溶液、熔融电解质等 第二类导体的特点是: A. 正、负离子作反向移动而导电,导电总量分别 由正、负离子分担 B. 电解质溶液的连续导电过程必须在电化学装置中实现, 而且总是伴随有电化学反应和化学能与电能相互转换发 生。 C. 温度升高,电阻下降

1.1基本概念(2)电极正极、负极电势高的极称为正极,电流从正极正极:流向负极。电势低的极称为负极,电子从负极负极:流向正极。7
7 正极、负极 电势低的极称为负极,电子从负极 流向正极。 负极: 电势高的极称为正极,电流从正极 流向负极。 正极: 1.1 基本概念 (2)电极
1.1基本概念(2)电极阴极、阳极阴极:发生还原作用的极称为阴极。(Cathode)阳极:发生氧化作用的极称为阳极。(Anode)8
8 阴极、阳极 阴极: 发生还原作用的极称为阴极。 (Cathode) 发生氧化作用的极称为阳极。 阳极: (Anode) 1.1 基本概念 (2)电极

1.1基本概念(2)电极电极反应:电极上进行的有电子得失的化学反应阳极: H2 (g)→>2H+(m)+ 2e阴极: Clz (g)+2e →>2CI(m)电池反应:两个电极反应的总结果表示电池反应以上电极反应的总反应为:H2(g)+Cl2(g)-→2HCI(m)9
9 1.1 基本概念 (2)电极 电极反应:电极上进行的有电子得失的化学反应 电池反应:两个电极反应的总结果表示电池反应 阳极: H2 (g)→2H+ (m)+ 2e- 阴极: Cl2 (g)+2e - →2Cl- (m) 以上电极反应的总反应为: H2 (g)+Cl2 (g)→2HCl(m)
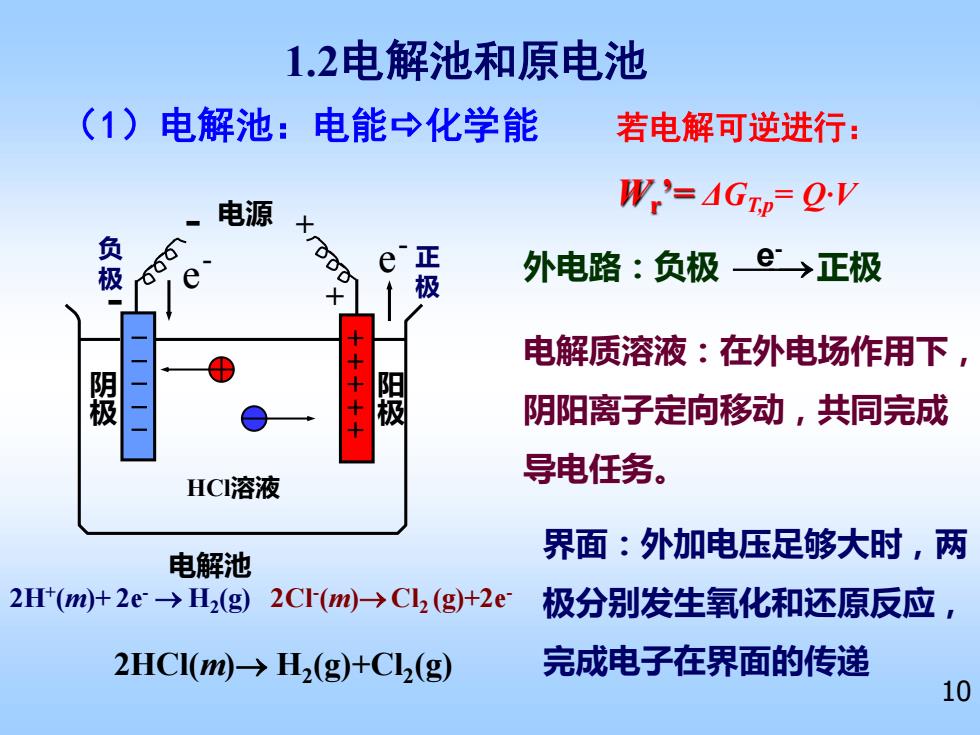
1.2电解池和原电池(1)电解池:电能化学能若电解可逆进行W,= 4GTp= Q-V电源Xg负极000正e外电路:负极e>正极e极++++++电解质溶液:在外电场作用下,阳极阴极阴阳离子定向移动,共同完成导电任务。HCI溶液界面:外加电压足够大时,两电解池2H+(m)+ 2e→H2(g)2CI(m)→Cl (g)+2e极分别发生氧化和还原反应,完成电子在界面的传递2HCl(m)→H2(g)+Cl(g)10
10 HCl溶液 - 电源 + 电解池 + - e - e - 电解质溶液:在外电场作用下, 阴阳离子定向移动,共同完成 导电任务。 (1)电解池:电能化学能 1.2电解池和原电池 负 极 正 极 2HCl(m)→ H2 (g)+Cl2 (g) 2Cl- (m)→Cl2 (g)+2e- 2H+ (m)+ 2e- → H2 (g) 阴 极 阳 极 外电路:负极 ⎯⎯→ e 正极 - 界面:外加电压足够大时,两 极分别发生氧化和还原反应, 完成电子在界面的传递 若电解可逆进行: Wr ’= ΔGT,p= Q·V - - - - - + + + + +