
第四节 沉淀溶解平衡 第1课时 沉淀溶解平衡 课后·训练提升 基础巩固 1.下列说法正确的是()。 A.其他条件不变,离子浓度改变时,Ks即也发生改变 B.溶度积常数是不受任何条件影响的常数,简称溶度积 C.可用离子积Q判断沉淀溶解平衡进行的方向 D.所有物质的溶度积都是随温度的升高而增大的 答案:C 解析:Ks即与温度有关,有的难溶电解质的Ks即随温度升高而增大,也有的难溶电解 质的Ks即随温度升高而减小。 2.己知25℃时Ksp(AgCI=1.8×10-10,Kp(Ag)=8.5×10-17,Ksp(Ag2Cr04=2.0×10-12,则 下列难溶电解质的饱和溶液中,Ag浓度大小顺序正确的是()。 A.AgCL>AgI>Ag2CrO4 B.AgCL>Ag2CrO4>AgI C.Ag2CrO4>AgCDAgI D.Ag2CrO4>AgI>AgCl 答案:C 解析:由Ksp(AgCI)=1.8×10-10可求出c(AgF1.34×105 mol L-;由Ksp(Ag)=8.5×10 17可求出c(Ag9.2×10-9 mol-L-1;由Kp(Ag2Cr042.0×10-2可求出 c(Ag户1.59×104 mol L-,所以c(Ag)大小顺序为Ag2CrO4>AgC>Agl。 3.一定温度下,将足量的AgCI分别加入下列物质中,AgCI的溶解程度由大到小的 排列顺序是()。 ①20mL0.01 mol-L-1 KC1溶液 ②30mL0.02 mol-L-1 CaC2溶液 ③40mL0.03molL1HC1溶液 ④10mL蒸馏水 ⑤50mL0.05molL-1 AgNO3溶液 A.①>②>③>④>⑤ B.④>①>③>②>⑤ C.⑤>④>②>①>③ D.④>③>⑤>②>①
第四节 沉淀溶解平衡 第 1 课时 沉淀溶解平衡 课后· 基础巩固 1.下列说法正确的是( )。 A.其他条件不变,离子浓度改变时,Ksp 也发生改变 B.溶度积常数是不受任何条件影响的常数,简称溶度积 C.可用离子积 Q 判断沉淀溶解平衡进行的方向 D.所有物质的溶度积都是随温度的升高而增大的 答案:C 解析:Ksp 与温度有关,有的难溶电解质的 Ksp随温度升高而增大,也有的难溶电解 质的 Ksp 随温度升高而减小。 2.已知 25 ℃时 Ksp(AgCl)=1.8×10-10 ,Ksp(AgI)=8.5×10-17 ,Ksp(Ag2CrO4)=2.0×10-12 ,则 下列难溶电解质的饱和溶液中,Ag+浓度大小顺序正确的是( )。 A.AgCl>AgI>Ag2CrO4 B.AgCl>Ag2CrO4>AgI C.Ag2CrO4>AgCl>AgI D.Ag2CrO4>AgI>AgCl 答案:C 解析:由 Ksp(AgCl)=1.8×10-10 可求出 c(Ag+ )≈1.34×10-5 mol·L -1 ;由 Ksp(AgI)=8.5×10- 17 可求出 c(Ag+ )≈9.2×10-9 mol·L -1 ;由 Ksp(Ag2CrO4)=2.0×10-12可求出 c(Ag+ )≈1.59×10-4 mol·L -1 ,所以 c(Ag+ )大小顺序为 Ag2CrO4>AgCl>AgI。 3.一定温度下,将足量的 AgCl 分别加入下列物质中,AgCl 的溶解程度由大到小的 排列顺序是( )。 ①20 mL 0.01 mol·L -1 KCl 溶液 ②30 mL 0.02 mol·L -1 CaCl2 溶液 ③40 mL 0.03 mol·L -1 HCl 溶液 ④10 mL 蒸馏水 ⑤50 mL 0.05 mol·L -1 AgNO3 溶液 A.①>②>③>④>⑤ B.④>①>③>②>⑤ C.⑤>④>②>①>③ D.④>③>⑤>②>①

答案B 解析:AgCl(s)一Ag(aq+CIr(aq),由于c(Ag)c(Cr=Ksp,溶液中cCr)或c(Ag)越 大,越能抑制AgC1的溶解,AgCI的溶解程度就越小。AgCI的溶解程度大小只与 溶液中Ag*或C的浓度有关,而与溶液的体积无关。①c(C=0.01 mol-L-!:② c(C=0.04 mol L:③c(C=0.03 mol L-!;④c(C=0 mol L-!;⑤c(Ag=0.05molL 1。Ag或C浓度由小到大的排列顺序为④<①<③<②<⑤,故AgCI的溶解程度由 大到小的排列顺序为④>①>③>②>⑤。 4.下列说法中正确的是()。 A.在一定温度下的AgCI水溶液中,Ag和C浓度的乘积是一个常数 B.AgCI的Ksp=1.8×10-10,在任何含AgCI固体的溶液中,c(Ag尸c(C),且Ag*与CI 浓度的乘积均等于1.8×1010 C.温度一定时,当溶液中Ag*和C浓度的乘积等于Ksp的值时,此溶液为AgC1的 饱和溶液 D.一定温度下,向饱和AgCI水溶液中加入盐酸,Ksp变大 答案:C 解析:在AgCI的饱和溶液中,Ag和C浓度的乘积才是一个常数,A项错误;在含 有AgC1固体的溶液中c(Ag)c(C=1.8×1010,但c(Ag)不一定等于c(C),B项错 误;当O=Ksp时,溶液为饱和溶液,C项正确;一定温度下,向饱和AgCI溶液中加入 盐酸,不会影响Ksp,D项错误。 5.25℃时在含有浓度均为0.01olLl的C、Br、的溶液中,缓慢且少量地加 入AgNO3稀溶液,结合溶度积常数判断析出三种沉淀的先后顺序是()。 A.AgCl、AgBr、Agl B.Agl、AgBr、AgCI C.AgBr、AgCl、Agl D.三种沉淀同时析出 答案B 解析:Ag比AgBr、AgCI更难溶于水,故Ag不足时先生成Ag,析出沉淀的先后 顺序是Ag、AgBr、AgCl。 6.在有固态CaCO3存在的饱和溶液中,存在着如下平衡CaCO3(s,一 Ca+(aq+C0(aq),加入下列溶液能使CaCO3质量增大的是(). A.CaC2溶液 B.KNO3溶液 C.NH4CI溶液 D.NaCI溶液 答案:A
答案:B 解析:AgCl(s) Ag+ (aq)+Cl- (aq),由于 c(Ag+ )·c(Cl- )=Ksp,溶液中 c(Cl- )或 c(Ag+ )越 大,越能抑制 AgCl 的溶解,AgCl 的溶解程度就越小。AgCl 的溶解程度大小只与 溶液中 Ag+或 Cl-的浓度有关,而与溶液的体积无关。①c(Cl- )=0.01 mol·L -1 ;② c(Cl- )=0.04 mol·L -1 ;③c(Cl- )=0.03 mol·L -1 ;④c(Cl- )=0 mol·L -1 ;⑤c(Ag+ )=0.05 mol·L - 1。Ag+或 Cl-浓度由小到大的排列顺序为④<①<③<②<⑤,故 AgCl 的溶解程度由 大到小的排列顺序为④>①>③>②>⑤。 4.下列说法中正确的是( )。 A.在一定温度下的 AgCl 水溶液中,Ag+和 Cl-浓度的乘积是一个常数 B.AgCl 的 Ksp=1.8×10-10 ,在任何含 AgCl 固体的溶液中,c(Ag+ )=c(Cl- ),且 Ag+与 Cl- 浓度的乘积均等于 1.8×10-10 C.温度一定时,当溶液中 Ag+和 Cl-浓度的乘积等于 Ksp 的值时,此溶液为 AgCl 的 饱和溶液 D.一定温度下,向饱和 AgCl 水溶液中加入盐酸,Ksp 变大 答案:C 解析:在 AgCl 的饱和溶液中,Ag+和 Cl-浓度的乘积才是一个常数,A 项错误;在含 有 AgCl 固体的溶液中 c(Ag+ )·c(Cl- )=1.8×10-10 ,但 c(Ag+ )不一定等于 c(Cl- ),B 项错 误;当 Q=Ksp 时,溶液为饱和溶液,C 项正确;一定温度下,向饱和 AgCl 溶液中加入 盐酸,不会影响 Ksp,D 项错误。 5.25 ℃时在含有浓度均为 0.01 mol·L -1 的 Cl-、Br-、I -的溶液中,缓慢且少量地加 入 AgNO3 稀溶液,结合溶度积常数判断析出三种沉淀的先后顺序是( )。 A.AgCl、AgBr、AgI B.AgI、AgBr、AgCl C.AgBr、AgCl、AgI D.三种沉淀同时析出 答案:B 解析:AgI 比 AgBr、AgCl 更难溶于水,故 Ag+不足时先生成 AgI,析出沉淀的先后 顺序是 AgI、AgBr、AgCl。 6.在有固态 CaCO3 存在的饱和溶液中,存在着如下平衡 CaCO3(s) Ca2+(aq)+CO3 2- (aq),加入下列溶液能使 CaCO3 质量增大的是( )。 A.CaCl2 溶液 B.KNO3 溶液 C.NH4Cl 溶液 D.NaCl 溶液 答案:A

解析:加入CaC2溶液,溶液中c(Ca+)增大,平衡逆向移动,CaCO3质量增大,A项正 确,加入KNO3溶液,相当于加入水,溶液中c(C+)、c(C0子)均减小,平衡正向移 动,CaCO3质量减小,B项错误;加入NH4CI溶液,NHt水解产生的H+与CO?反 应,c(C0)减小,平衡正向移动,CaCO3质量减小,C项错误;加入NaC1溶液,相当于 加入水,溶液中c(Ca+)、c(C0?)均减小,平衡正向移动,CaCO3质量减小,D项错 误。 7.己知25℃时AgC1和Ag2C04的溶度积分别为1.8×1010和2.0×1012,若用难溶 电解质在溶液中的浓度来表示其溶解度,则下列叙述中正确的是()。 A.AgCI和Ag2CrO4的溶解度相等 B.AgCI的溶解度大于Ag2CrO4的溶解度 C.两者类型不同,不能由Ksp的大小直接判断溶解能力的大小 D.都是难溶电解质,溶解度无意义 答案:C 解析:AgCI和Ag2CO4的阴、阳离子比例不同,不能直接利用Ksp来比较两者溶 解能力的大小,所以只有C项正确:其余三项叙述均错误。若用溶度积比较溶解 度大小,必须是同类型的难溶电解质,否则不能直接比较。 8.己知一定温度下在Ca3(P042的饱和溶液中,c(Ca2+=2.0×106molL-, cP0=1.58×106molL1,则该温度下Ca3(PO42的Kp为()。 A.2.0×1029 B.3.2×1012 C.6.3×1018 D.5.1×10-27 答案:A 解析:Ca3(PO42的饱和溶液中存在沉淀溶解平衡:Ca3(PO42(s一 3Ca2+(aqt2P0(aq),c(Ca2+=2.0×10-6 mol L-,c(P0=1.58×10-6moLl,则该温度 下Ca3(P04)2的Kp=c3(Ca2+)c2(P0)户2.0×10-29。 9.(1)在CaNO32溶液中加入NH4)2CO3溶液后过滤,若测得滤液中c(C0)=1×10 3molL1,则Ca2+是否沉淀完全?(填“是”或“否)。「已知c(Ca2+)≤1×105 mol-L-!时可视为沉淀完全;Ksp(CaC03尸3.4×10-] (2)已知25℃时K'sp[Fe(OH)3]=2.8×1039,此温度下若在实验室中配制2.8molL 100 mL FeCla3溶液,为使配制过程中不出现浑浊现象,则至少需要加入 mL2 mol-L-!的盐酸(忽略加入盐酸的体积): 答案:(1)是(2)5 解析:()根据Kp(CaC0cCa2)a(C03.4×10-,得cCa2+34x1g 1x103 mol-L- 1=3.4×106 mol L-<1×105 mol-L-!,可视为沉淀完全
解析:加入 CaCl2 溶液,溶液中 c(Ca2+)增大,平衡逆向移动,CaCO3 质量增大,A 项正 确;加入 KNO3 溶液,相当于加入水,溶液中 c(Ca2+)、c(CO3 2- )均减小,平衡正向移 动,CaCO3 质量减小,B 项错误;加入 NH4Cl 溶液,NH4 +水解产生的 H+与 CO3 2-反 应,c(CO3 2- )减小,平衡正向移动,CaCO3 质量减小,C 项错误;加入 NaCl 溶液,相当于 加入水,溶液中 c(Ca2+)、c(CO3 2- )均减小,平衡正向移动,CaCO3 质量减小,D 项错 误。 7.已知 25 ℃时 AgCl 和 Ag2CrO4 的溶度积分别为 1.8×10-10和 2.0×10-12 ,若用难溶 电解质在溶液中的浓度来表示其溶解度,则下列叙述中正确的是( )。 A.AgCl 和 Ag2CrO4 的溶解度相等 B.AgCl 的溶解度大于 Ag2CrO4 的溶解度 C.两者类型不同,不能由 Ksp 的大小直接判断溶解能力的大小 D.都是难溶电解质,溶解度无意义 答案:C 解析:AgCl 和 Ag2CrO4 的阴、阳离子比例不同,不能直接利用 Ksp来比较两者溶 解能力的大小,所以只有 C 项正确;其余三项叙述均错误。若用溶度积比较溶解 度大小,必须是同类型的难溶电解质,否则不能直接比较。 8.已知一定温度下在 Ca3(PO4)2 的饱和溶液中,c(Ca2+)=2.0×10-6 mol·L -1 , c(PO4 3- )=1.58×10-6 mol·L -1 ,则该温度下 Ca3(PO4)2 的 Ksp为( )。 A.2.0×10-29 B.3.2×10-12 C.6.3×10-18 D.5.1×10-27 答案:A 解析:Ca3(PO4)2 的饱和溶液中存在沉淀溶解平衡:Ca3(PO4)2(s) 3Ca2+(aq)+2PO4 3- (aq),c(Ca2+)=2.0×10-6 mol·L -1 ,c(PO4 3- )=1.58×10-6 mol·L -1 ,则该温度 下 Ca3(PO4)2 的 Ksp=c 3 (Ca2+)·c 2 (PO4 3- )≈2.0×10-29。 9.(1)在 Ca(NO3)2 溶液中加入(NH4)2CO3溶液后过滤,若测得滤液中 c(CO3 2- )=1×10- 3 mol·L -1 ,则 Ca2+是否沉淀完全? (填“是”或“否”)。[已知 c(Ca2+)≤1×10-5 mol·L -1 时可视为沉淀完全;Ksp(CaCO3)=3.4×10-9 ] (2)已知 25 ℃时 Ksp[Fe(OH)3]=2.8×10-39 ,此温度下若在实验室中配制 2.8 mol·L -1 100 mL FeCl3 溶液,为使配制过程中不出现浑浊现象,则至少需要加入 mL 2 mol·L -1 的盐酸(忽略加入盐酸的体积)。 答案:(1)是 (2)5 解析:(1)根据 Ksp(CaCO3)=c(Ca2+)·c(CO3 2- )=3.4×10-9 ,得 c(Ca2+)=3.4×10 -9 1×10 -3 mol·L - 1=3.4×10-6 mol·L -1<1×10-5 mol·L -1 ,可视为沉淀完全
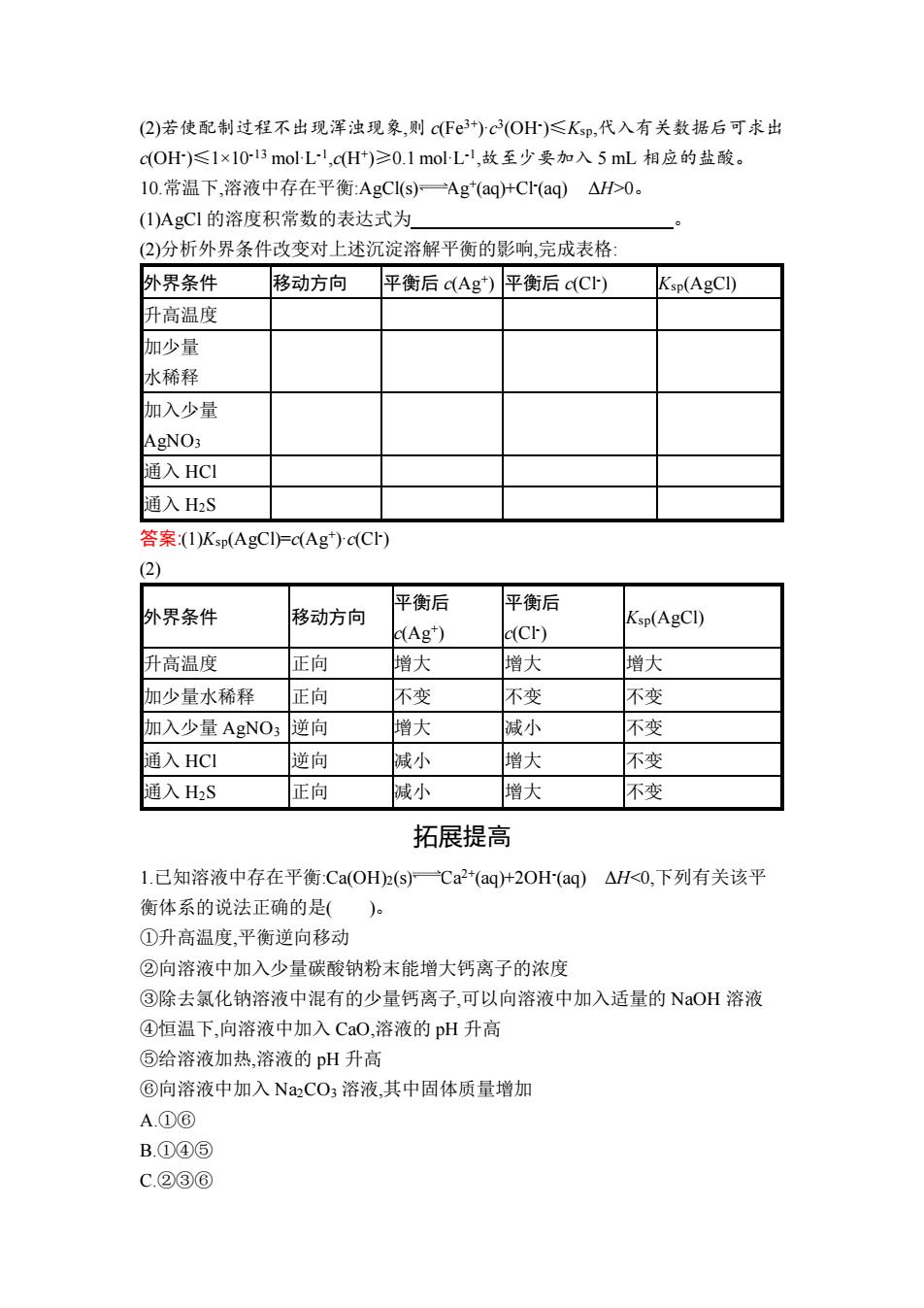
(2)若使配制过程不出现浑浊现象,则c(F3+)c3(OH)≤Ksp,代入有关数据后可求出 c(OH)≤1×10l3moLl,cH)≥0.1molL,故至少要加入5mL相应的盐酸。 10.常温下,溶液中存在平衡:AgCI(s)一Ag*(aq)+CI(aq)△H>0。 (1)AgCI的溶度积常数的表达式为 (2)分析外界条件改变对上述沉淀溶解平衡的影响,完成表格: 外界条件 移动方向 平衡后c(Ag) 平衡后c(C) Ksp(AgCI) 升高温度 加少量 水稀释 加入少量 AgNO3 通入HCI 通入H2S 答案:1)Ksp(AgCI)=c(Ag)c(Cr) (2) 平衡后 平衡后 外界条件 移动方向 Ksp(AgCl) d(Ag") (Cr) 升高温度 正向 增大 增大 增大 加少量水稀释 正向 不变 不变 不变 加入少量AgNO3 逆向 增大 减小 不变 通入HCI 逆向 减小 增大 不变 通入H2S 正向 减小 增大 不变 拓展提高 1.已知溶液中存在平衡Ca(OH)2(s)℃a2+(aq+2OH(aq) △H<0.下列有关该平 衡体系的说法正确的是()。 ①升高温度,平衡逆向移动 ②向溶液中加入少量碳酸钠粉末能增大钙离子的浓度 ③除去氯化钠溶液中混有的少量钙离子,可以向溶液中加入适量的NaOH溶液 ④恒温下,向溶液中加入CaO,溶液的pH升高 ⑤给溶液加热,溶液的pH升高 ⑥向溶液中加入Na2CO3溶液,其中固体质量增加 A.①⑥ B.①④⑤ C.②③⑥
(2)若使配制过程不出现浑浊现象,则 c(Fe3+)·c 3 (OH- )≤Ksp,代入有关数据后可求出 c(OH- )≤1×10-13 mol·L -1 ,c(H+ )≥0.1 mol·L -1 ,故至少要加入 5 mL 相应的盐酸。 10.常温下,溶液中存在平衡:AgCl(s) Ag+ (aq)+Cl- (aq) ΔH>0。 (1)AgCl 的溶度积常数的表达式为 。 (2)分析外界条件改变对上述沉淀溶解平衡的影响,完成表格: 外界条件 移动方向 平衡后 c(Ag+ ) 平衡后 c(Cl- ) Ksp(AgCl) 升高温度 加少量 水稀释 加入少量 AgNO3 通入 HCl 通入 H2S 答案:(1)Ksp(AgCl)=c(Ag+ )·c(Cl- ) (2) 外界条件 移动方向 平衡后 c(Ag+ ) 平衡后 c(Cl- ) Ksp(AgCl) 升高温度 正向 增大 增大 增大 加少量水稀释 正向 不变 不变 不变 加入少量 AgNO3 逆向 增大 减小 不变 通入 HCl 逆向 减小 增大 不变 通入 H2S 正向 减小 增大 不变 拓展提高 1.已知溶液中存在平衡:Ca(OH)2(s) Ca2+(aq)+2OH- (aq) ΔH<0,下列有关该平 衡体系的说法正确的是( )。 ①升高温度,平衡逆向移动 ②向溶液中加入少量碳酸钠粉末能增大钙离子的浓度 ③除去氯化钠溶液中混有的少量钙离子,可以向溶液中加入适量的 NaOH 溶液 ④恒温下,向溶液中加入 CaO,溶液的 pH 升高 ⑤给溶液加热,溶液的 pH 升高 ⑥向溶液中加入 Na2CO3 溶液,其中固体质量增加 A.①⑥ B.①④⑤ C.②③⑥

D.①②⑥ 答案A 解析:根据沉淀溶解平衡特点,正向放热,升温时,平衡左移,①对:加入碳酸钠粉末生 成CaCO3,使Ca+浓度减小,②错:加入氢氧化钠溶液会使平衡左移,有Ca(OH)2沉 淀生成,但Ca(OH)2的溶度积较大,要除去Ca2+,应把Ca+转化为更难溶的CaCO3, ③错;恒温下Ksp不变,加入CaO后,溶液仍为Ca(OH)2的饱和溶液,pH不变,④错; 加热,Ca(OH)2的溶解度减小,溶液的pH降低,⑤错;加入Na2CO3溶液,沉淀溶解平 衡向右移动,Ca(OH)2固体转化为CaCO3固体,固体质量增大,⑥对。 2.室温时,M(OH)2(s)M2+(aq+2OH(aq)Ksp=a,在M(OH)2的饱和溶液中 cMP+=b mol L-!时,溶液的pH等于() A哈 B2g号 C.14+号 D.14+e哈 答案C 解析:由Kp=cM2)c2(OHr)得cOHr=号)mol-L,Kw=cH)cOHr)得 号克molL-pH=-l1g2xo4 C(Ht)=1x1024 3.己知25℃时,电离常数Ka(HF=3.6×104,溶度积常数Ksp(CaF2=1.46×1010。现 向1L0.2moL1HF溶液中加入1L0.2molL1CaC2溶液,下列说法正确的是 () A.25℃时,0.1 mol-LHF溶液中pH=1 B.Ksp(CaF2)随温度和浓度的变化而变化 C该体系中Kn(CaF2K而 D.该体系中有CaF2沉淀产生 答案D 解析HF为弱酸,不能完全电离,则25℃时,0.1 mol-L-1 HF溶液中pH>1,A项错 误:Kn与浓度无关,B项错误;由已知得Kn(CaF广xC项错误:两溶液混合 后,c(Ca2+)=0.1 mol-L-!,c(F=√K(HF)×cHF)=6×10-3molL1,则 Q=c2(F)c(Ca2+)=3.6×10-6>Ksp(CaF2),故体系中有CaF2沉淀产生,D项正确
D.①②⑥ 答案:A 解析:根据沉淀溶解平衡特点,正向放热,升温时,平衡左移,①对;加入碳酸钠粉末生 成 CaCO3,使 Ca2+浓度减小,②错;加入氢氧化钠溶液会使平衡左移,有 Ca(OH)2 沉 淀生成,但 Ca(OH)2 的溶度积较大,要除去 Ca2+ ,应把 Ca2+转化为更难溶的 CaCO3, ③错;恒温下 Ksp 不变,加入 CaO 后,溶液仍为 Ca(OH)2的饱和溶液,pH 不变,④错; 加热,Ca(OH)2 的溶解度减小,溶液的 pH 降低,⑤错;加入 Na2CO3溶液,沉淀溶解平 衡向右移动,Ca(OH)2 固体转化为 CaCO3 固体,固体质量增大,⑥对。 2.室温时,M(OH)2(s) M2+(aq)+2OH- (aq) Ksp=a,在 M(OH)2 的饱和溶液中 c(M2+)=b mol·L -1 时,溶液的 pH 等于( )。 A. 1 2 lg𝑏 𝑎 B. 1 2 lg𝑎 𝑏 C.14+1 2 lg𝑎 𝑏 D.14+1 2 lg𝑏 𝑎 答案:C 解析:由 Ksp=c(M2+)·c 2 (OH- )得 c(OH- )=(𝑎 𝑏 ) 1 2 mol·L -1 ,KW=c(H+ )·c(OH- )得 c(H+ )=1×10 -14 ( 𝑎 𝑏 ) 1 2 mol·L -1 ,pH=-lg1×10 -14 ( 𝑎 𝑏 ) 1 2 =14+1 2 lg𝑎 𝑏 。 3.已知 25 ℃时,电离常数 Ka(HF)=3.6×10-4 ,溶度积常数 Ksp(CaF2)=1.46×10-10。现 向 1 L 0.2 mol·L -1 HF 溶液中加入 1 L 0.2 mol·L -1 CaCl2 溶液,下列说法正确的是 ( )。 A.25 ℃时,0.1 mol·L -1HF 溶液中 pH=1 B.Ksp(CaF2)随温度和浓度的变化而变化 C.该体系中 Ksp(CaF2)= 1 𝐾a (HF) D.该体系中有 CaF2 沉淀产生 答案:D 解析:HF 为弱酸,不能完全电离,则 25 ℃时,0.1 mol·L -1 HF 溶液中 pH>1,A 项错 误;Ksp 与浓度无关,B 项错误;由已知得 Ksp(CaF2)≠ 1 𝐾a (HF) ,C 项错误;两溶液混合 后,c(Ca2+)=0.1 mol·L -1 ,c(F- )=√𝐾a (HF) × 𝑐(HF)=6×10-3 mol·L -1 ,则 Q=c 2 (F- )·c(Ca2+)=3.6×10-6>Ksp(CaF2),故体系中有 CaF2沉淀产生,D 项正确