
第三节金属的腐蚀与防护 课后·训练提升 基础巩固 1.铁锅表面覆盖有下列物质时,锈蚀最快的是( A.水 B.食盐水 C.食用油 D.酒精 答案B 解析:当形成电化学腐蚀,且铁作原电池的负极材料时,表面覆盖的溶液导电性越 强,锈蚀越快。食用油和酒精不能导电,不能形成原电池反应,而水的导电性没有 食盐水强,所以锈蚀最快的是食盐水,故选B。 2.下列叙述不正确的是()。 A.锌与稀硫酸反应制取氢气,加入少量的硫酸铜能增大反应速率 B.镀层破损后,白铁(镀锌的铁)比马口铁(镀锡的铁)更易被腐蚀 C.钢铁表面常易被锈蚀生成Fe2O3nH2O D钢铁在发生析氢腐蚀和吸氧腐蚀时,完全相同的反应是负极反应 答案B 解析:锌与CuSO4发生置换反应后,铜附着在锌的表面上,浸泡在稀硫酸中形成锌 铜原电池,负极锌被氧化而加速反应,A项正确:镀锌的铁构成原电池时锌为负极, 铁为正极,铁被保护,镀锡的铁构成原电池时铁作负极,锡作正极,加速了铁的腐 蚀,B项不正确:钢铁的锈蚀主要是吸氧腐蚀,负极(Fe)反应为Fe-2eF+,正极 (C)反应为2H20+O2+4e一4OH,形成Fe(OH2,在空气中4Fe(OH)2+O2+2HC 4Fe(OH)3,久置后2Fe(OH)一Fe2O3+3HO,所以铁锈的成分是Fe2O3nH2O,C项 正确:钢铁在发生析氢腐蚀和吸氧腐蚀时,负极反应相同,都是F-2eFe2+,但正 极反应不同,分别是析出氢气和吸收氧气,D项正确。 3.下列说法中,不正确的是( Fe2+电解质溶液O2 A钢铁表面水膜的酸性很弱或呈中性,发生吸氧腐蚀
第三节 金属的腐蚀与防护 课后· 基础巩固 1.铁锅表面覆盖有下列物质时,锈蚀最快的是( )。 A.水 B.食盐水 C.食用油 D.酒精 答案:B 解析:当形成电化学腐蚀,且铁作原电池的负极材料时,表面覆盖的溶液导电性越 强,锈蚀越快。食用油和酒精不能导电,不能形成原电池反应,而水的导电性没有 食盐水强,所以锈蚀最快的是食盐水,故选 B。 2.下列叙述不正确的是( )。 A.锌与稀硫酸反应制取氢气,加入少量的硫酸铜能增大反应速率 B.镀层破损后,白铁(镀锌的铁)比马口铁(镀锡的铁)更易被腐蚀 C.钢铁表面常易被锈蚀生成 Fe2O3·nH2O D.钢铁在发生析氢腐蚀和吸氧腐蚀时,完全相同的反应是负极反应 答案:B 解析:锌与 CuSO4 发生置换反应后,铜附着在锌的表面上,浸泡在稀硫酸中形成锌 铜原电池,负极锌被氧化而加速反应,A 项正确;镀锌的铁构成原电池时锌为负极, 铁为正极,铁被保护,镀锡的铁构成原电池时铁作负极,锡作正极,加速了铁的腐 蚀,B 项不正确;钢铁的锈蚀主要是吸氧腐蚀,负极(Fe)反应为 Fe-2e- Fe2+ ,正极 (C)反应为 2H2O+O2+4e- 4OH- ,形成 Fe(OH)2,在空气中 4Fe(OH)2+O2+2H2O 4Fe(OH)3,久置后 2Fe(OH)3 Fe2O3+3H2O,所以铁锈的成分是 Fe2O3·nH2O,C 项 正确;钢铁在发生析氢腐蚀和吸氧腐蚀时,负极反应相同,都是 Fe-2e- Fe2+ ,但正 极反应不同,分别是析出氢气和吸收氧气,D 项正确。 3.下列说法中,不正确的是( )。 A.钢铁表面水膜的酸性很弱或呈中性,发生吸氧腐蚀
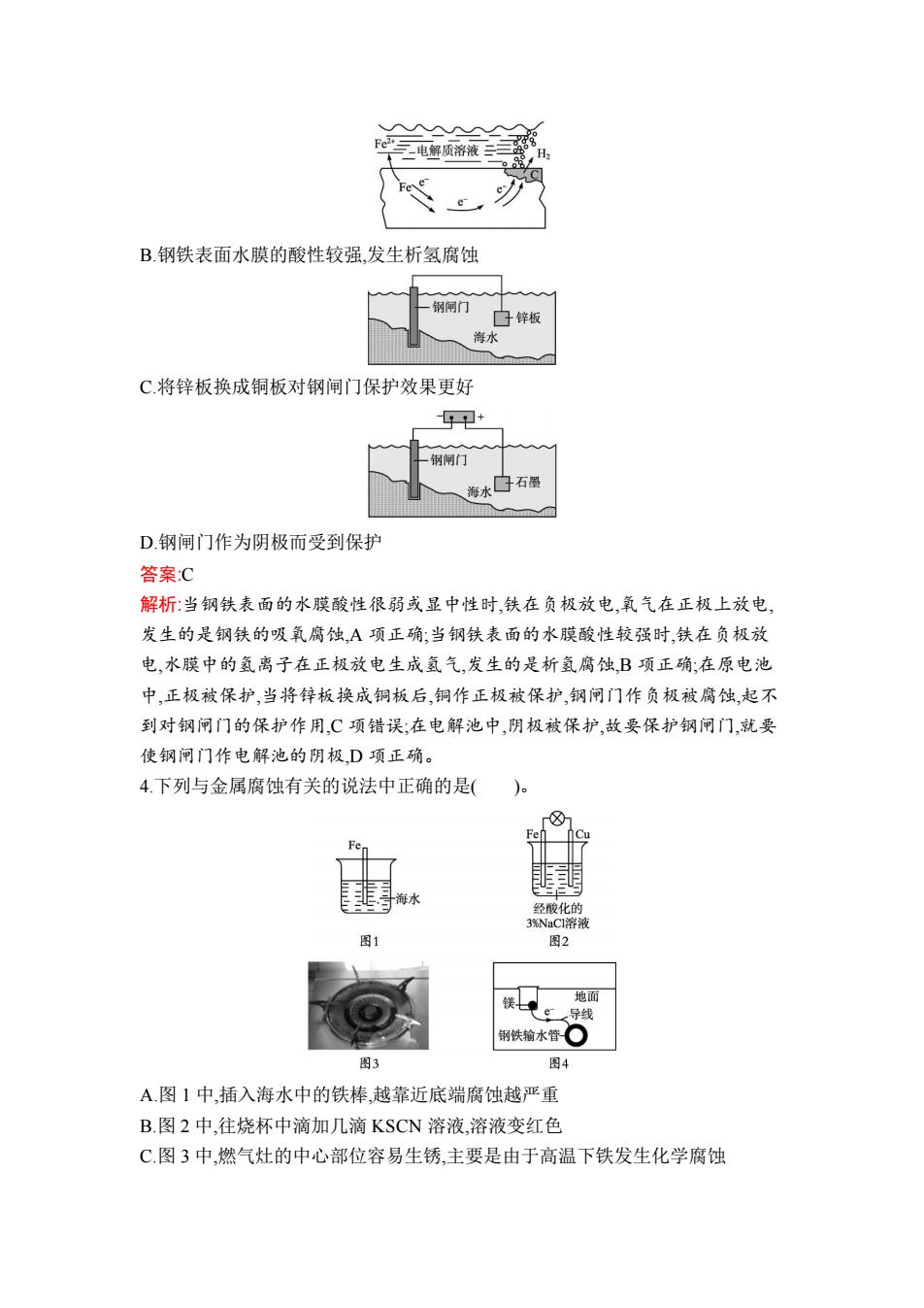
心电解质溶液 B.钢铁表面水膜的酸性较强,发生析氢腐蚀 钢闸门 子锌板 海水 C.将锌板换成铜板对钢闸门保护效果更好 中印+ 钢闸门 海水口石图 D钢闸门作为阴极而受到保护 答案:C 解析:当钢铁表面的水膜酸性很弱或显中性时,铁在负极放电,氧气在正极上放电, 发生的是钢铁的吸氧腐蚀,A项正确;当钢铁表面的水膜酸性较强时,铁在负极放 电,水膜中的氢离子在正极放电生成氢气,发生的是析氢腐蚀,B项正确:在原电池 中,正极被保护,当将锌板换成铜板后,铜作正极被保护,钢闸门作负极被腐蚀,起不 到对钢闸门的保护作用,C项错误;在电解池中,阴极被保护,故要保护钢闸门,就要 使钢闸门作电解池的阴极,D项正确。 4.下列与金属腐蚀有关的说法中正确的是( )。 圉将水 经酸化的 3NaCI溶液 图1 图2 铁民导线 地面 钢铁输水管○ 图3 图4 A.图1中,插入海水中的铁棒,越靠近底端腐蚀越严重 B.图2中,往烧杯中滴加几滴KSCN溶液,溶液变红色 C.图3中,燃气灶的中心部位容易生锈,主要是由于高温下铁发生化学腐蚀
B.钢铁表面水膜的酸性较强,发生析氢腐蚀 C.将锌板换成铜板对钢闸门保护效果更好 D.钢闸门作为阴极而受到保护 答案:C 解析:当钢铁表面的水膜酸性很弱或显中性时,铁在负极放电,氧气在正极上放电, 发生的是钢铁的吸氧腐蚀,A 项正确;当钢铁表面的水膜酸性较强时,铁在负极放 电,水膜中的氢离子在正极放电生成氢气,发生的是析氢腐蚀,B 项正确;在原电池 中,正极被保护,当将锌板换成铜板后,铜作正极被保护,钢闸门作负极被腐蚀,起不 到对钢闸门的保护作用,C 项错误;在电解池中,阴极被保护,故要保护钢闸门,就要 使钢闸门作电解池的阴极,D 项正确。 4.下列与金属腐蚀有关的说法中正确的是( )。 A.图 1 中,插入海水中的铁棒,越靠近底端腐蚀越严重 B.图 2 中,往烧杯中滴加几滴 KSCN 溶液,溶液变红色 C.图 3 中,燃气灶的中心部位容易生锈,主要是由于高温下铁发生化学腐蚀

D.图4中,用牺牲镁块的方法来防止地下钢铁管道的腐蚀,镁块相当于原电池的正 极 答案:C 解析:插入海水中的铁棒,除发生化学腐蚀外,靠近液面的地方还会发生电化学腐 蚀,越靠近液面腐蚀越严重,A项错误;图2中Fe作负极,失电子,生成Fe2+,滴加几 滴KSCN溶液,溶液不变红色,B项错误;高温下铁发生氧化反应,发生化学腐蚀,C 项正确:镁块相当于原电池的负极,失电子,从而保护地下钢铁管道,D项错误。 5用如图所示装置来研究钢铁制品的腐蚀,装置的气密性良好,且开始时U形管两 端的红墨水液面相平。一段时间后能观察到铁钉生锈。下列说法不正确的是 () A.铁钉表面发生的反应为Fe-3e一Fe3+ B.若液体a为稀醋酸,则U形管液面左低右高 C.若液体a为食盐水,则U形管液面左高右低 D.若液体a为食用油,则铁钉生锈较慢 答案:A 解析:铁钉发生电化学腐蚀时,电极反应式为Fe-2e一Fe2+,A项错误;若液体a为 稀醋酸,则试管内发生析氢腐蚀,试管内压强增大,故U形管液面左低右高,B项正 确:若液体a为食盐水,试管内发生吸氧腐蚀,压强减小,故U形管液面左高右低,C 项正确:若液体a为食用油,则不能形成原电池,铁钉生锈较慢,D项正确。 6.为延长舰船服役寿命可采用的电化学防腐的方法如下:①舰体与直流电源相连。 ②舰体上镶嵌某种金属块。下列有关说法正确的是( A.方法①中舰体应连电源的正极 B.方法②中镶嵌的金属块可以是锌 C.方法①为牺牲阳极法 D.方法②为外加电流法 答案B 解析:舰体是由钢板做的,方法①舰体若与电源相连,必须与电源负极相连,A项错 误;方法②舰体镶嵌的一些金属块,必须是比铁活泼的金属,如锌等,B项正确:方法 ②舰体镶嵌一些金属块,这种方法叫牺牲阳极法,C项错误,方法①舰体与电源相 连,这种方法叫外加电流法,D项错误。 7.如图表示的是钢铁在海水中的锈蚀过程,以下有关说法正确的是()
D.图 4 中,用牺牲镁块的方法来防止地下钢铁管道的腐蚀,镁块相当于原电池的正 极 答案:C 解析:插入海水中的铁棒,除发生化学腐蚀外,靠近液面的地方还会发生电化学腐 蚀,越靠近液面腐蚀越严重,A 项错误;图 2 中 Fe 作负极,失电子,生成 Fe2+ ,滴加几 滴 KSCN 溶液,溶液不变红色,B 项错误;高温下铁发生氧化反应,发生化学腐蚀,C 项正确;镁块相当于原电池的负极,失电子,从而保护地下钢铁管道,D 项错误。 5.用如图所示装置来研究钢铁制品的腐蚀,装置的气密性良好,且开始时 U 形管两 端的红墨水液面相平。一段时间后能观察到铁钉生锈。下列说法不正确的是 ( )。 A.铁钉表面发生的反应为 Fe-3e- Fe3+ B.若液体 a 为稀醋酸,则 U 形管液面左低右高 C.若液体 a 为食盐水,则 U 形管液面左高右低 D.若液体 a 为食用油,则铁钉生锈较慢 答案:A 解析:铁钉发生电化学腐蚀时,电极反应式为 Fe-2e- Fe2+,A 项错误;若液体 a 为 稀醋酸,则试管内发生析氢腐蚀,试管内压强增大,故 U 形管液面左低右高,B 项正 确;若液体 a 为食盐水,试管内发生吸氧腐蚀,压强减小,故 U 形管液面左高右低,C 项正确;若液体 a 为食用油,则不能形成原电池,铁钉生锈较慢,D 项正确。 6.为延长舰船服役寿命可采用的电化学防腐的方法如下:①舰体与直流电源相连; ②舰体上镶嵌某种金属块。下列有关说法正确的是( )。 A.方法①中舰体应连电源的正极 B.方法②中镶嵌的金属块可以是锌 C.方法①为牺牲阳极法 D.方法②为外加电流法 答案:B 解析:舰体是由钢板做的,方法①舰体若与电源相连,必须与电源负极相连,A 项错 误;方法②舰体镶嵌的一些金属块,必须是比铁活泼的金属,如锌等,B 项正确;方法 ②舰体镶嵌一些金属块,这种方法叫牺牲阳极法,C 项错误;方法①舰体与电源相 连,这种方法叫外加电流法,D 项错误。 7.如图表示的是钢铁在海水中的锈蚀过程,以下有关说法正确的是( )

Fe2+海水O2OH A.该金属腐蚀过程为析氢腐蚀 B.正极为C,发生的反应为氧化反应 C.在酸性条件下发生的是吸氧腐蚀 D.正极反应为O2+2H2O+4e一4OH 答案D 解析:钢铁中含有铁和碳,在潮湿的环境中构成原电池,铁作负极,碳作正极。从图 中看出,氧气参与反应,应该是发生了吸氧腐蚀,A项错误;碳作正极,发生的反应为 还原反应,B项错误:在酸性环境下发生的是析氢腐蚀,C项错误;吸氧腐蚀时,氧气 在正极发生得电子的还原反应:O2+2H20+4e一4OH,D项正确。 8.埋在地下的钢管道可以用如图所示方法进行电化学保护。下列说法正确的是 () 检测桩 金属连接片 地面 777777 777777777777777 钢管道 镁块 潮湿的碱性土壤 A.该方法将电能转化成化学能 B.在此装置中钢管道作正极 C.该方法称为外加电流法 D.镁块上发生的电极反应为O2+2H20+4e一4OH 答案B 解析:该方法是将化学能转化成了电能,A项错误:根据图片知,该金属防护措施采 用的是栖牲阳极法,钢管道作正极,B项正确,C项错误:镁块作负极,电极反 应:Mg+2OH-2e一Mg(OH2,D项错误。 9.某课外活动小组,将剪下的一块镀锌铁片放入试剂瓶中,加入少量食盐水,再加数 滴酚酞溶液,按下图装置进行实验,数分钟后观察,下列现象不可能出现的是 () 镀锌铁片 ☑ -H2O A.乙中导气管里形成一段水柱
A.该金属腐蚀过程为析氢腐蚀 B.正极为 C,发生的反应为氧化反应 C.在酸性条件下发生的是吸氧腐蚀 D.正极反应为 O2+2H2O+4e- 4OH- 答案:D 解析:钢铁中含有铁和碳,在潮湿的环境中构成原电池,铁作负极,碳作正极。从图 中看出,氧气参与反应,应该是发生了吸氧腐蚀,A 项错误;碳作正极,发生的反应为 还原反应,B 项错误;在酸性环境下发生的是析氢腐蚀,C 项错误;吸氧腐蚀时,氧气 在正极发生得电子的还原反应:O2+2H2O+4e- 4OH- ,D 项正确。 8.埋在地下的钢管道可以用如图所示方法进行电化学保护。下列说法正确的是 ( )。 A.该方法将电能转化成化学能 B.在此装置中钢管道作正极 C.该方法称为外加电流法 D.镁块上发生的电极反应为 O2+2H2O+4e- 4OH- 答案:B 解析:该方法是将化学能转化成了电能,A 项错误;根据图片知,该金属防护措施采 用的是牺牲阳极法,钢管道作正极,B 项正确,C 项错误;镁块作负极,电极反 应:Mg+2OH- -2e- Mg(OH)2,D 项错误。 9.某课外活动小组,将剪下的一块镀锌铁片放入试剂瓶中,加入少量食盐水,再加数 滴酚酞溶液,按下图装置进行实验,数分钟后观察,下列现象不可能出现的是 ( )。 A.乙中导气管里形成一段水柱

B.乙中导气管中产生气泡 C.金属片剪口处溶液变红 D.锌被腐蚀 答案B 解析:镀锌铁片与食盐水形成的原电池中,金属锌为负极,发生反应:Zn-2e一乙n+ 铁为正极,发生吸氧腐蚀,即2H2O+O2+4e一4OH,所以锥形瓶中气体压强减小,导 气管里形成一段水柱,生成的氢氧根离子能使酚酞溶液变红色。原电池形成后没 有气体生成,所以乙中导气管中不会产生气泡,B项错误。 10.铁生锈是比较常见的现象,某实验小组为研究铁生锈的条件,设计了以下快 速、易行的实验步骤(夹持装置已省略): 放置在空 气中的潮 KMnO 干燥的团 固体 潮湿的团湿的团状 状细铁丝 状细铁丝细铁丝 首先检查制氧气装置的气密性,然后按图连接好装置,点燃酒精灯给试剂加热,持 续3mi左右,观察到的实验现象为:①直形管中用蒸馏水浸过的光亮铁丝表面颜 色变得灰暗,发生锈蚀:②直形管中干燥的铁丝表面依然光亮,没有发生锈蚀:③烧 杯中潮湿的铁丝依然光亮。 试回答以下问题。 (1)由于接触的介质不同,金属腐蚀分成不同类型,本实验中铁生锈属 于 。 能表示其原理的反应方程式为 (2)仪器A的名称为 其中装的试剂可以是 其作用是 (3)由实验可知,该类铁生锈的条件为 决定铁 生锈快慢的一个重要因素是 答案(1)电化学腐蚀负极:2Fe-4e一2Fe2+,正极:2H0+02+4e一4OH (2)球形干燥管碱石灰(或无水氯化钙)干燥O2 (3)与O2接触、与水接触氧气浓度 解析:钢铁在潮湿环境中形成原电池,发生电化学腐蚀。此实验在直形管中的现象 说明,潮湿是铁生锈的前提。直形管中与烧杯中实验现象的对比,则说明O2浓度 是影响铁丝生锈快慢的一个重要因素。 拓展提高 1.如图是金属牺牲阳极法的实验装置,有关说法正确的是(
B.乙中导气管中产生气泡 C.金属片剪口处溶液变红 D.锌被腐蚀 答案:B 解析:镀锌铁片与食盐水形成的原电池中,金属锌为负极,发生反应:Zn-2e- Zn2+ , 铁为正极,发生吸氧腐蚀,即 2H2O+O2+4e- 4OH- ,所以锥形瓶中气体压强减小,导 气管里形成一段水柱,生成的氢氧根离子能使酚酞溶液变红色。原电池形成后没 有气体生成,所以乙中导气管中不会产生气泡,B 项错误。 10.铁生锈是比较常见的现象,某实验小组为研究铁生锈的条件,设计了以下快 速、易行的实验步骤(夹持装置已省略): 首先检查制氧气装置的气密性,然后按图连接好装置,点燃酒精灯给试剂加热,持 续 3 min 左右,观察到的实验现象为:①直形管中用蒸馏水浸过的光亮铁丝表面颜 色变得灰暗,发生锈蚀;②直形管中干燥的铁丝表面依然光亮,没有发生锈蚀;③烧 杯中潮湿的铁丝依然光亮。 试回答以下问题。 (1)由于接触的介质不同,金属腐蚀分成不同类型,本实验中铁生锈属 于 。能表示其原理的反应方程式为 。 (2)仪器 A 的名称为 ,其中装的试剂可以是 , 其作用是 。 (3)由实验可知,该类铁生锈的条件为 。决定铁 生锈快慢的一个重要因素是 。 答案:(1)电化学腐蚀 负极:2Fe-4e- 2Fe2+ ,正极:2H2O+O2+4e- 4OH- (2)球形干燥管 碱石灰(或无水氯化钙) 干燥 O2 (3)与 O2 接触、与水接触 氧气浓度 解析:钢铁在潮湿环境中形成原电池,发生电化学腐蚀。此实验在直形管中的现象 说明,潮湿是铁生锈的前提。直形管中与烧杯中实验现象的对比,则说明 O2 浓度 是影响铁丝生锈快慢的一个重要因素。 拓展提高 1.如图是金属牺牲阳极法的实验装置,有关说法正确的是( )