
第2课时 影响化学平衡的因素 课后·训练提升 基础巩固 1.下列说法不正确的是()。 A.反应混合物中各组分百分含量发生改变,化学平衡一定发生了移动 B.外界条件的改变引起v正遮,则平衡一定发生移动 C.平衡移动时,反应物的浓度一定减小 D.外界条件发生变化,化学平衡不一定移动 答案:C 解析:外界条件的改变使正、逆反应速率不相等时才能使化学平衡发生移动,升高 温度使化学平衡逆向移动时反应物的浓度增大。 2.已知反应A2(g十2B2(g)一2AB2(g)△H<0,下列说法正确的是()。 A.升高温度,正反应速率减小,逆反应速率增大,平衡向逆反应方向移动 B.升高温度有利于反应速率的增大,从而缩短达到平衡所需的时间 C.达到平衡后,升高温度或增大压强(减小容器的容积)都有利于该反应平衡正向 移动 D达到平衡后,降低温度或减小压强(增大容器的容积)都有利于该反应平衡正向 移动 答案B 解析:A2(g十2B2(g)一2AB2(g)的正反应是放热的、气体体积缩小的反应,升高温 度,正、逆反应速率均增大,达到平衡需要的时间减少,但吸热方向的速率增大得 更多,所以平衡向逆反应方向移动,A项、C项错误,B项正确:减小压强(增大容器 的容积),平衡向逆反应方向移动,D项错误。 3.已知化学反应2A(?)十B(g)2C(?)达到平衡,当增大压强(减小容积)时,平衡向 逆反应方向移动,则下列情况可能的是( A.A是气体C是固体 B.A、C均为气体 C.A、C均为固体 D.A是固体,C是气体 答案D 解析:增大压强,平衡逆向移动说明逆反应是气体物质的量减小的反应,故C为气 体,A为非气态(如固体)
第 2 课时 影响化学平衡的因素 课后· 基础巩固 1.下列说法不正确的是( )。 A.反应混合物中各组分百分含量发生改变,化学平衡一定发生了移动 B.外界条件的改变引起 v 正≠v 逆,则平衡一定发生移动 C.平衡移动时,反应物的浓度一定减小 D.外界条件发生变化,化学平衡不一定移动 答案:C 解析:外界条件的改变使正、逆反应速率不相等时才能使化学平衡发生移动,升高 温度使化学平衡逆向移动时反应物的浓度增大。 2.已知反应 A2(g)+2B2(g) 2AB2(g) ΔH<0,下列说法正确的是( )。 A.升高温度,正反应速率减小,逆反应速率增大,平衡向逆反应方向移动 B.升高温度有利于反应速率的增大,从而缩短达到平衡所需的时间 C.达到平衡后,升高温度或增大压强(减小容器的容积)都有利于该反应平衡正向 移动 D.达到平衡后,降低温度或减小压强(增大容器的容积)都有利于该反应平衡正向 移动 答案:B 解析:A2(g)+2B2(g) 2AB2(g)的正反应是放热的、气体体积缩小的反应,升高温 度,正、逆反应速率均增大,达到平衡需要的时间减少,但吸热方向的速率增大得 更多,所以平衡向逆反应方向移动,A 项、C 项错误,B 项正确;减小压强(增大容器 的容积),平衡向逆反应方向移动,D 项错误。 3.已知化学反应 2A(?)+B(g) 2C(?)达到平衡,当增大压强(减小容积)时,平衡向 逆反应方向移动,则下列情况可能的是( )。 A.A 是气体,C 是固体 B.A、C 均为气体 C.A、C 均为固体 D.A 是固体,C 是气体 答案:D 解析:增大压强,平衡逆向移动说明逆反应是气体物质的量减小的反应,故 C 为气 体,A 为非气态(如固体)

4.恒温下,反应:aX(g)一bY(g十cZ(g)达到平衡后,把容器容积压缩到原来的一半 且达到新平衡时,X的物质的量浓度由0.1molL1增大到0.19molL1,下列判断 正确的是( A.a>b+c B.a<b+c C.a=b+c D.a=b=c 答案:A 解析:由于容积减小一半,而X的浓度增大不到原来的2倍,说明增大压强,平衡向 正反应方向移动,正反应气体体积缩小,所以心b什c。 5.在一定条件下,反应:2S02(g+02(g)一2S03(g)达到了平衡,改变某一条件,发生 下述变化,其中可确定该平衡一定发生移动的是()。 A.v(SO2)增大 B.vSO3)减小 C.O2的百分含量发生变化 D.SO3的质量不变 答案:C 解析:若正、逆反应速率同等程度地增大或减小,仍然相等,平衡不移动:O2的百分 含量发生变化,化学平衡一定发生移动:SO3的质量不变,平衡不移动。 6.己知反应2NO(g+O2(g)2NO2(g)△H<0,如图所示的曲线是其他条件一定 时,NO的平衡转化率与温度的关系曲线。图中标有A、B、C、D四点,其中表示 未达到平衡状态,且v正>v运的点是( )。 4NO的转化率 ·A C 温度 AA点 B.B点 C.C点 DD点 答案:C 解析:坐标系的纵轴表示NO的平衡转化率横轴表示温度,曲线上的任意一点表 示在该温度下达到平衡状态时对应的NO的转化率。C点时NO的平衡转化率 比对应温度下的NO的平衡转化率小,因此需要转化更多的NO,即C点未达到平 衡状态,且v>v延。A点表示未达到平衡状态,但A点时NO的平衡转化率比对 应温度下的NO的平衡转化率大,V<v逆。B、D点表示达到平衡状态。 7.一定条件下,生成物水蒸气含量随反应时间的变化趋势符合下图的是( )
4.恒温下,反应:aX(g) bY(g)+cZ(g)达到平衡后,把容器容积压缩到原来的一半 且达到新平衡时,X 的物质的量浓度由 0.1 mol·L -1 增大到 0.19 mol·L -1 ,下列判断 正确的是( )。 A.a>b+c B.a<b+c C.a=b+c D.a=b=c 答案:A 解析:由于容积减小一半,而 X 的浓度增大不到原来的 2 倍,说明增大压强,平衡向 正反应方向移动,正反应气体体积缩小,所以 a>b+c。 5.在一定条件下,反应:2SO2(g)+O2(g) 2SO3(g)达到了平衡,改变某一条件,发生 下述变化,其中可确定该平衡一定发生移动的是( )。 A.v(SO2)增大 B.v(SO3)减小 C.O2 的百分含量发生变化 D.SO3 的质量不变 答案:C 解析:若正、逆反应速率同等程度地增大或减小,仍然相等,平衡不移动;O2 的百分 含量发生变化,化学平衡一定发生移动;SO3 的质量不变,平衡不移动。 6.已知反应 2NO(g)+O2(g) 2NO2(g) ΔH<0,如图所示的曲线是其他条件一定 时,NO 的平衡转化率与温度的关系曲线。图中标有 A、B、C、D 四点,其中表示 未达到平衡状态,且 v 正>v 逆的点是( )。 A.A 点 B.B 点 C.C 点 D.D 点 答案:C 解析:坐标系的纵轴表示 NO 的平衡转化率,横轴表示温度,曲线上的任意一点表 示在该温度下达到平衡状态时对应的 NO 的转化率。C 点时 NO 的平衡转化率 比对应温度下的 NO 的平衡转化率小,因此需要转化更多的 NO,即 C 点未达到平 衡状态,且 v 正>v 逆。A 点表示未达到平衡状态,但 A 点时 NO 的平衡转化率比对 应温度下的 NO 的平衡转化率大,v 正<v 逆。B、D 点表示达到平衡状态。 7.一定条件下,生成物水蒸气含量随反应时间的变化趋势符合下图的是( )
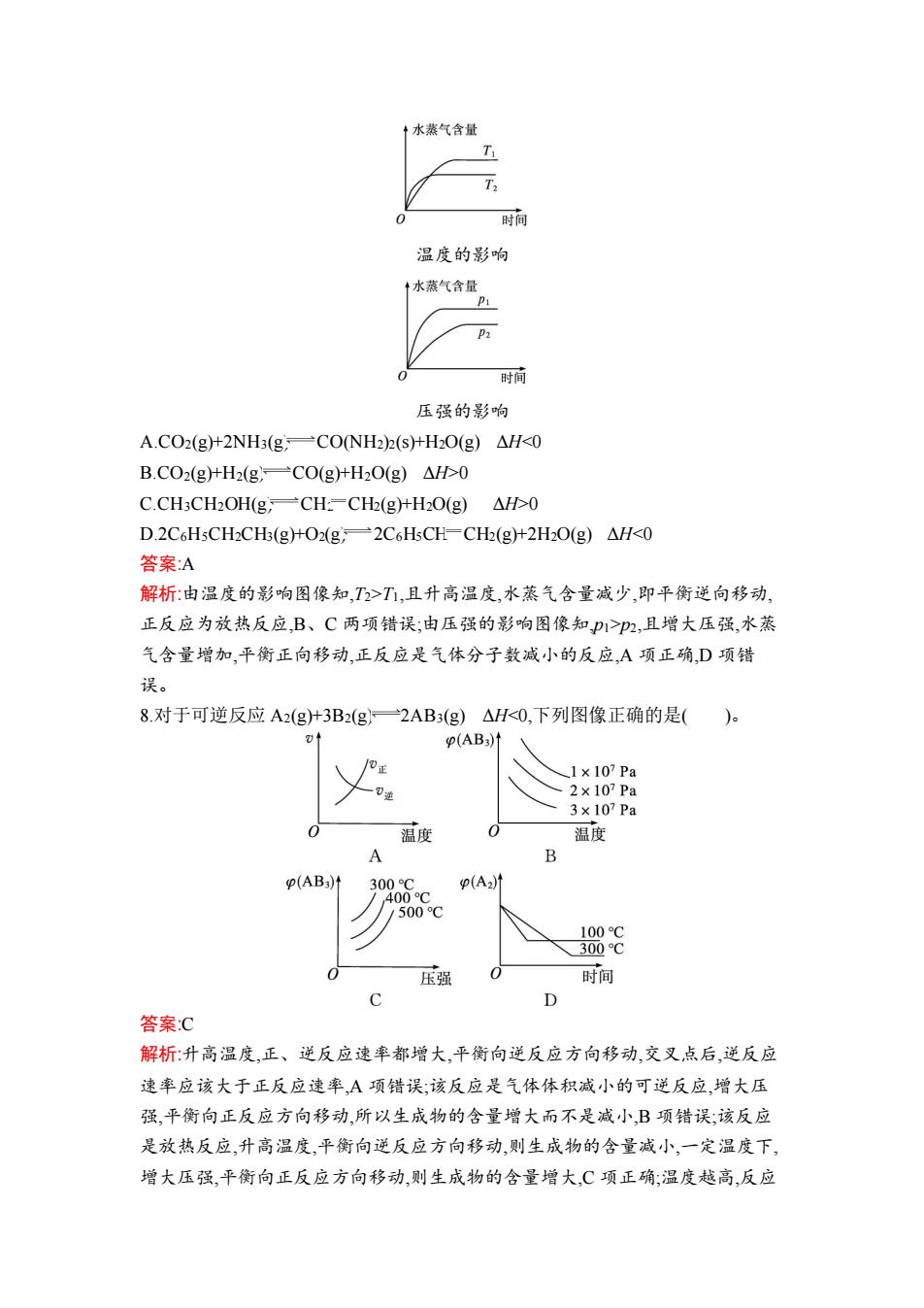
+水蒸气含量 T 时间 温度的影响 +水蒸气含量 时间 压强的影响 A.CO2(g+2NH3(g,一CONH2)2(s+HO(g)△H<0 B.CO2(g+H2(g一CO(g+H2O(g)△H0 C.CH3CH2OH(g,一CH=CH(g+H2O(g)△H0 D.2C6HsCH2CH3(g)+O2(g2C6HsCH-CH2(g)+2H2O(g)AH<0 答案:A 解析:由温度的影响图像知,T2>T,且升高温度,水蒸气含量减少,即平衡逆向移动, 正反应为放热反应,B、C两项错误;由压强的影响图像知,P1>p2,且增大压强,水蒸 气含量增加,平衡正向移动,正反应是气体分子数减小的反应,A项正确,D项错 误。 8对于可逆反应A2(g十3B2(g)一2AB3(g)△H<0,下列图像正确的是()。 (AB3)1 1×107Pa 2×107Pa 3×107Pa 温度 温度 B (AB3)t 300C p(A)计 400C 1500C 100C 300℃ 压强 时间 C D 答案:C 解析:升高温度,正、逆反应速率都增大,平衡向逆反应方向移动,交叉点后,逆反应 速率应该大于正反应速率,A项错误;该反应是气体体积减小的可逆反应,增大压 强,平衡向正反应方向移动,所以生成物的含量增大而不是减小,B项错误;该反应 是放热反应,升高温度,平衡向逆反应方向移动,则生成物的含量减小,一定温度下, 增大压强,平衡向正反应方向移动,则生成物的含量增大,C项正确:温度越高,反应
温度的影响 压强的影响 A.CO2(g)+2NH3(g) CO(NH2)2(s)+H2O(g) ΔH<0 B.CO2(g)+H2(g) CO(g)+H2O(g) ΔH>0 C.CH3CH2OH(g) CH2 CH2(g)+H2O(g) ΔH>0 D.2C6H5CH2CH3(g)+O2(g) 2C6H5CH CH2(g)+2H2O(g) ΔH<0 答案:A 解析:由温度的影响图像知,T2>T1,且升高温度,水蒸气含量减少,即平衡逆向移动, 正反应为放热反应,B、C 两项错误;由压强的影响图像知,p1>p2,且增大压强,水蒸 气含量增加,平衡正向移动,正反应是气体分子数减小的反应,A 项正确,D 项错 误。 8.对于可逆反应 A2(g)+3B2(g) 2AB3(g) ΔH<0,下列图像正确的是( )。 答案:C 解析:升高温度,正、逆反应速率都增大,平衡向逆反应方向移动,交叉点后,逆反应 速率应该大于正反应速率,A 项错误;该反应是气体体积减小的可逆反应,增大压 强,平衡向正反应方向移动,所以生成物的含量增大而不是减小,B 项错误;该反应 是放热反应,升高温度,平衡向逆反应方向移动,则生成物的含量减小,一定温度下, 增大压强,平衡向正反应方向移动,则生成物的含量增大,C 项正确;温度越高,反应

速率越大,则达到平衡所需时间越短,升高温度,平衡向逆反应方向移动,反应物的 含量增大,D项错误。 9.下列事实能用勒夏特列原理来解释的是() A.工业上制取SO3,通常需要使用催化剂:2SO2(g十O2(g,一2SO3(g) B.铁在潮湿的空气中容易生锈 C.减小容器的容积,H2、I2、HI平衡体系混合气体颜色变深:H2(g十H2(g,一2HI(g) D.实验室采用排饱和食盐水的方法收集氯气:C2+H2C一H+CI+HCIO 答案D 解析:催化剂不会使平衡发生移动,不能用勒夏特列原理解释,A项错误:铁生锈是 不可逆过程,不能用勒夏特列原理解释,B项错误;H2(g十H2(g,一2HI(g)反应后气体 体积不变,减小容器的容积,I2(g)浓度增大,气体颜色变深,但平衡不移动,不能用勒 夏特列原理解释,C项错误;氯气与水的反应是可逆反应,饱和氯化钠溶液中氯离 子浓度大,有利于化学平衡逆向移动,从而抑制氯气溶解,实验室用排饱和食盐水 的方法收集氯气,能用勒夏特列原理解释,D项正确。 10.在密闭容器中进行如下反应:CO2(g+C(s)一2CO(g)△H0,达到平衡后,若改 变下列条件,则指定物质的浓度及平衡如何变化。每小问中,第一个空填“正向移 动逆向移动”或“不移动”,第二个空填“增大减小”或“不变”。 (1)增加C(s),则平衡 ,c(CO2) (2)保持温度不变,缩小反应容器的容积,则平衡 ,c(CO2)】 (3)保持反应容器的容积和温度不变,通入N2,则平 衡 c(CO2) (4)保持反应容器的容积不变,升高温度,则平衡 cCO)】 答案(1)不移动不变(2)逆向移动增大 (3)不移动不变(4)正向移动增大 解析(1)C为固体,增加C的量,其浓度不变,平衡不移动,cC02)不变。 (2)缩小反应容器的容积,即增大压强,平衡向气体体积减小的方向移动,C(CO2)增 大。 (3)通入N2,但容积和温度不变,平衡不会发生移动,c(CO2)不变。 (4)容积不变,升高温度,平衡向吸热方向移动,c(C0)增大。 11.(1)工业上利用H2与C02合成二甲醚的反应为6H2(g十2C02(g CH3OCH3(g+3HO(g)△H<0:温度升高,反应达到新的平衡后,CH3OCH3的产率 将 (填“变大变小”或“不变,下同),混合气体的平均相对分子质量 将 (2)某科研小组欲研究在其他条件不变的情况下,改变起始氧气的物质的量对反应 4NO2(g+O2(g)一2N2O5(g)△H<0的影响
速率越大,则达到平衡所需时间越短,升高温度,平衡向逆反应方向移动,反应物的 含量增大,D 项错误。 9.下列事实能用勒夏特列原理来解释的是( )。 A.工业上制取 SO3,通常需要使用催化剂:2SO2(g)+O2(g) 2SO3(g) B.铁在潮湿的空气中容易生锈 C.减小容器的容积,H2、I2、HI 平衡体系混合气体颜色变深:H2(g)+I2(g) 2HI(g) D.实验室采用排饱和食盐水的方法收集氯气:Cl2+H2O H++Cl-+HClO 答案:D 解析:催化剂不会使平衡发生移动,不能用勒夏特列原理解释,A 项错误;铁生锈是 不可逆过程,不能用勒夏特列原理解释,B 项错误;H2(g)+I2(g) 2HI(g)反应后气体 体积不变,减小容器的容积,I2(g)浓度增大,气体颜色变深,但平衡不移动,不能用勒 夏特列原理解释,C 项错误;氯气与水的反应是可逆反应,饱和氯化钠溶液中氯离 子浓度大,有利于化学平衡逆向移动,从而抑制氯气溶解,实验室用排饱和食盐水 的方法收集氯气,能用勒夏特列原理解释,D 项正确。 10.在密闭容器中进行如下反应:CO2(g)+C(s) 2CO(g) ΔH>0,达到平衡后,若改 变下列条件,则指定物质的浓度及平衡如何变化。每小问中,第一个空填“正向移 动”“逆向移动”或“不移动”;第二个空填“增大”“减小”或“不变”。 (1)增加 C(s),则平衡 ,c(CO2) 。 (2)保持温度不变,缩小反应容器的容积,则平衡 ,c(CO2) 。 (3)保持反应容器的容积和温度不变,通入 N2,则平 衡 ,c(CO2) 。 (4)保持反应容器的容积不变,升高温度,则平衡 ,c(CO) 。 答案:(1)不移动 不变 (2)逆向移动 增大 (3)不移动 不变 (4)正向移动 增大 解析:(1)C 为固体,增加 C 的量,其浓度不变,平衡不移动,c(CO2)不变。 (2)缩小反应容器的容积,即增大压强,平衡向气体体积减小的方向移动,c(CO2)增 大。 (3)通入 N2,但容积和温度不变,平衡不会发生移动,c(CO2)不变。 (4)容积不变,升高温度,平衡向吸热方向移动,c(CO)增大。 11.(1)工业上利用 H2 与 CO2 合成二甲醚的反应为 6H2(g)+2CO2(g) CH3OCH3(g)+3H2O(g) ΔH<0;温度升高,反应达到新的平衡后,CH3OCH3的产率 将 (填“变大”“变小”或“不变”,下同),混合气体的平均相对分子质量 将 。 (2)某科研小组欲研究在其他条件不变的情况下,改变起始氧气的物质的量对反应 4NO2(g)+O2(g) 2N2O5(g) ΔH<0 的影响

平衡时N2O的百分含量 起始时n(O2) ①图像中T1和T2的关系是T (填><”或=”)T2。 ②比较A、B、C三点所处的平衡状态中,反应物NO2的转化率最大的 是 答案:(1)变小 变小 (2)①>②C 解析(1)正反应放热,升高温度,平衡向逆反应方向移动,二甲醚的产率变小。气体 的质量不变,物质的量增大,因此混合气体的平均相对分子质量将变小。 (2)①正反应是放热反应,升高温度,平衡向逆反应方向移动,生成物含量降低,所以 温度是T1>T2。 ②增加氧气的浓度,能增大NO2的转化率,所以反应物NO2的转化率最大的是C 点。 拓展提高 1.在一密闭容器中进行以下可逆反应:M(g)十N(g)P(g十2L(?)。在不同的条件下 P的质量分数的变化情况如图,则该反应( WP)◆ I20C、200kPa 50℃、200kPa 50"℃、600kPa A.正反应放热,L是固体 B.正反应放热,L是气体 C.正反应吸热,L是气体 D.正反应放热,L是固体或气体 答案B 解析:依据图像分析,相同条件下,先拐先平温度高,压强大,依据I、Ⅱ可知温度越 高w(P)越小,说明升温平衡逆向移动,正反应为放热反应。结合Ⅱ、Ⅲ,压强越 大,w(P)越小,说明增大压强平衡逆向移动,增大压强平衡向体积减小的方向移动, 则L为气体。 2.在密闭容器中的一定量混合气体发生反应xA(g)十B(g)C(g),达到平衡时,测 得A的浓度为0.5olLl,在温度不变的条件下,将容器的容积扩大到原来的两
①图像中 T1 和 T2 的关系是 T1 (填“>”“<”或“=”)T2。 ②比较 A、B、C 三点所处的平衡状态中,反应物 NO2 的转化率最大的 是 。 答案:(1)变小 变小 (2)①> ②C 解析:(1)正反应放热,升高温度,平衡向逆反应方向移动,二甲醚的产率变小。气体 的质量不变,物质的量增大,因此混合气体的平均相对分子质量将变小。 (2)①正反应是放热反应,升高温度,平衡向逆反应方向移动,生成物含量降低,所以 温度是 T1>T2。 ②增加氧气的浓度,能增大 NO2 的转化率,所以反应物 NO2的转化率最大的是 C 点。 拓展提高 1.在一密闭容器中进行以下可逆反应:M(g)+N(g) P(g)+2L(?)。在不同的条件下 P 的质量分数的变化情况如图,则该反应( )。 A.正反应放热,L 是固体 B.正反应放热,L 是气体 C.正反应吸热,L 是气体 D.正反应放热,L 是固体或气体 答案:B 解析:依据图像分析,相同条件下,先拐先平温度高,压强大,依据Ⅰ、Ⅱ可知温度越 高 w(P)越小,说明升温平衡逆向移动,正反应为放热反应。结合Ⅱ、Ⅲ,压强越 大,w(P)越小,说明增大压强平衡逆向移动,增大压强平衡向体积减小的方向移动, 则 L 为气体。 2.在密闭容器中的一定量混合气体发生反应:xA(g)+yB(g) zC(g),达到平衡时,测 得 A 的浓度为 0.5 mol·L -1 ,在温度不变的条件下,将容器的容积扩大到原来的两