
第八章原子结构 1.屏蔽效应 安原子核从只有1个由子,这个由子仅受到原子核的作用。句原子的波动 程可精确求解。但是在多电子原子中,每 一个由子不仅到 带Z个电荷的原子 的吸引,而且还受到(亿-)个电子的排斥。故至今尚未能对除氢原子或类氢原手 以外的微观粒子运动方程精确求解,因此对多电子原子系统是采取近似的方法 在多电子原子中,核电荷对某个电子的吸引力,因其它电子对该电子的排 后而被到弱的作用称为屏被效应 7,=7 01 其中乙'是有效核电荷数。σ:为屏蔽常数 G就是电子1受其他电子排斥而在核的吸引上要把核的正电荷扣除的部分。 2.钻穿效应 由图8-4中可知不同电子在离核r处球面上出现的概率大小不同。对于较大 的电子(例如3s,3即电子),出现概率最大的地方离核较远,但在离核较近的地 方有小峰,表明在离核较近的地方电子也有出现的可能.也就是说外层电子可 能钻到内层出现在离核较近的地方,这种现象叫做钻穿效应 3d 图8-44s,3d电子云的径向分布图 二.核外电子排布原理 根据光谱实验数据以及对元素性质周期律的分析,归纳出多电子原子中的 电子在核外的排布应遵从以下三条原则,即泡利(Pauli)不相容原理、能量最低 原理和洪特(und)规则。 1.泡利不相容原理 泡利指出:在同一原子中不可能有四个量子数完全相同的2个电子同时存 在,称为泡利不相容原理。换言之,每一种运动状态的电于只能有1个,在同 轨道上最多只能 纳自旋方向相反的2 个电于 。由于每个电子层中原子轨道 的总数是n2个,因此各电子层中电子的最大容量是2n个。 2.能量最低原理 在不违背泡利不相容原理的前提下电子在个轨道上的排布方式应使整个原 子能量处于最低状态,即多电子原子在基态时核外电子总是尽可能地先占据能 量最低的轨道,称为能量最低原理 3.洪特规则 电子在能量相同的轨道(即等价轨道)上排布时,总是尽可能以自旋相同的 方向分占不同的轨道,因为这样的排布方式总能量最低,称为洪特规则。 洪特规则特例:对于同一电子亚层,当电子分布为半充满(’、°、)、全 态0、少和全空(、时,电子云分布是球子结酸
第八章原子结构 105 1.屏蔽效应 氢原子核外只有1个电子,这个电子仅受到原子核的作用,氢原子的波动方 程可精确求解。但是在多电子原子中,每一个电子不仅受到带Z个电荷的原子核 的吸引,而且还受到(Z-1)个电子的排斥。故至今尚未能对除氢原子或类氢原子 以外的微观粒子运动方程精确求解,因此对多电子原子系统是采取近似的方法。 在多电子原子中,核电荷对某个电子的吸引力,因其它电子对该电子的排 斥而被削弱的作用称为屏蔽效应 令 Z’=Z - i,其中Z’是有效核电荷数。i 为屏蔽常数。 i 就是电子i受其他电子排斥而在核的吸引上要把核的正电荷扣除的部分。 2.钻穿效应 由图8-4中可知不同电子在离核r处球面上出现的概率大小不同。对于n较大 的电子(例如3s,3p电子),出现概率最大的地方离核较远,但在离核较近的地 方有小峰,表明在离核较近的地方电子也有出现的可能.也就是说外层电子可 能钻到内层出现在离核较近的地方,这种现象叫做钻穿效应。 图8-4 4s,3d电子云的径向分布图 二. 核外电子排布原理 根据光谱实验数据以及对元素性质周期律的分析,归纳出多电子原子中的 电子在核外的排布应遵从以下三条原则,即泡利(Pauli)不相容原理、能量最低 原理和洪特(Hund)规则。 1.泡利不相容原理 泡利指出:在同一原子中不可能有四个量子数完全相同的 2 个电子同时存 在,称为泡利不相容原理。换言之,每一种运动状态的电于只能有 1 个,在同 一轨道上最多只能容纳自旋方向相反的 2 个电子。由于每个电子层中原子轨道 的总数是 n 2个,因此各电子层中电子的最大容量是 2n2个。 2.能量最低原理 在不违背泡利不相容原理的前提下电子在个轨道上的排布方式应使整个原 子能量处于最低状态,即多电子原子在基态时核外电子总是尽可能地先占据能 量最低的轨道,称为能量最低原理。 3.洪特规则 电子在能量相同的轨道(即等价轨道)上排布时,总是尽可能以自旋相同的 方向分占不同的轨道,因为这样的排布方式总能量最低,称为洪特规则。 洪特规则特例:对于同一电子亚层,当电子分布为半充满(p 3、d 5、f 7)、全 充满(p 6、d 10、f 1 4)和全空(p 0、d 0、f 0)时,电子云分布呈球状,原子结构较 稳定
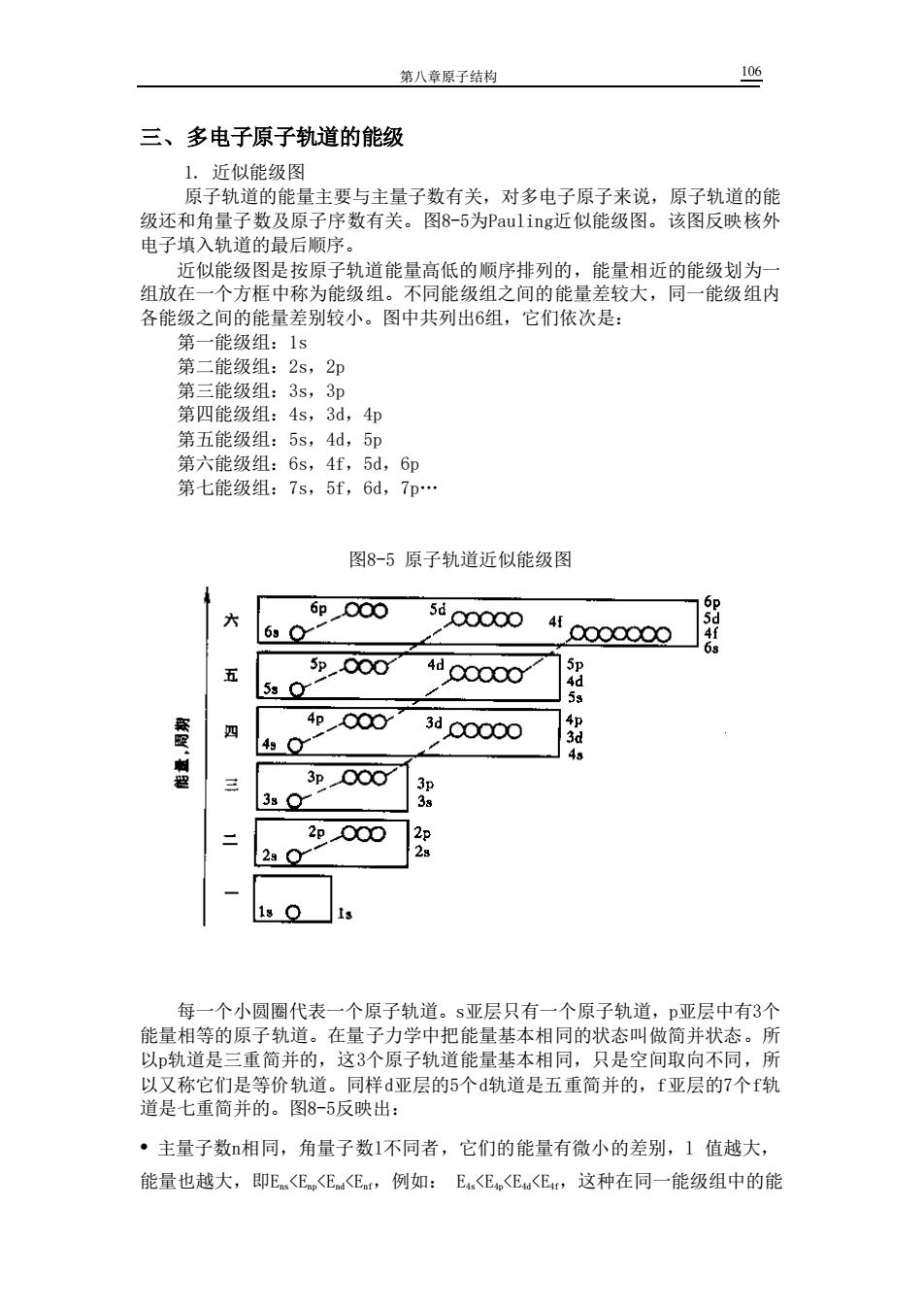
第八章原子结构 106 三、多电子原子轨道的能级 近似能级图 原 轨道的能量主要与主量子数有关,对多电子原子来说,原子轨道的能 级还和角量子数及原子序数有关。图8-5为Paulingi近似能级图。该图反映核匀 电子填入轨道的最后顺序。 近似能级图是按原子轨道能量高低的顺序排列的,能量相近的能级划为 组放在一个方框中称为能级组。不同能级组之间的能量差较大,同一能级组内 各能级之间的能量差别较小。图中共列出6组 它们依次是 第一能级组:1s 第二能级组:2s,2p 第三能级组:35,3p 第四能级组:4s,3d,4p 第五能级组:5s,4d,5 第六能级组 65,4f,5d,6p 第七能级组:7s,5f,6d,7p. 图8-5原子轨道近似能级图 6p00∞ 6g● 5d00000 4f0000000 6 5p,Q00 4d00000 5s or 四 4p00 4s O 3d00000 三 3p000 3s o 阳 p000 2g0y1 1s O 1s 每一个小圆圈代表一个原子轨道。s亚层只有一个原子轨道,p亚层中有3个 能量相等的原子轨道。在量子力学中把能量基本相同的状态叫做简并状态。所 以轨道是三重简并的,这3个原子轨道能量基本相同,只是空间取向不同,所 ·主量子数相同,角量子数1不同者,它们的能量有微小的差别,1值越大, 能量也越大,即E<E<E<E,例如:E<E<Eu<EH,这种在同一能级组中的能
第八章原子结构 106 三、多电子原子轨道的能级 1. 近似能级图 原子轨道的能量主要与主量子数有关,对多电子原子来说,原子轨道的能 级还和角量子数及原子序数有关。图8-5为Pauling近似能级图。该图反映核外 电子填入轨道的最后顺序。 近似能级图是按原子轨道能量高低的顺序排列的,能量相近的能级划为一 组放在一个方框中称为能级组。不同能级组之间的能量差较大,同一能级组内 各能级之间的能量差别较小。图中共列出6组,它们依次是: 第一能级组:1s 第二能级组:2s,2p 第三能级组:3s,3p 第四能级组:4s,3d,4p 第五能级组:5s,4d,5p 第六能级组:6s,4f,5d,6p 第七能级组:7s,5f,6d,7p. 图8-5 原子轨道近似能级图 每一个小圆圈代表一个原子轨道。s亚层只有一个原子轨道,p亚层中有3个 能量相等的原子轨道。在量子力学中把能量基本相同的状态叫做简并状态。所 以p轨道是三重简并的,这3个原子轨道能量基本相同,只是空间取向不同,所 以又称它们是等价轨道。同样d亚层的5个d轨道是五重简并的,f亚层的7个f轨 道是七重简并的。图8-5反映出: • 主量子数n相同,角量子数l不同者,它们的能量有微小的差别,l 值越大, 能量也越大,即Ens<Enp<End<Enf,例如: E4s<E4p<E4d<E4f,这种在同一能级组中的能