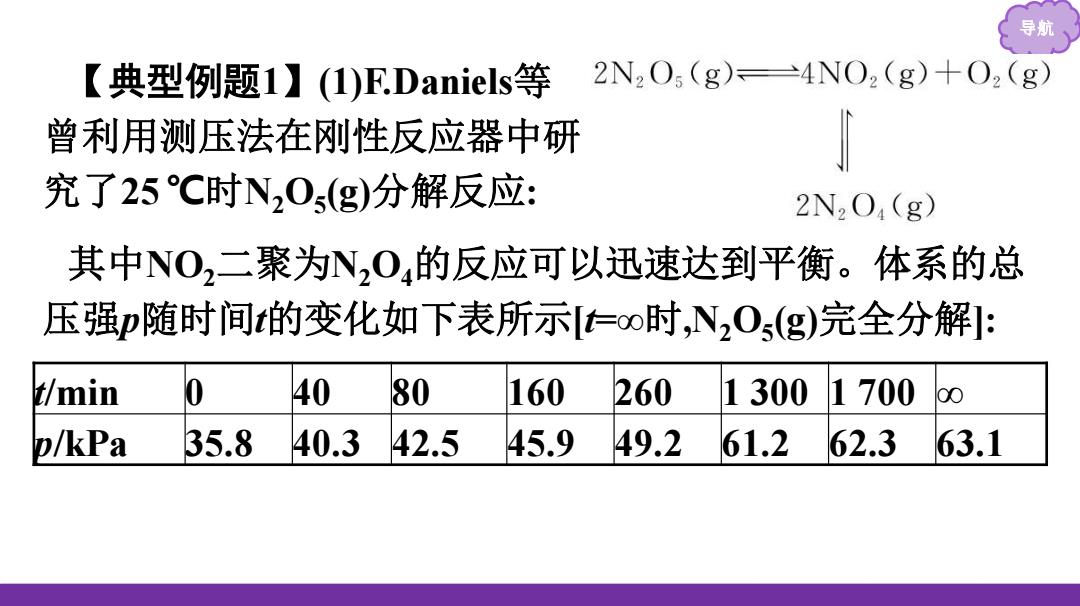
导月 【典型例题1】(1)F.Daniels等 2N2O5(g)=4NO2(g)+O2(g) 曾利用测压法在刚性反应器中研 究了25C时N20s(g)分解反应: 2N2O4(g) 其中NO2二聚为N2O4的反应可以迅速达到平衡。体系的总 压强p随时间t的变化如下表所示仁oo时,N0s(g)完全分解: t/min 40 80 160 260 1300 1700 00 p/kPa 35.8 40.3 42.5 45.9 49.2 61.2 62.3 63.1
导航 【典型例题1】(1)F.Daniels等 曾利用测压法在刚性反应器中研 究了25 ℃时N2O5 (g)分解反应: 其中NO2二聚为N2O4的反应可以迅速达到平衡。体系的总 压强p随时间t的变化如下表所示[t=∞时,N2O5 (g)完全分解]: t/min 0 40 80 160 260 1 300 1 700 ∞ p/kPa 35.8 40.3 42.5 45.9 49.2 61.2 62.3 63.1

导期 ①已知:2N20s(g)2N204(g)+02(g)△H1=-4.4kJmo1 2N02(g)=N204(g)H2=-55.3kJmo1 则反应N20s(g)→2NO2(g)+202(g)的H=_一 kJ.mol-1。 ②研究表明,N20s(g)分解的反应速率=2×103×pN20(kPa minl),=62min时,测得体系中po2=2.9kPa,则此时的pN20s= kPa,= _kPa'min-l
导航 ①已知:2N2O5(g) 2N2O4(g)+O2(g) ΔH1=-4.4 kJ·mol-1 2NO2(g) N2O4(g) ΔH2=-55.3 kJ·mol-1 则反应 N2O5(g) 2NO2(g)+𝟏 𝟐 O2(g)的 ΔH= kJ·mol-1 。 ②研究表明,N2O5(g)分解的反应速率 v=2×10-3 ×𝒑𝐍𝟐 𝐎𝟓 (kPa· min-1 ),t=62 min 时,测得体系中𝒑𝐎𝟐 =2.9 kPa,则此时的𝒑𝐍𝟐 𝐎𝟓 = kPa,v= kPa·min-1

导 ③若提高反应温度至35℃,则N,0sg)完全分解后体系压强 p(35C) (填“大于”“等于”或“小于)63.1kPa,原因 是 ④25C时N204(g)一2NO2(g)反应的平衡常数K。一(K, 为以分压表示的平衡常数,计算结果保留1位小数)
导航 ③若提高反应温度至35 ℃,则N2O5 (g)完全分解后体系压强 p∞ (35 ℃) (填“大于”“等于”或“小于”)63.1 kPa,原因 是 。 ④25 ℃时N2O4 (g) 2NO2 (g)反应的平衡常数Kp = (Kp 为以分压表示的平衡常数,计算结果保留1位小数)

导航 (2)对于反应2N20s(g)→4NO2(g)+O2(g),有人提出如下反应 历程: 第一步:N205=NO2+NO3快速平衡 第二步:NO2+NO3→NO+NO2+O2慢反应 第三步:NO+NO32NO2快反应
导航 (2)对于反应2N2O5 (g)→4NO2 (g)+O2 (g),有人提出如下反应 历程: 第一步:N2O5 NO2+NO3 快速平衡 第二步:NO2+NO3 NO+NO2+O2 慢反应 第三步:NO+NO3 2NO2 快反应

其中可近似地认为第二步反应不影响第一步的平衡。下列 表述正确的是 填字母)。 A.(第一步的逆反应)>y(第二步反应) B.反应的中间产物只有NO3 C第二步中NO2与NO3的碰撞仅部分有效 D第三步反应活化能较高
导航 其中可近似地认为第二步反应不影响第一步的平衡。下列 表述正确的是 (填字母)。 A.v(第一步的逆反应)>v(第二步反应) B.反应的中间产物只有NO3 C.第二步中NO2与NO3的碰撞仅部分有效 D.第三步反应活化能较高