
全程设计 章末核心素养整合
章末核心素养整合

知识体系构建 专题归纳突破
知识体系构建 专题归纳突破
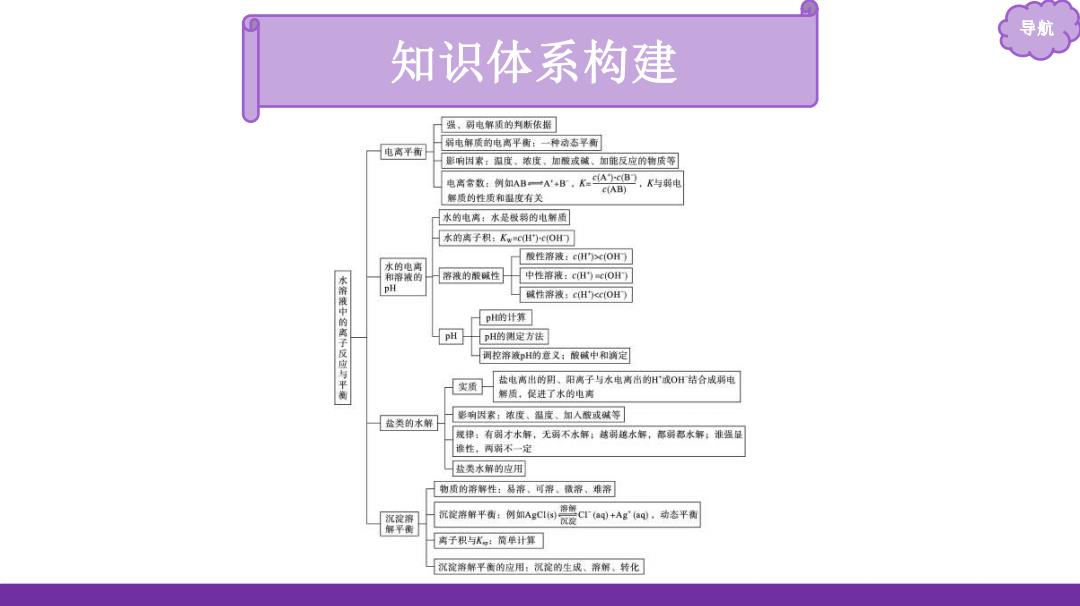
导航 知识体系构建 强。弱电解质的判新依据 粥电解质的电离平衡:一种右早新 电离平面 影响国素:阻度。浓度。加酸成碱、如能反应的物质等 电离含数:例如AB一A4B,KcB,K与转电 C(AB) 解质的性质和湿度有关 水的电离:水是做彩的电解质 水的离子积:KwcH)CO门 酸性溶液:cHC(OH门 水的电离 和溶液的 容液的酸碱性 中性溶液:cHc(OH门 PH 水溶液中的离子反应与平衡 碱性溶液:cH<cOH) p的计算 PH H的测定方法 词控溶液即H的意义:酸碱中和满定 实质 盐电离出的阴。阳离子与水电离雷的H或OH结合成斯电 解质,促进了水的电离 影响因索:浓度、温度、加入酸或碱等 盐类的水解 规律:有弱才水解,无弱不水解:感弱越水解,都明都水解:淮强显 谁性,两瑞不一定 盐类水解的应川 物质的溶解性:易溶、可溶。藏溶、堆溶 沉淀将解平黄:例如AgC警CTa0+Areo。动态平内 离子积与术。:简单计算 沉淀溶解平衡的应用:沉淀的生成、帝解。转化
导航 知识体系构建

导航 专题归纳突破 专题一溶液中水的电离分析 1水电离出的c水(H)或c水(OH)的计算(常温下)。 (I)c水(OH)和c水(H)的关系。 由H,0一H+O可知,不论何种温度,何种溶液,由H,0电 离的c水(O)和c水(H)永远相等。 (2)pH的意义。 pH=-gc溶液(H),所以由pH=可以直接推出溶液中c溶液 H)=10-amoL1
导航 专题一 溶液中水的电离分析 1.水电离出的c水(H+ )或c水(OH- )的计算(常温下)。 (1)c水(OH- )和c水(H+ )的关系。 由H2O H++OH-可知,不论何种温度,何种溶液,由H2O电 离的c水(OH- )和c水(H+ )永远相等。 (2)pH的意义。 pH=-lgc溶液(H+ ),所以由pH=a可以直接推出溶液中c溶液 (H+ )=10-a mol·L-1 。 专题归纳突破

导航 (3)理清来源及等量关系。 C溶液(H)=C酸(H+)+C水(H+) ①酸溶液 (C溶液(OH)=C水(OH) 如常温下,pH=1的CH3COOH溶液中,溶液中的H+来源于 CH3COOH的电离和水的电离;而溶液中的O全部来自水的电 离,所以cH)-eOH-eO)时 Kw = 10-14 -10-1 mol.L-1 =1013moL1
导航 (3)理清来源及等量关系 。 ①酸溶液 𝒄 溶液(𝐇 +) = 𝒄酸(𝐇 +) + 𝒄 水(𝐇 +) 𝒄 溶液(𝐎 𝐇-) = 𝒄 水(𝐎 𝐇-) 如常温下,pH=1 的 CH 3COOH 溶液中,溶液中的 H + 来源于 CH 3COOH 的电离和水的电离;而溶液中的 OH- 全部来自水的电 离,所以 c 水(H + )=c 水(OH- )=c 溶液(OH- )= 𝑲 𝐖 𝒄 溶 液(𝐇 +) = 𝟏 𝟎-𝟏 𝟒 𝟏 𝟎-𝟏 mol·L-1 =10-13 mol·L-1