
全程设计 章末核心素养整合
章末核心素养整合

知识体系构建 专题归纳突破
知识体系构建 专题归纳突破
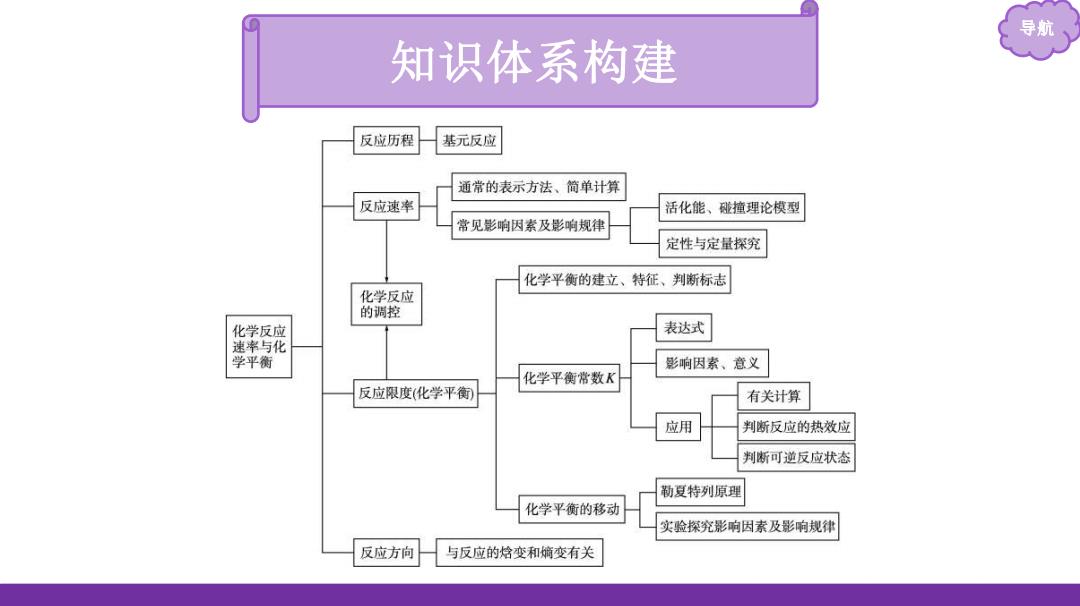
导航 知识体系构建 反应历程 基元反应 通常的表示方法、简单计算 反应速率 活化能、碰撞理论模型 常见影响因素及影响规律 定性与定量探究 化学平衡的建立、特征、判断标志 化学反应 的调控 化学反应 表达式 速率与化 学平衡 影响因索、意义 化学平衡常数K 反应限度(化学平衡 有关计算 应用 判断反应的热效应 判断可逆反应状态 勒夏特列原理 化学平衡的移动 实验探究影响因素及影响规律 反应方向 与反应的焓变和嫡变有关
导航 知识体系构建

导航 专题归纳突破 专题一化学反应速率与平衡常数的计算模板 1.基本模式。 mA(g)+nB(g)pC(g) 起始浓度 L b C (molL-1) 变化浓度 X (molL-1) 器 px m 平衡浓度 nx a-X b c+ (molL-1) m m
导航 专题一 化学反应速率与平衡常数的计算模板 1.基本模式。 mA(g)+nB(g) pC(g) 起始浓度 (𝐦𝐨𝐥·𝐋 -𝟏) a b c 变化浓度 (𝐦𝐨𝐥·𝐋 -𝟏) x 𝒏𝒙 𝒎 𝒑𝒙 𝒎 平衡浓度 (𝐦𝐨𝐥·𝐋 -𝟏) a-x b- 𝒏𝒙 𝒎 c+𝒑𝒙 𝒎 专题归纳突破

导航 2.几个公式。 c (1)化学反应速率:= △n △t V△t (2)反应物转化率 c(Ax100%。 c(A)原 nC平x100%。 3)平衡时的体积分数p(C总学 (4)平衡常数K= cP(C) cm(A)-cn(B)
导航 2.几个公式 。 (1)化学反应速率:v= 𝚫 𝒄 𝚫𝒕 = 𝚫 𝒏 𝑽·𝚫𝒕。 (2)反应物转化率:𝚫 𝒄(𝐀) 𝒄(𝐀)原 ×100%。 (3)平衡时的体积分数 φ(C)= 𝒏(𝐂)平 𝒏(总)平 ×100%。 (4)平衡常数 K= 𝒄 𝒑(𝐂) 𝒄𝒎(𝐀)·𝒄𝒏(𝐁)