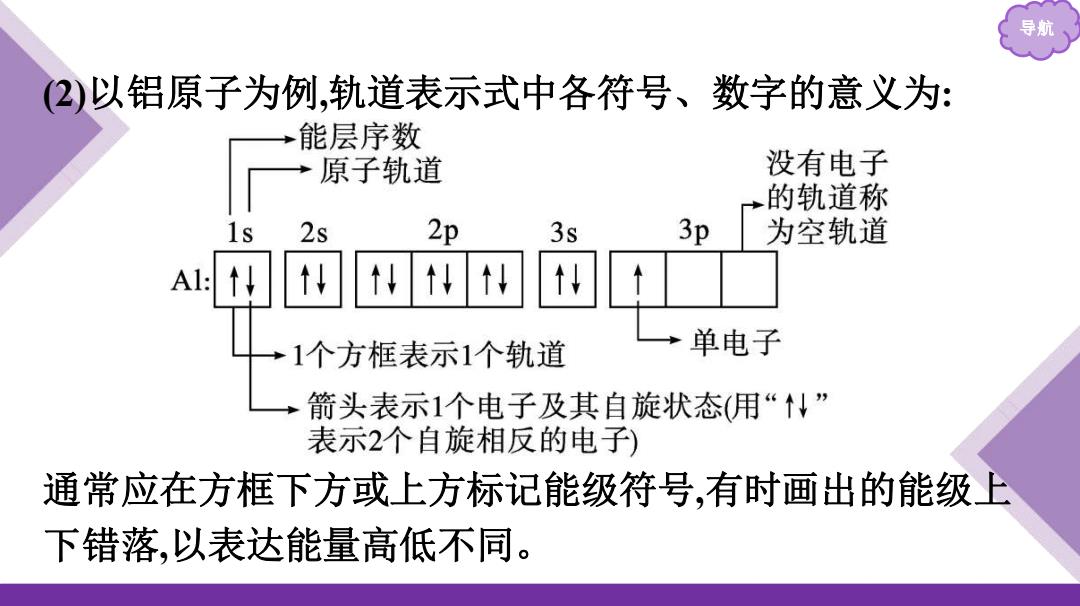
导 2)以铝原子为例,轨道表示式中各符号、数字的意义为: →能层序数 原子轨道 没有电子 的轨道称 2s 2p 3s 3p 为空轨道 t4儿t 1个方框表示1个轨道 单电子 箭头表示1个电子及其自旋状态(用“↓” 表示2个自旋相反的电子) 通常应在方框下方或上方标记能级符号,有时画出的能级上 下错落,以表达能量高低不同
导航 (2)以铝原子为例,轨道表示式中各符号、数字的意义为: 通常应在方框下方或上方标记能级符号,有时画出的能级上 下错落,以表达能量高低不同

导期 3洪特规则。 ()内容:基态原子中,填入简并轨道的电子总是先单独分占,且 自旋 (2)洪特规则不仅适用于基态原子,也适用于基态离子。 特别提醒洪特规则是针对电子填入简并轨道而言的,并不适 用于电子填入能量不同的轨道
导航 3.洪特规则。 (1)内容:基态原子中,填入简并轨道的电子总是先单独分占,且 自旋 平行 。 (2)洪特规则不仅适用于基态原子,也适用于基态离子。 特别提醒 洪特规则是针对电子填入简并轨道而言的,并不适 用于电子填入能量不同的轨道

导 4.能量最低原理 ()内容:在构建基态原子时,电子将尽可能地占据能量 的原子轨道,使整个原子的能量最低。 (2)整个原子的能量由 和 三个因素共同决定,相邻能级能量相差很大时,电子填 入能量低的能级即可使整个原子能量最低(如所有族 元素的基态原子);而当相邻能级能量相差不太大时,有1~2个 电子占据能量稍高的能级可能反而降低了电子排斥能而使整 个原子能量最低(如所有 族元素的基态原子)
导航 4.能量最低原理。 (1)内容:在构建基态原子时,电子将尽可能地占据能量 最低 的原子轨道,使整个原子的能量最低。 (2)整个原子的能量由 核电荷数 、 电子数 和 电子 状态 三个因素共同决定,相邻能级能量相差很大时,电子填 入能量低的能级即可使整个原子能量最低(如所有 主 族 元素的基态原子);而当相邻能级能量相差不太大时,有1~2个 电子占据能量稍高的能级可能反而降低了电子排斥能而使整 个原子能量最低(如所有 副 族元素的基态原子)

导航 预习检测 1.判断正误,正确的画“√,错误的画“义”。 (1)电子云中的小点代表电子在此空间出现的次数。(×) (2)s电子电子云的形状为圆形。(X) (3)3p表示3p能级有两个轨道。(×) (4)核外电子排布的表示方法中,轨道表示式最能反映电子的 排布情况。(√)
导航 预习检测 1.判断正误,正确的画“√”,错误的画“×” 。 (1)电子云中的小点代表电子在此空间出现的次数。( ) (2)s电子电子云的形状为圆形。( ) (3)3p2表示3p能级有两个轨道。( ) (4)核外电子排布的表示方法中,轨道表示式最能反映电子的 排布情况。( ) ✖ ✖ ✖ ✔

导 2.下列关于电子云的说法中正确的是( A.电子云表示电子在原子核外运动的轨迹 B.电子云表示处于一定空间运动状态的电子在核外空间出现 的概率密度分布 C.电子云图中的小点越密,表示核外空间的电子越多 D.钠原子的1s、2s、3s电子云半径相同 答案:B
导航 2.下列关于电子云的说法中正确的是( )。 A.电子云表示电子在原子核外运动的轨迹 B.电子云表示处于一定空间运动状态的电子在核外空间出现 的概率密度分布 C.电子云图中的小点越密,表示核外空间的电子越多 D.钠原子的1s、2s、3s电子云半径相同 答案:B