
14.3酰基碳上的亲核取代反应 603 carbon)上的亲核取代反应 此类亲核取代可以在碱催化的条件下进行。碱催化下的反应机理如下所示: 0 R-CY+B→ -R-C-B+:Y 四面体中间体 反应分两步进行,首先是亲核试剂在羰基碳上发生亲核加成,形成四面体中间体(tetrahedral in- termediate),然后再消除一个负离子,总的结果是取代。由于第一步反应是亲核加成,而形成的 是一个带负电荷的四面体中间体,因此原料中羰基碳的正电性越大,其周围的空间位阻越少,越 有利于反应的进行。第二步消除反应决定于离去基团的性质,越易离去的基团,反应越易发生。 在羧酸衍生物中,基团离去能力的次序是 I>Br>CI>-OCOOR>-OR>-OH>-NH, 此类亲核取代反应也可以在酸催化下进行,酸催化下的反应机理表述如下: COH R6-+一Ry -RCB +H:Y 首先是羰基氧的质子化(protonation)。羧酸衍生物的羰基氧具有碱性,酸的作用就是通过羰基 氧的质子化,使氧带有正电荷,从而吸引羰基碳上的电子,使碳更具正电性。接着,亲核试剂对活 化的羰基进行亲核加成,得到四面体中间体。最后发生消除反应生成产物。 绝大多数羧酸衍生物,是按上述机理进行亲核取代反应的。综合亲核加成及消除二步,不管 是酸催化还是碱催化的机理,羧酸衍生物亲核取代的反应性顺序是: 0 R人≈R人Br>R人 0人R>R人OR≈R人OH>R人NH,≈RC=N 习题14一根据下面提供的数据,将下列化合物按碱性强弱排列成序,并通过对其结构的分析来明 排序的合理性。 0 0 0 0 化合物 CH,人NH,CH,人OHCH,人OC,H,CH,人CH,CH,人HCH,人CI 共轭酸的pK, .61 -6.5 -7.2 ≈一8 一9
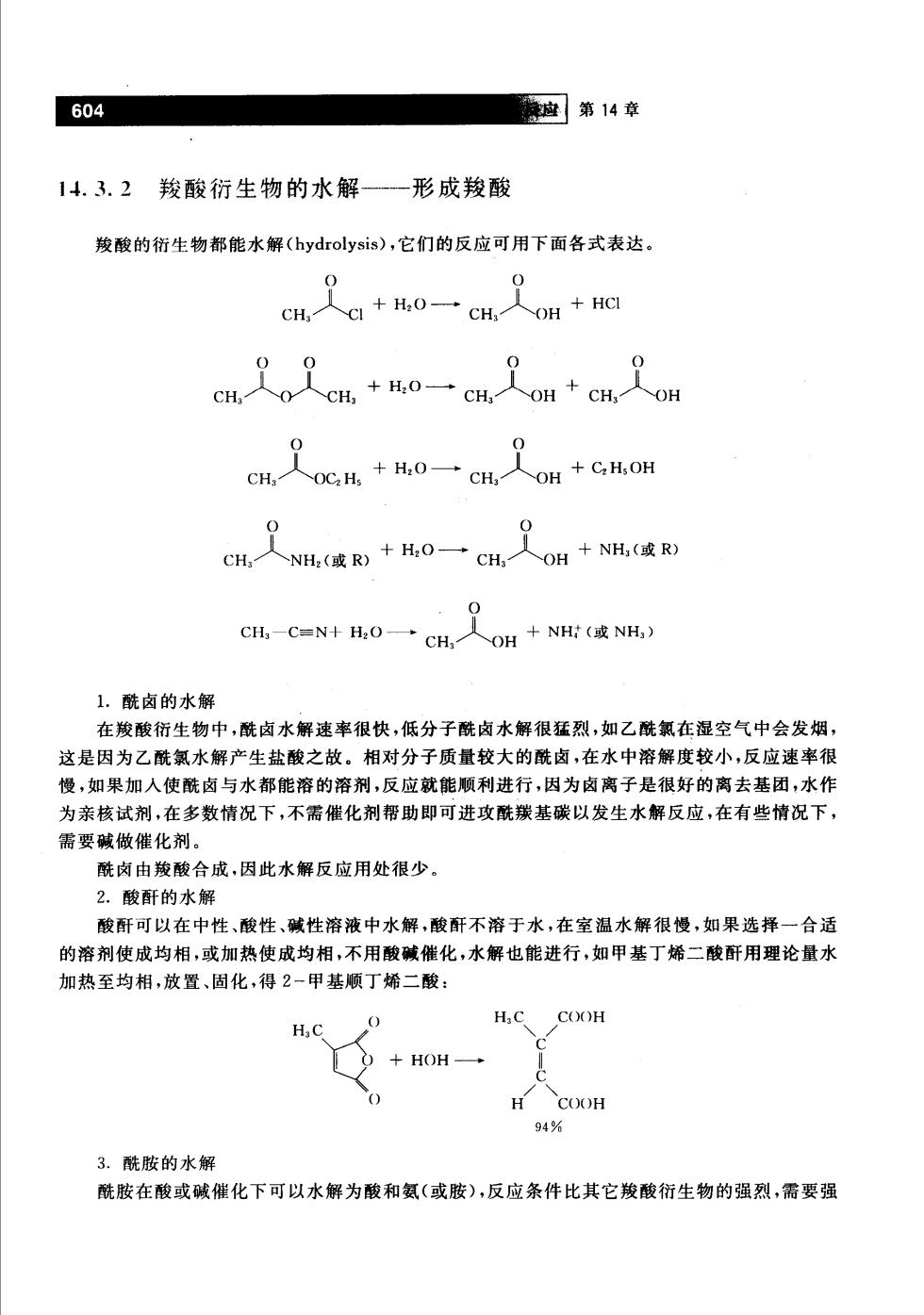
604 应第14章 14.3.2羧酸衍生物的水解一形成羧酸 羧酸的衍生物都能水解(hydrolysis),它们的反应可用下面各式表达。 0 cH,人a+H0一cH人OH+HC cH人0C,H+H0一cH,人OH+cH,oH 0 cH,人NH,(或R)+H,0一cH,人OH+NH,政R) CH-C=N+O一cH,人oH+NH:波NH 1.酰卤的水解 在羧酸衍生物中,酰卤水解速率很快,低分子酰卤水解很猛烈,如乙酰氯在湿空气中会发烟, 这是因为乙酰氯水解产生盐酸之故。相对分子质量较大的酰卤,在水中溶解度较小,反应速率很 慢,如果加入使酰卤与水都能溶的溶剂,反应就能顺利进行,因为卤离子是很好的离去基团,水作 为亲核试剂,在多数情况下,不需催化剂帮助即可进攻酰羰基碳以发生水解反应,在有些情况下, 需要碱做催化剂。 酰卤由羧酸合成,因此水解反应用处很少。 2。酸酐的水解 酸酐可以在中性、酸性、碱性溶液中水解,酸酐不溶于水,在室温水解很慢,如果选择一合适 的溶剂使成均相,或加热使成均相,不用酸碱催化,水解也能进行,如甲基丁烯二酸酐用理论量水 加热至均相,放置、固化,得2-甲基顺丁烯二酸: HC C(XH +HOH- 94% 3.酰胺的水解 酰胺在酸或碱催化下可以水解为酸和氨(或胺),反应条件比其它羧酸衍生物的强烈,需要强

14.3酰基碳上的亲核取代反应 605 酸或强碱以及比较长时间的加热回流: Ph人NH:一可流 OH NH:CI 80% Hc0-NHeekoH.o.Hco-一NH,+H0+K 回流 NO 酸催化时,酸的作用除使酰胺的羰基质子化外,还可以中和平衡体系中产生的氨或胺,使它们成 为铵盐,这样可使平衡向水解方向移动。碱催化是OH量进攻羰基碳,同时将形成的羧酸中和 成盐。 这个反应与酯一样,亦可用于鉴定酰胺,即通过酰胺水解,根据所得羧酸及氨(或胺),来判断 酰胺的结构。 有些酰胺有空间位阻,较难水解,如果用亚硝酸处理,可以在室温水解得到羧酸,产率较高: 0 35℃ OH 80% 反应过程首先由HONO中的N0与一NH2反应得一N=N(参看17.8/1,18.8.1),然后N:离 去,酰基正离子与H,O结合,再失去质子得羧酸: 4。腈的水解 腈在酸或碱作用下加热,可水解为羧酸(参看14.3.2)。酰胺加一分子水成为羧酸的铵盐 失一分子水即变为腈,它们之间的关系为 -H09 RCOONH,0R又NH0aON 小心控制反应条件,可使腈水解为酰胺 5.酯的水解 酯水解产生一分子羧酸和一分子醇 0 这是酯化反应的逆反应,因此酯水解反应最后也达到平衡。酯的水解比酰氯、酸酐困难,故需要

606 羧酸衍生物酰基碳上的亲核取代反应第14章 酸或碱催化,一般常用碱作催化剂,因为O■是较强的亲核试剂,容易与酯羰基碳发生亲核反 应,而且产生的酸可以与碱作用生成盐,有利于平衡反应的正向移动。因此碱催化时,碱的用量 要比1mol多,碱实际上不仅是催化剂,也是试剂。 6。酯水解的反应机理 酰卤、酸酐、酯、酰胺的水解、醇解、氨(胺)解的反应机理很多是类似的,对酯水解的反应机理 研究得比较深入,故用它加以说明,其它类推。 (1)酯的碱性水解机理酯可以在碱催化作用下发生水解生成羧酸盐和醇 CH,COOC:H,+NaOH-CH,COONa C:H,OH 油脂在碱性条件下水解,生成脂肪酸(fatty acid)的钠(或钾)盐及甘油。日常用的肥皂就是高级 脂肪酸的钠盐(参见14.l5.4),所以油脂的碱性水解也称为皂化反应(saponification). 酯的碱性水解是通过亲核加成一消除机理(nucleophilic addition-elimination mechanism)完 成的,具体过程如下: 0 +0 R OR' +R'O- RRO OH +R'OH R OH R 四面体中间体 O川先进攻酯漾基碳发生亲核加成,形成四面体中间体,然后消除O',这两步反应均是可逆 的,在四面体中间体上消除OH,得回原来的酯:消除O',可以得羧酸。但由于该反应是在碱 性条件下进行的,生成的羧酸可以和碱发生中和反应,从而移动了平衡。 上述反应机理表明,酯在碱性水解时,发生了酰氧键(acyl-oxygen bond)断裂,这一点已被同 位素标记实验(isotope labeling experimen)所证明。乙酸戊酯用H,O在碱性条件下水解,结果 得到的羧酸负离子中有“O,这说明水解是酰氧键断裂: CH,oC,H+"oH= CH, 人oH+CH.0一cH人g+CH,oH 酰氧健断裂 酯的碱性水解也是按四面体中间体机理进行的。这一点已被很多实验证明。其中一个证据是三 氟代乙酸乙酯与乙氧基负离子在正丁醚中形成一个四面体化合物,这已从红外光谱中得到了 证实。 OC.H: cs,况 另外一个证据是用R 人OR在普通水中部分水解,然后测定未水解酯中“0的含量,发现 酯中O含量减少,即存在没有O的酯。这个现象,可以从形成四面体中间体来解释

14.3 607 5) R人OR'+OH ROH一R人OH+OR (iv) (i) () 质子转移 ()H R人OR+OH一 一R人H+0R (vi) (i) () 中间体(i)既可消除OR'得到羧酸(),又可消除OH恢复为原来的酯(v),同时中间体(i)的 OH上的质子可以转移到另一个氧上得到(ii),这是一个交换反应(exchange reaction).。(ii)与 ()一样,可以同样的速率消除OR',得到羧酸(v),又可消除OH得到酯(vi),()OH上的 质子也可以转移得到()。由于存在这些可逆反应及交换反应,因此在未水解的酯中,存在两种 酯即(iv)与(),在(vi)中已没有(),故在分析未水解酯中发现(的含量降低,这是由于形成四 面体中间体进行质子转移的结果。 碱性水解反应过程中形成一个四面体中间体的负离子,并且比较拥挤,因此可以预见,羰基 附近的碳上有吸电子基团可以使负离子稳定而促进反应,空间位阻越小,越有利于加成反应,这 些预见从表14-2中一系列化合物反应的相对速率得到证实。当羧酸的。碳上存在吸电子基团 氯时,反应速率较未取代的加快290倍,吸电子基团越多,吸电子能力越强,反应速率就越快。同 时可以看到,羧酸的α碳上空间位阻越大,或酯基中与氧连接的烷基碳上取代基越多,反应速率 也就越慢 表1+-2电子效应及空间效应对酯碱性催化水解反应速帝的影响 RCOOC:Hs H0.25 相对速率 相对速率 相对速率 CHC CH.CH 0.470 CHCH2 0.431 CHCL 6130 (CH)CH 0.100 (CH,)2CH 0.065 CHCo 7200 (CHa)C 0.010 (CH)3C 0.002 23150 CHs 0.102 0.042 (2)酯的酸性水解机理酯水解亦可在酸性条件下进行: CH,人OCH,+H,0H CH,人OH+CH,OH 经同位素方法证明,酸催化水解也是酰氧键断裂,反应是按下列机理进行的: