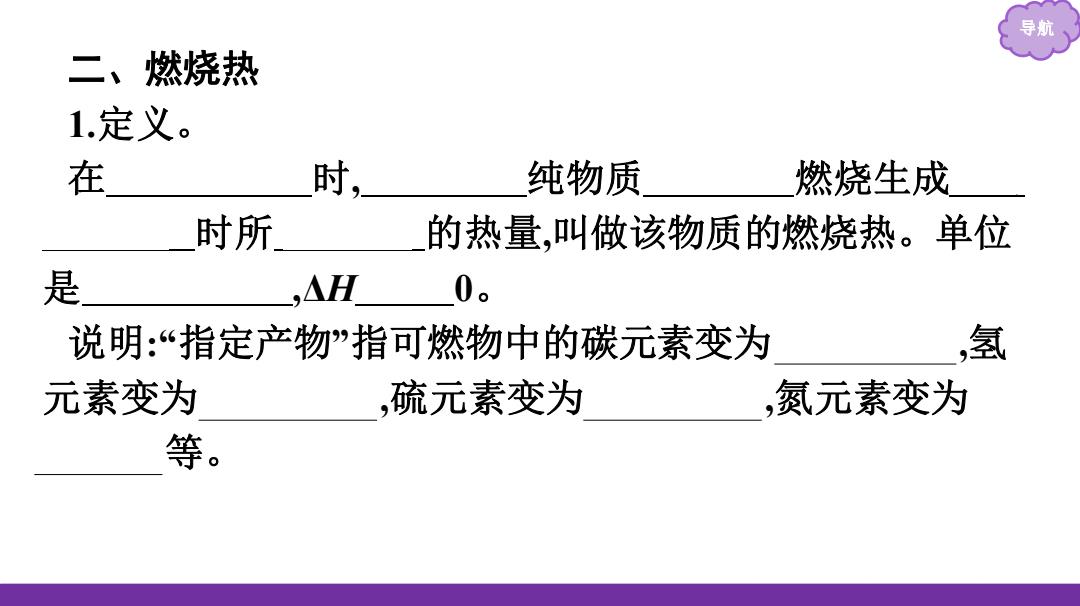
导航 二、燃烧热 1.定义。 在 时, 纯物质 燃烧生成 时所 的热量,叫做该物质的燃烧热。单位 是 ,△H 0。 说明:“指定产物”指可燃物中的碳元素变为 氢 元素变为 硫元素变为 ,氮元素变为 等
导航 二、燃烧热 1.定义。 在 101 kPa 时, 1 mol 纯物质 完全 燃烧生成 指 定产物 时所 放出 的热量,叫做该物质的燃烧热。单位 是 kJ·mol-1 ,ΔH < 0。 说明:“指定产物”指可燃物中的碳元素变为 CO2 (g) ,氢 元素变为 H2O(l) ,硫元素变为 SO2 (g) ,氮元素变为 N2 (g) 等

导 2.意义。 在25C和101kPa时甲烷的燃烧热△H=-890.3kJmo1,热化 学方程式为 说明:1mol甲烷完全燃烧生成C02(g)和 时放出 kJ的热量
导航 2.意义。 在25 ℃和101 kPa时甲烷的燃烧热ΔH=-890.3 kJ·mol-1 ,热化 学方程式为 CH4 (g)+2O2 (g)══CO2 (g)+2H2O(l) ΔH= -890.3 kJ·mol-1 。 说明:1 mol 甲烷完全燃烧生成CO2 (g)和 H2O(l) 时放出 890.3 kJ的热量

导 微思考2可燃物越多其燃烧热数值越大”,这句话是否正确? 物质的燃烧热如何测定? 提示:不正确。物质的燃烧热是指10l纯物质完全燃烧生 成指定产物时放出的热量,物质的燃烧热不随物质量的改变 而改变;燃烧热通常用量热计由实验测得
导航 微思考2“可燃物越多其燃烧热数值越大”,这句话是否正确? 物质的燃烧热如何测定? 提示:不正确。物质的燃烧热是指1 mol纯物质完全燃烧生 成指定产物时放出的热量,物质的燃烧热不随物质量的改变 而改变;燃烧热通常用量热计由实验测得

预习检测 1.判断正误,正确的画“V,错误的画“×”。 (1)热化学方程式既体现了物质变化,又体现了能量变化。(√) (2)H2(g)+C2(g)一2HC1(g) △H=-184.6kJmo1表示1mol H2(g)和1molC2(g)生成2 mol HCI(g)放出的热量为184.6kJ。 (√) (3)1ol碳在常温常压下燃烧所放出的热量为碳的燃烧热。 (X) (4)1molH,完全燃烧生成1mol气态水所放出的热量称为氢 气的燃烧热。(×)
导航 1.判断正误,正确的画“√”,错误的画“×” 。 (1)热化学方程式既体现了物质变化,又体现了能量变化。( ) (2)H2 (g)+Cl2 (g)══2HCl(g) ΔH=-184.6 kJ·mol-1表示1 mol H2 (g)和1 mol Cl2 (g)生成2 mol HCl(g)放出的热量为184.6 kJ。 ( ) (3)1 mol碳在常温常压下燃烧所放出的热量为碳的燃烧热。 ( ) (4)1 mol H2完全燃烧生成1 mol气态水所放出的热量称为氢 气的燃烧热。( ) √ √ 预 习 检 测 × ×

导月 2.下列说法不正确的是( A.物质发生化学反应的反应热仅指反应放出的热量 B.热化学方程式中各物质的化学计量数只表示物质的量,不 表示分子的个数 C所有的燃烧反应都是放热的 D.热化学方程式中,化学式前面的化学计量数可以是分数 答案:A 解析:化学反应的反应热包括反应放出或吸收的热量
导航 2.下列说法不正确的是( )。 A.物质发生化学反应的反应热仅指反应放出的热量 B.热化学方程式中各物质的化学计量数只表示物质的量,不 表示分子的个数 C.所有的燃烧反应都是放热的 D.热化学方程式中,化学式前面的化学计量数可以是分数 答案:A 解析:化学反应的反应热包括反应放出或吸收的热量