
2 酶促反应动力学 教学基本内容: 酶促反应的特点;单底物酶促反应动力学方程(米氏方程)的推导;抑制剂 对酶促反应的影响,竞争性抑制和非竞争性抑制酶促反应动力学方程的推导;产 物抑制、底物抑制的概念,产物抑制和底物抑制酶促反应动力学方程的推导;多 底物酶促反应的机制,双底物酶促反应动力学的推导;固定化酶的概念,常见的 酶的固定化方法,固定化对酶性质的影响及固定化对酶促反应的影响,外扩散过 程和内扩散过程分析;酶的失活动力学。 2.1 酶促反应动力学的特点 2.2 均相酶促反应动力学 2.2.1 酶促反应动力学基础 2.2.2 单底物酶促反应动力学 2.2.3 抑制剂对酶促反应速率的影响 2.2.4 多底物酶促反应动力学 2.3 固定化酶促反应动力学 2.4 酶的失活动力学 授课重点: 1. 酶的应用研究与经典酶学研究的联系与区别 2. 米氏方程。 3 竞争性抑制酶促反应动力学方程。 4. 非竞争性抑制酶促反应动力学方程。 5. 产物抑制酶促反应动力学方程。 6. 底物抑制酶促反应动力学方程。 7. 双底物酶促反应动力学方程。 8. 外扩散对固定化酶促反应动力学的影响,Da 准数的概念。 9. 内扩散对固定化酶促反应动力学的影响,φ 准数的概念。 10. 酶的失活动力学。 难点: 1. 采用稳态法和快速平衡法建立酶促反应动力学方程。 2. 固定化对酶促反应的影响,五大效应(分子构象的改变、位阻效应、微扰 效应、分配效应及扩散效应)的区分。 3. 内扩散过程分析,涉及到对微元单位进行物料衡算和二阶微分方程的求
2 酶促反应动力学 教学基本内容: 酶促反应的特点;单底物酶促反应动力学方程(米氏方程)的推导;抑制剂 对酶促反应的影响,竞争性抑制和非竞争性抑制酶促反应动力学方程的推导;产 物抑制、底物抑制的概念,产物抑制和底物抑制酶促反应动力学方程的推导;多 底物酶促反应的机制,双底物酶促反应动力学的推导;固定化酶的概念,常见的 酶的固定化方法,固定化对酶性质的影响及固定化对酶促反应的影响,外扩散过 程和内扩散过程分析;酶的失活动力学。 2.1 酶促反应动力学的特点 2.2 均相酶促反应动力学 2.2.1 酶促反应动力学基础 2.2.2 单底物酶促反应动力学 2.2.3 抑制剂对酶促反应速率的影响 2.2.4 多底物酶促反应动力学 2.3 固定化酶促反应动力学 2.4 酶的失活动力学 授课重点: 1. 酶的应用研究与经典酶学研究的联系与区别 2. 米氏方程。 3 竞争性抑制酶促反应动力学方程。 4. 非竞争性抑制酶促反应动力学方程。 5. 产物抑制酶促反应动力学方程。 6. 底物抑制酶促反应动力学方程。 7. 双底物酶促反应动力学方程。 8. 外扩散对固定化酶促反应动力学的影响,Da 准数的概念。 9. 内扩散对固定化酶促反应动力学的影响,φ 准数的概念。 10. 酶的失活动力学。 难点: 1. 采用稳态法和快速平衡法建立酶促反应动力学方程。 2. 固定化对酶促反应的影响,五大效应(分子构象的改变、位阻效应、微扰 效应、分配效应及扩散效应)的区分。 3. 内扩散过程分析,涉及到对微元单位进行物料衡算和二阶微分方程的求

解、无因次变换、解析解与数值解等问题。 4.温度对酶促反应速率和酶的失活速率的双重影响,最适温度的概念。温度 和时间对酶失活的影响。 本章主要教学要求: 1. 掌握稳态法和快速平衡法推导酶促反应动力学方程。 2. 了解酶的固定化方法。理解固定化对酶促反应速率的影响。掌握 Da 准数 的概念及 φ 准数的概念,理解外扩散和内扩散对酶促反应速率的影响。 3. 了解酶的一步失活模型与多步失活模型,反应过程中底物对酶稳定性的 影响
解、无因次变换、解析解与数值解等问题。 4.温度对酶促反应速率和酶的失活速率的双重影响,最适温度的概念。温度 和时间对酶失活的影响。 本章主要教学要求: 1. 掌握稳态法和快速平衡法推导酶促反应动力学方程。 2. 了解酶的固定化方法。理解固定化对酶促反应速率的影响。掌握 Da 准数 的概念及 φ 准数的概念,理解外扩散和内扩散对酶促反应速率的影响。 3. 了解酶的一步失活模型与多步失活模型,反应过程中底物对酶稳定性的 影响

2 酶促反应动力学 2.1 酶促反应动力学的特点 2.1.1 酶的基本概念 2.1.2 酶的稳定性及应用特点 酶是以活力、而不是以质量购销的。 酶有不同的质量等级:工业用酶、食品用酶、医药用酶。 酶的实际应用中应注意,没有必要使用比工艺条件所需纯度更高的酶。 2.1.3 酶的应用研究与经典酶学研究的联系与区别 经典酶学研究中,酶活力的测定是在反应的初始短时间内进行的,并且酶浓 度、底物浓度较低,且为水溶液,酶学研究的目的是探讨酶促反应的机制。工业 上,为保证酶促反应高效率完成,常需要使用高浓度的酶制剂和底物,且反应要 持续较长时间,反应体系多为非均相体系,有时反应是在有机溶剂中进行。 2.2 均相酶促反应动力学 均相酶促反应动力学是以研究酶促反应机制为目的发展起来的。作为酶工程 技术人员,如果仅仅比较详细地解释了酶促反应机制和过程是不够的,还应对影 响其反应速率的因素进行定量的分析,建立可信赖的反应速率方程,并以此为基 础进行反应器的合理设计和确定反应过程的最佳条件。因此,以讨论反应机制为 目的的酶促反应动力学与为了设计与操作反应器的工业酶动力学,在研究方法上 自然不同。这与化学中的反应动力学和工业上的化学反应动力学的不同一样。 2.2.1 酶促反应动力学基础 可采用化学反应动力学方法建立酶促反应动力学方程。 对酶促反应 A B P Q k + → + ,有: A P ACB r = r = r = kC (2-1) dt dC r A A = − (2-2) dt dC r P P = (2-3) 式中, k:酶促反应速率常数; r:酶促反应速率; rA:以底物 A 的消耗速率表示的酶促反应速率; rP:以产物 P 的生成速率表示的酶促反应速率
2 酶促反应动力学 2.1 酶促反应动力学的特点 2.1.1 酶的基本概念 2.1.2 酶的稳定性及应用特点 酶是以活力、而不是以质量购销的。 酶有不同的质量等级:工业用酶、食品用酶、医药用酶。 酶的实际应用中应注意,没有必要使用比工艺条件所需纯度更高的酶。 2.1.3 酶的应用研究与经典酶学研究的联系与区别 经典酶学研究中,酶活力的测定是在反应的初始短时间内进行的,并且酶浓 度、底物浓度较低,且为水溶液,酶学研究的目的是探讨酶促反应的机制。工业 上,为保证酶促反应高效率完成,常需要使用高浓度的酶制剂和底物,且反应要 持续较长时间,反应体系多为非均相体系,有时反应是在有机溶剂中进行。 2.2 均相酶促反应动力学 均相酶促反应动力学是以研究酶促反应机制为目的发展起来的。作为酶工程 技术人员,如果仅仅比较详细地解释了酶促反应机制和过程是不够的,还应对影 响其反应速率的因素进行定量的分析,建立可信赖的反应速率方程,并以此为基 础进行反应器的合理设计和确定反应过程的最佳条件。因此,以讨论反应机制为 目的的酶促反应动力学与为了设计与操作反应器的工业酶动力学,在研究方法上 自然不同。这与化学中的反应动力学和工业上的化学反应动力学的不同一样。 2.2.1 酶促反应动力学基础 可采用化学反应动力学方法建立酶促反应动力学方程。 对酶促反应 A B P Q k + → + ,有: A P ACB r = r = r = kC (2-1) dt dC r A A = − (2-2) dt dC r P P = (2-3) 式中, k:酶促反应速率常数; r:酶促反应速率; rA:以底物 A 的消耗速率表示的酶促反应速率; rP:以产物 P 的生成速率表示的酶促反应速率

对连锁的酶促反应,如 A M P k k ⎯⎯1→ ⎯⎯2→ ,有: A A kC dt dC − = (2-4) A M M k C k C dt dC = 1 − 2 (2-5) M P k C dt dC = 2 (2-6) 2.2.2 单底物酶促反应动力学(米氏方程) 单底物不可逆酶促反应是最简单的酶促反应。水解酶、异构酶及多数裂解酶 的催化反应均属此类。 对单底物酶促反应 S → P ,根据酶-底物中间复合物假说,其反应机制可 表示为: E S ES E P k k k + → + − 1 2 1 下面我们分别采用快速平衡法和稳态法推导其动力学方程。 快速平衡法: 几点假设: (1)CS>>CE,中间复合物 ES 的形成不会降低 CS。 (2)不考虑 E + P EP 这个可逆反应。 (3) E S ES k k + − 1 1 为快速平衡, ES E P k → + 2 为整个反应的限速阶段,此 ES 分解成产物不足以破坏这个平衡。 根据以上假设,建立动力学方程: CES r k = 2 (2-7) 1 1 k k K C C C S ES E S − = = (2-8) CE0 = CE +CES (2-9) 解之,得 S S E S K C k C C r + = 2 0 (2-10) 令 max 2CE0 r = k , (2-11)
对连锁的酶促反应,如 A M P k k ⎯⎯1→ ⎯⎯2→ ,有: A A kC dt dC − = (2-4) A M M k C k C dt dC = 1 − 2 (2-5) M P k C dt dC = 2 (2-6) 2.2.2 单底物酶促反应动力学(米氏方程) 单底物不可逆酶促反应是最简单的酶促反应。水解酶、异构酶及多数裂解酶 的催化反应均属此类。 对单底物酶促反应 S → P ,根据酶-底物中间复合物假说,其反应机制可 表示为: E S ES E P k k k + → + − 1 2 1 下面我们分别采用快速平衡法和稳态法推导其动力学方程。 快速平衡法: 几点假设: (1)CS>>CE,中间复合物 ES 的形成不会降低 CS。 (2)不考虑 E + P EP 这个可逆反应。 (3) E S ES k k + − 1 1 为快速平衡, ES E P k → + 2 为整个反应的限速阶段,此 ES 分解成产物不足以破坏这个平衡。 根据以上假设,建立动力学方程: CES r k = 2 (2-7) 1 1 k k K C C C S ES E S − = = (2-8) CE0 = CE +CES (2-9) 解之,得 S S E S K C k C C r + = 2 0 (2-10) 令 max 2CE0 r = k , (2-11)
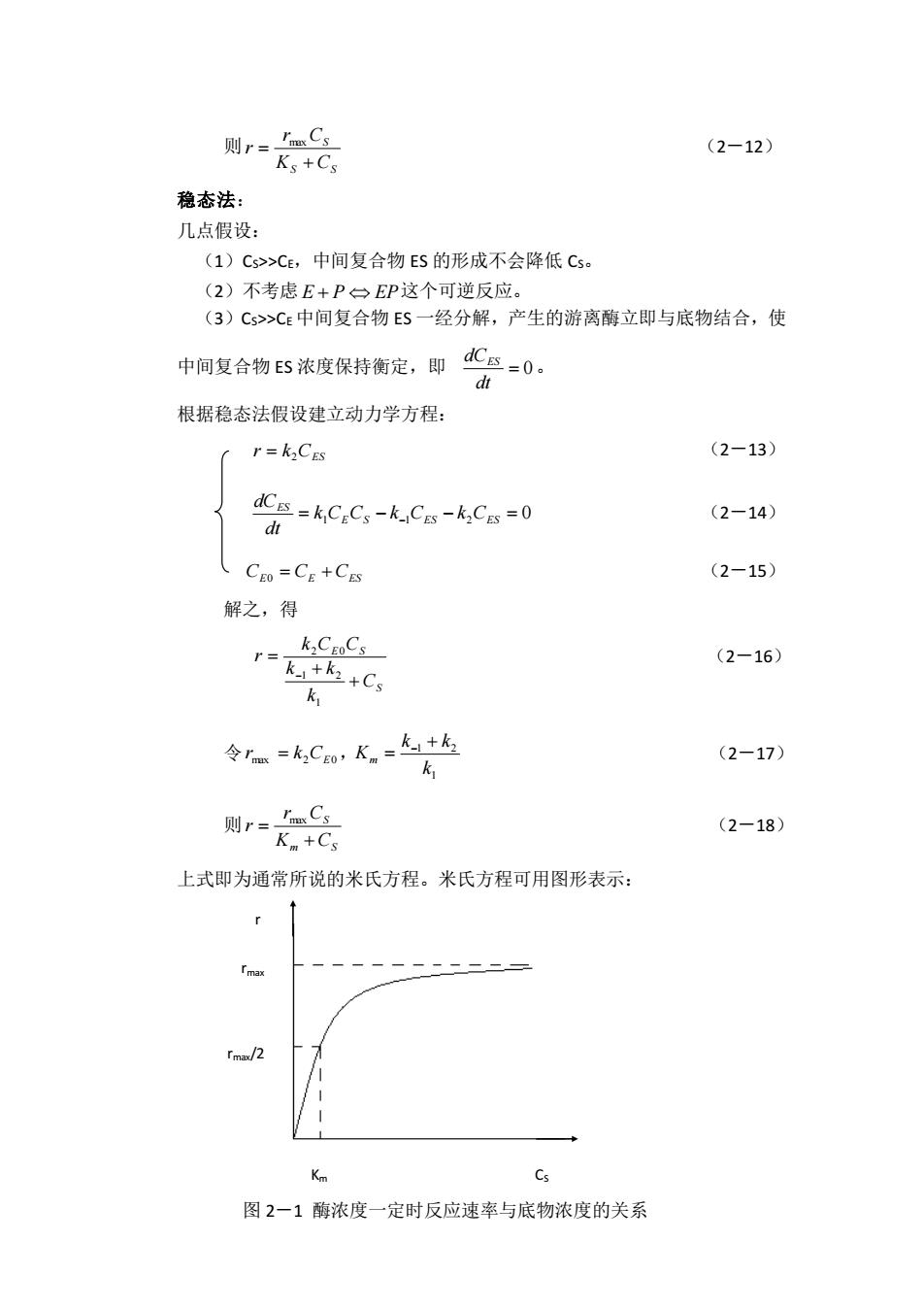
则 S S S K C r C r + = max (2-12) 稳态法: 几点假设: (1)CS>>CE,中间复合物 ES 的形成不会降低 CS。 (2)不考虑 E + P EP 这个可逆反应。 (3)CS>>CE 中间复合物 ES 一经分解,产生的游离酶立即与底物结合,使 中间复合物 ES 浓度保持衡定,即 = 0 dt dCES 。 根据稳态法假设建立动力学方程: CES r k = 2 (2-13) = 1 E S − −1 ES − 2 ES = 0 ES k C C k C k C dt dC (2-14) CE0 = CE +CES (2-15) 解之,得 S E S C k k k k C C r + + = − 1 1 2 2 0 (2-16) 令 max 2CE0 r = k , 1 1 2 k k k Km + = − (2-17) 则 m S S K C r C r + = max (2-18) 上式即为通常所说的米氏方程。米氏方程可用图形表示: r rmax rmax/2 Km CS 图 2-1 酶浓度一定时反应速率与底物浓度的关系
则 S S S K C r C r + = max (2-12) 稳态法: 几点假设: (1)CS>>CE,中间复合物 ES 的形成不会降低 CS。 (2)不考虑 E + P EP 这个可逆反应。 (3)CS>>CE 中间复合物 ES 一经分解,产生的游离酶立即与底物结合,使 中间复合物 ES 浓度保持衡定,即 = 0 dt dCES 。 根据稳态法假设建立动力学方程: CES r k = 2 (2-13) = 1 E S − −1 ES − 2 ES = 0 ES k C C k C k C dt dC (2-14) CE0 = CE +CES (2-15) 解之,得 S E S C k k k k C C r + + = − 1 1 2 2 0 (2-16) 令 max 2CE0 r = k , 1 1 2 k k k Km + = − (2-17) 则 m S S K C r C r + = max (2-18) 上式即为通常所说的米氏方程。米氏方程可用图形表示: r rmax rmax/2 Km CS 图 2-1 酶浓度一定时反应速率与底物浓度的关系