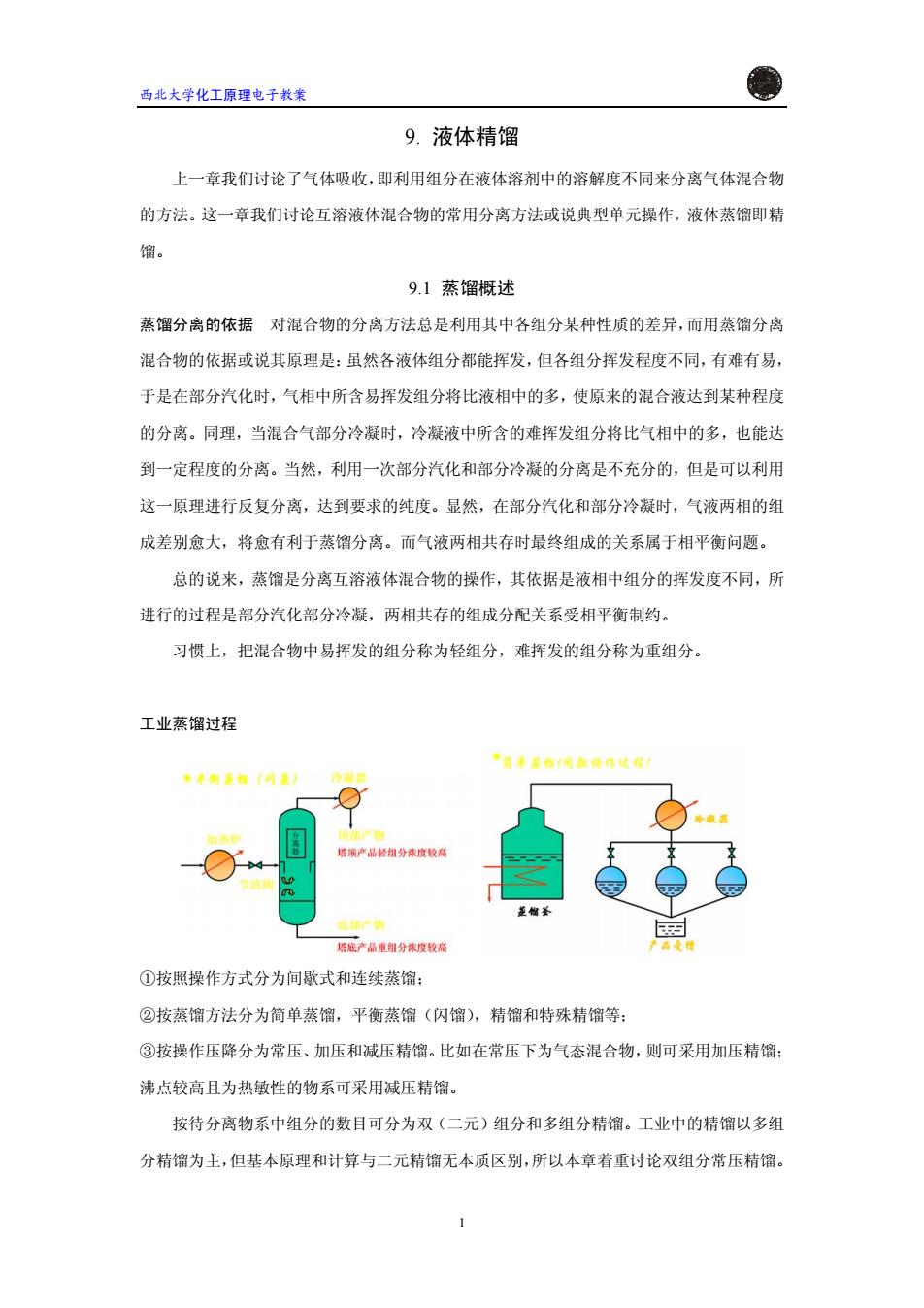
西北大学化工原理电子教案 9.液体精馏 上一章我们讨论了气体吸收,即利用组分在液体溶剂中的溶解度不同来分离气体混合物 的方法。这一章我们讨论互溶液体混合物的常用分离方法或说典型单元操作,液体蒸馏即精 馏。 9.1蒸馏概述 蒸馏分离的依据对混合物的分离方法总是利用其中各组分某种性质的差异,而用蒸馏分离 混合物的依据或说其原理是:虽然各液体组分都能挥发,但各组分挥发程度不同,有难有易, 于是在部分汽化时,气相中所含易挥发组分将比液相中的多,使原来的混合液达到某种程度 的分离。同理,当混合气部分冷凝时,冷凝液中所含的难挥发组分将比气相中的多,也能达 到一定程度的分离。当然,利用一次部分汽化和部分冷凝的分离是不充分的,但是可以利用 这一原理进行反复分离,达到要求的纯度。显然,在部分汽化和部分冷凝时,气液两相的组 成差别愈大,将愈有利于蒸馏分离。而气液两相共存时最终组成的关系属于相平衡问题。 总的说来,蒸馏是分离互溶液体混合物的操作,其依据是液相中组分的挥发度不同,所 进行的过程是部分汽化部分冷凝,两相共存的组成分配关系受相平衡制约。 习惯上,把混合物中易挥发的组分称为轻组分,难挥发的组分称为重组分。 工业蒸馏过程 P608日0表0作花难 t●B0网0 然碳产品轻组分浓度较高 建非么简 塔:产品重组分浓度较高 ①按照操作方式分为间歇式和连续蒸馏: ②按蒸馏方法分为简单蒸馏,平衡蒸馏(闪馏),精馏和特殊精馏等: ③按操作压降分为常压、加压和减压精馏。比如在常压下为气态混合物,则可采用加压精馏: 沸点较高且为热敏性的物系可采用减压精馏。 按待分离物系中组分的数目可分为双(二元)组分和多组分精馏。工业中的精馏以多组 分精馏为主,但基本原理和计算与二元精馏无本质区别,所以本章着重讨论双组分常压精馏
西北大学化工原理电子教案 9. 液体精馏 上一章我们讨论了气体吸收,即利用组分在液体溶剂中的溶解度不同来分离气体混合物 的方法。这一章我们讨论互溶液体混合物的常用分离方法或说典型单元操作,液体蒸馏即精 馏。 9.1 蒸馏概述 蒸馏分离的依据 对混合物的分离方法总是利用其中各组分某种性质的差异,而用蒸馏分离 混合物的依据或说其原理是:虽然各液体组分都能挥发,但各组分挥发程度不同,有难有易, 于是在部分汽化时,气相中所含易挥发组分将比液相中的多,使原来的混合液达到某种程度 的分离。同理,当混合气部分冷凝时,冷凝液中所含的难挥发组分将比气相中的多,也能达 到一定程度的分离。当然,利用一次部分汽化和部分冷凝的分离是不充分的,但是可以利用 这一原理进行反复分离,达到要求的纯度。显然,在部分汽化和部分冷凝时,气液两相的组 成差别愈大,将愈有利于蒸馏分离。而气液两相共存时最终组成的关系属于相平衡问题。 总的说来,蒸馏是分离互溶液体混合物的操作,其依据是液相中组分的挥发度不同,所 进行的过程是部分汽化部分冷凝,两相共存的组成分配关系受相平衡制约。 习惯上,把混合物中易挥发的组分称为轻组分,难挥发的组分称为重组分。 工业蒸馏过程 ①按照操作方式分为间歇式和连续蒸馏; ②按蒸馏方法分为简单蒸馏,平衡蒸馏(闪馏),精馏和特殊精馏等; ③按操作压降分为常压、加压和减压精馏。比如在常压下为气态混合物,则可采用加压精馏; 沸点较高且为热敏性的物系可采用减压精馏。 按待分离物系中组分的数目可分为双(二元)组分和多组分精馏。工业中的精馏以多组 分精馏为主,但基本原理和计算与二元精馏无本质区别,所以本章着重讨论双组分常压精馏。 1

西北大学化工原理电子教案 蒸馏操作的费用和操作压强加热和冷却(能耗大)是蒸馏过程的主要费用。此外,对同样的 加热量和冷却量,所需费用还与加热温度和冷却温度有关。 9.2双组分溶液的汽液相平衡 蒸馏是汽液两相中的传质过程,因此常用组分在两相中浓度(组分)偏离平衡的程度来 衡量传质推动力的大小。传质过程是以两相达到相平衡为极限的。因此,汽液相平衡为极限 的。因此,汽液相平衡关系是分析蒸馏原理和设备计算的理论基础,所以在讨论精馏计算之 前,先讨论相平衡。 9.2.1理想物系的气液相平衡 气液两相平衡共存时的自由度根据相率,平衡物系的自由度为: F=N-Φ+2 (9-2) 对双组分物系气液:N=2、=2,则代入得: F=2 即双组分物系汽液平衡的自由度为2。 平衡物系的参数为温度T,压强P,以及汽相组成y和液相组成X。对二元系,给定一 个汽相组成和一个液相组成,则可由y4+yB=1,x4+xB=1定出另一个汽相组成和液相 组成。因而在上述四个参数T、P、y、x中任意确定两个,即可确定系统状态。 精馏系统经常在恒压下操作,即P一定,则在T、y、x中任意确定一个,系统的状态 就确定了。如果定x则y~T之间存在对应关系:如果定y,则x~T之间存在对应关系:如 果定T,则x~y之间存在对应关系。精馏过程中相平衡关系的定量描述,就是要找出P一 定时,y或x~T,以及y~x的定量关系。 完全理想物系是指:液相为理想溶液,服从拉乌尔定律,P,=Px:汽相为理想气体 服从道尔顿分压定律:P:=Py 在拉乌尔定律p,=px,中,p是纯组分i在溶液温度t下的饱和蒸汽压,因而p是 温度t的函数,可写成: pi=f() 纯组分的饱和蒸汽压P与温度t的关系通常用Antoine(安托因)经验方法计算,即: 2
西北大学化工原理电子教案 蒸馏操作的费用和操作压强 加热和冷却(能耗大)是蒸馏过程的主要费用。此外,对同样的 加热量和冷却量,所需费用还与加热温度和冷却温度有关。 9.2 双组分溶液的汽液相平衡 蒸馏是汽液两相中的传质过程,因此常用组分在两相中浓度(组分)偏离平衡的程度来 衡量传质推动力的大小。传质过程是以两相达到相平衡为极限的。因此,汽液相平衡为极限 的。因此,汽液相平衡关系是分析蒸馏原理和设备计算的理论基础,所以在讨论精馏计算之 前,先讨论相平衡。 9.2.1 理想物系的气液相平衡 气液两相平衡共存时的自由度 根据相率,平衡物系的自由度为: F=N-Φ+2 (9-2) 对双组分物系气液:N=2、Φ=2,则代入得: F=2 即双组分物系汽液平衡的自由度为 2。 平衡物系的参数为温度 T,压强 P,以及汽相组成 y 和液相组成 x。对二元系,给定一 个汽相组成和一个液相组成,则可由 + = 1 BA yy , + = 1 BA xx 定出另一个汽相组成和液相 组成。因而在上述四个参数 T、P、y、x 中任意确定两个,即可确定系统状态。 精馏系统经常在恒压下操作,即 P 一定,则在 T、y、x 中任意确定一个,系统的状态 就确定了。如果定 x 则 y~T 之间存在对应关系;如果定 y,则 x~T 之间存在对应关系;如 果定 T,则 x~y 之间存在对应关系。精馏过程中相平衡关系的定量描述,就是要找出 P 一 定时,y 或 x~T,以及 y~x 的定量关系。 完全理想物系是指:液相为理想溶液,服从拉乌尔定律, ;汽相为理想气体 服从道尔顿分压定律: i o ii = xpp = pyp ii 在拉乌尔定律 中, 是纯组分 i 在溶液温度 t 下的饱和蒸汽压,因而 是 温度 t 的函数,可写成: i o ii = xpp o i p o i p (tfp ) i o i = 纯组分的饱和蒸汽压 P 与温度 t 的关系通常用 Antoine (安托因)经验方法计算,即: 2

西北大学化工原理电子教案 10gp°=A-B (9-7) 1+C 式中A、B、C为经验常数,可用手册查出。 双组分理想物系的液相组成一温度(泡点)关系式 对双组分,由拉乌尔定律: PA=PAXA (9-3) P8=PBxB (9-4) 溶液沸腾时的蒸汽压之和等于外压P,则可得: PA+PB=P 即分压之和等于总压。由(93,4)式可得: Px+PaxB=P pxa+p8(1-x)=p x=p-pg (9-5) P-pa 或: x=-P-fo(t) (9-6) f0)-f() 此式即液相组成与泡点温度的关系。已知泡点温度t可直接由Acoine方程计算p?、pg则 求出x4。若己知x4,求t,则经试差。因为p与t的关系通常为非线性的。例见9-1。 气液两相平衡组成间的关系式联解拉乌尔式与道尔顿式即可得: 或对轻组分A写成: yA= (9-8) 若令两相平衡常数K为: K=P/p (9-10) 3
西北大学化工原理电子教案 Ct B Apo + log −= (9-7) 式中 A、B、C 为经验常数,可用手册查出。 双组分理想物系的液相组成-温度(泡点)关系式 对双组分,由拉乌尔定律: A (9-3) o AA = xpp B (9-4) o BB = xpp 溶液沸腾时的蒸汽压之和等于外压 P,则可得: ppp + BA = 即分压之和等于总压。由(9-3,4)式可得: B pxpxp o BA o A =+ ( A ) pxpxp o BA o A 1 =−+ o B o A o b A pp pp x − − = (9-5) ( ) () ()tftf tfp x A B B A − − 或: = (9-6) 此式即液相组成与泡点温度的关系。已知泡点温度 t 可直接由 Acoine 方程计算 、 则 求出 。若已知 ,求 t,则经试差。因为 与 t 的关系通常为非线性的。例见 9-1。 o pA o pB o A pi x A x 气液两相平衡组成间的关系式 联解拉乌尔式与道尔顿式即可得: i o i i x p p y = 或对轻组分 A 写成: A o A A x p p y = (9-8) 若令两相平衡常数κ 为: ppo κ = A (9-10) 3
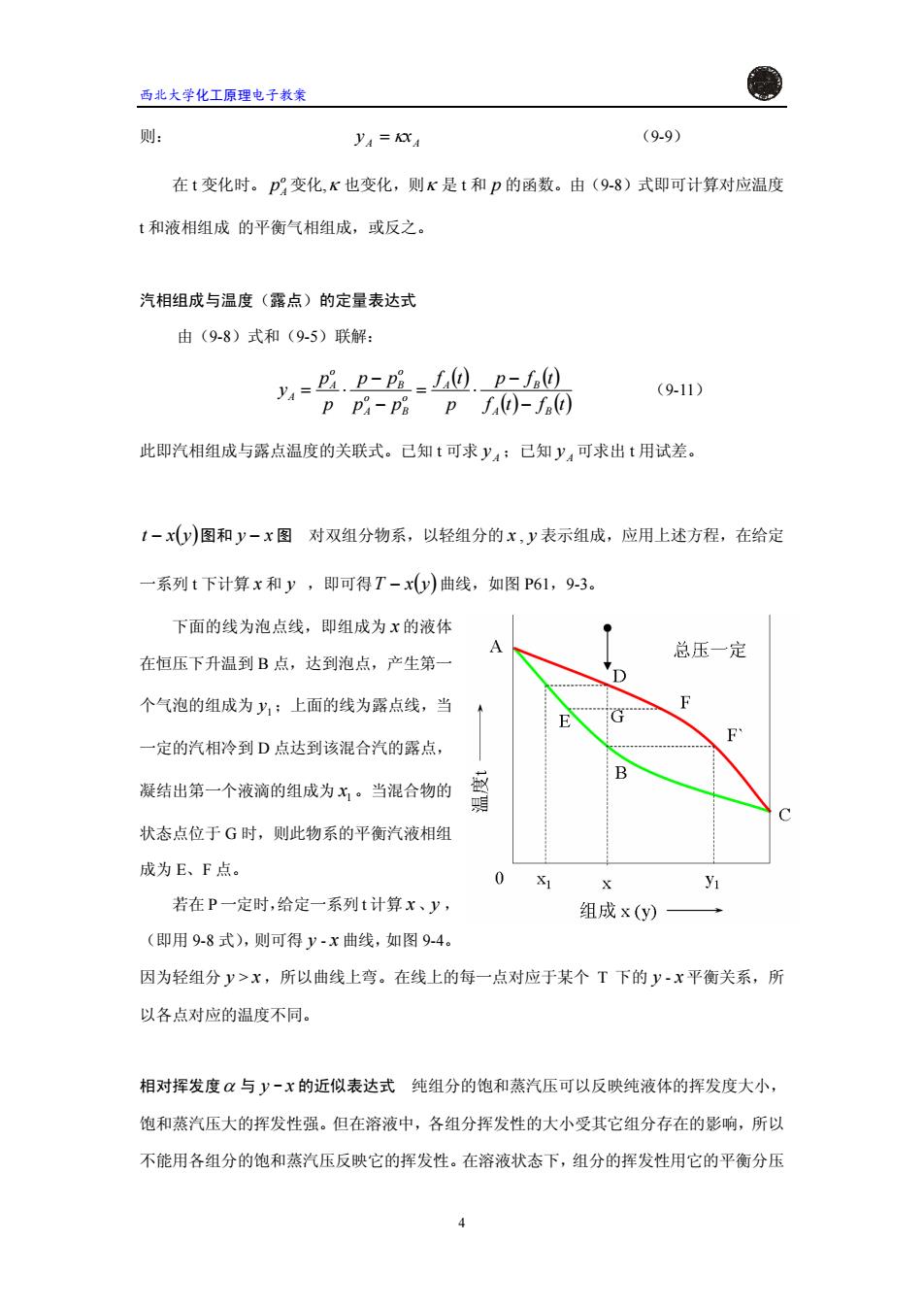
西北大学化工原理电子教案 则: y=KXA (9.9) 在t变化时。p变化,K也变化,则K是t和p的函数。由(9-8)式即可计算对应温度 t和液相组成的平衡气相组成,或反之。 汽相组成与温度(露点)的定量表达式 由(9-8)式和(9-5)联解: y=2.p-p=0.p-f0 (9-11) ppA-P8pf)-f@间 此即汽相组成与露点温度的关联式。己知t可求y4;己知y4可求出t用试差。 1-xy)图和y-x图对双组分物系,以轻组分的x,y表示组成,应用上述方程,在给定 一系列t下计算x和y,即可得T-xy)曲线,如图P61,93。 下面的线为泡点线,即组成为x的液体 A 总压一定 在恒压下升温到B点,达到泡点,产生第一 O 个气泡的组成为y,:上面的线为露点线,当 F E G 一定的汽相冷到D点达到该混合汽的露点, B 凝结出第一个液滴的组成为x。当混合物的 明 状态点位于G时,则此物系的平衡汽液相组 成为E、F点。 0 X yu 若在P一定时,给定一系列t计算x、y, 组成x(y) → (即用9-8式),则可得y-x曲线,如图9-4。 因为轻组分y>x,所以曲线上弯。在线上的每一点对应于某个T下的y-x平衡关系,所 以各点对应的温度不同。 相对挥发度与y-x的近似表达式纯组分的饱和蒸汽压可以反映纯液体的挥发度大小, 饱和蒸汽压大的挥发性强。但在溶液中,各组分挥发性的大小受其它组分存在的影响,所以 不能用各组分的饱和蒸汽压反映它的挥发性。在溶液状态下,组分的挥发性用它的平衡分压
西北大学化工原理电子教案 AA 则: = κxy (9-9) 在 t 变化时。 变化, o pA κ 也变化,则κ 是 t 和 p 的函数。由(9-8)式即可计算对应温度 t 和液相组成 的平衡气相组成,或反之。 汽相组成与温度(露点)的定量表达式 由(9-8)式和(9-5)联解: ( ) ( ) () ()tftf tfp p tf pp pp p p y A B A B o B o A o B o A A − − ⋅= − − ⋅= (9-11) 此即汽相组成与露点温度的关联式。已知 t 可求 ;已知 可求出 y A y A t 用试差。 − ( ) yxt 图和 y − x 图 对双组分物系,以轻组分的 x , y 表示组成,应用上述方程,在给定 一系列 t 下计算 x 和 y ,即可得 − (yxT )曲线,如图 P61,9-3。 下面的线为泡点线,即组成为 x 的液体 在恒压下升温到 B 点,达到泡点,产生第一 个气泡的组成为 ;上面的线为露点线,当 一定的汽相冷到 D 点达到该混合汽的露点, 凝结出第一个液滴的组成为 。当混合物的 状态点位于 G 时,则此物系的平衡汽液相组 成为 E、F 点。 1 y 1 x 若在 P 一定时,给定一系列 t 计算 x 、 , (即用 9-8 式),则可得 - y y x 曲线,如图 9-4。 因为轻组分 y > x ,所以曲线上弯。在线上的每一点对应于某个 T 下的 y - x 平衡关系,所 以各点对应的温度不同。 相对挥发度α 与 - y x 的近似表达式 纯组分的饱和蒸汽压可以反映纯液体的挥发度大小, 饱和蒸汽压大的挥发性强。但在溶液中,各组分挥发性的大小受其它组分存在的影响,所以 不能用各组分的饱和蒸汽压反映它的挥发性。在溶液状态下,组分的挥发性用它的平衡分压 4

西北大学化工原理电子教案 ● 与其液相分率的比值表示,并称为挥发度,即: "4sP4 XA XB 若对纯组分,x4=1,平衡分压即为挥发度,也即是饱和蒸汽压。 相对挥发度定义为两组分挥发度之比,即: a==Palx (9-12) VB PB/XB 若气相服从道尔顿分压定律P,=py,则: a=yalya (9-13) XA/XB 即气相中两组分的浓度比为液相中两组分浓度比的α倍。α的定义式即(9-13) 对双组分物系,由y4+yB=1,x4+xg=1,代入并解出y(以轻组分表示)则得: OX y=1+(a-1x (9-14) 此式也称为相平衡方程。如果能知道α,则可计算互成平衡时易挥发组分的y-x对应关系。 此式在精馏计算中用的最多。 对液相为理想溶液的完全理想体系,拉乌尔定律适用。P,=px,则: a=Palxs=Pi (9-15) Pa/x8 pe 即对完全理想体系,α的大小依赖于各组分的性质。由于p?与pg均是温度的函数,则也 是温度的函数,但α随温度的变化比p?,pg随温度的变化小的多。因而在工程设计中取α 的某一平均值计算y一x关系颇为方便。 平均相对挥发度的取法常用如下两种方式: ①算术平均am 当在操作温度的上下限范围内α变化不大时。可取上限温度心,和下限温度,的算术平 均值作为整个温度范围内的am平均值,即:
西北大学化工原理电子教案 与其液相分率的比值表示,并称为挥发度,即: A A A x p v = B B B x p v = 若对纯组分, ,平衡分压即为挥发度,也即是饱和蒸汽压。 = 1 A x 相对挥发度定义为两组分挥发度之比,即: BB AA B A xp xp v v α == (9-12) 若气相服从道尔顿分压定律 = pyp ii ,则: BA BA xx yy α = (9-13) 即气相中两组分的浓度比为液相中两组分浓度比的α 倍。 α 的定义式即(9-13) 对双组分物系,由 =+ 1, y BA yy + = 1 BA xx ,代入并解出 (以轻组分表示)则得: ( )x x y −+ 11 = α α (9-14) 此式也称为相平衡方程。如果能知道α ,则可计算互成平衡时易挥发组分的 y - x 对应关系。 此式在精馏计算中用的最多。 对液相为理想溶液的完全理想体系,拉乌尔定律适用。 i 则: o ii = xpp o B o A BB AA p p xp xp α == (9-15) 即对完全理想体系,α 的大小依赖于各组分的性质。由于 与 均是温度的函数,则 o pA o pB α 也 是温度的函数,但α 随温度的变化比 , 随温度的变化小的多。因而在工程设计中取 o pA o pB α 的某一平均值计算 y − x 关系颇为方便。 平均相对挥发度的取法常用如下两种方式: ① 算术平均α m 当在操作温度的上下限范围内α 变化不大时。可取上限温度α1和下限温度α 2的算术平 均值作为整个温度范围内的α m 平均值,即: 5