
1)涡流扩散凭籍流体质点的端动和旋涡来传递物质的现象。仿照分子扩散,可写出:dCAJ =-D. ds式中,D。-涡流扩散系数,它不是物质的物性,而是与流动状态等有关的一个系数。总扩散通量为:dCAJA= -(D.+ D)dz通常,D。>>D。2)对流传质发生在运动着的流体与相界面之间的传质过程。对于A组分在气相中的单向扩散,有:NA= kc(PA- Pai)而对于A组分在液相中的单向扩散,有:N =k,(CAi-CA)一般,传质分系数kc、ki由实验测定。1.3.2相间传质的双膜理论相间传质是指物质由一相转移到另一相的
1)涡流扩散 凭籍流体质点的湍动和旋涡来传递物质的 现象。 仿照分子扩散,可写出: dz dC DJ A A −= e 式中,De-涡流扩散系数,它不是物质的物 性,而是与流动状态等有关的一个系数。 总扩散通量为: dz dC DDJ A A e +−= )( 通常,De>>D。 2)对流传质 发生在运动着的流体与相界面之间的传质 过程。 对于 A 组分在气相中的单向扩散,有: )( −= PPkN AiAGA 而对于 A 组分在液相中的单向扩散,有: )( −= CCkN AAiLA 一般,传质分系数kG、kL由实验测定。 1.3.2 相间传质的双膜理论 相间传质是指物质由一相转移到另一相的

传质过程。“双膜理论”是目前在工程计算中广泛使用的一个传质模型,如图所示:气液相界面汽相主体111传质方向波相主体P气膜边界LCi边界双膜模型的要点是:①在汽、液两相接触面附近,分别存在着呈滞流流动的稳态气膜与液膜。在此滞流膜层内传质严格按分子扩散方式进行,膜的厚度随流体流动状态而变化;②汽、液两相在相界面上呈平衡状态,即相界面上不存在传质阻力;③膜层以外的汽、液相主体,由于流体的充分动,分压或浓度均匀化,无分压或浓度梯度。通常,双膜理论也称双阻力理论
传质过程。 “双膜理论”是目前在工程计算中广泛使用 的一个传质模型,如图所示: 双膜模型的要点是: ①在汽、液两相接触面附近,分别存在着呈 滞流流动的稳态气膜与液膜。在此滞流膜层 内传质严格按分子扩散方式进行,膜的厚度 随流体流动状态而变化; ②汽、液两相在相界面上呈平衡状态,即相 界面上不存在传质阻力; ③膜层以外的汽、液相主体,由于流体的充 分湍动,分压或浓度均匀化,无分压或浓度 梯度。 通常,双膜理论也称双阻力理论
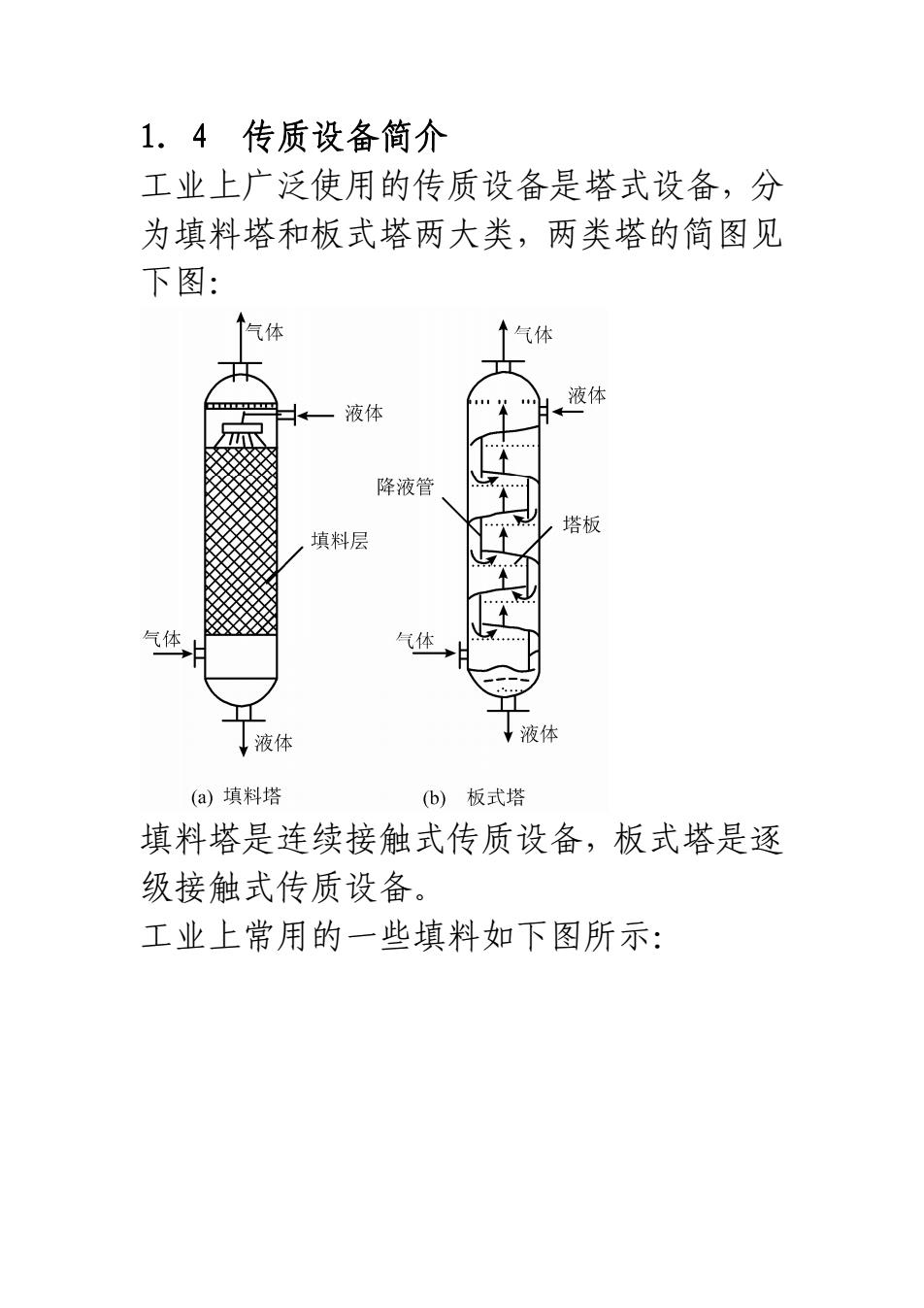
1.4传质设备简介工业上广泛使用的传质设备是塔式设备,分为填料塔和板式塔两大类,两类塔的简图见下图:+气体液体圣版管填料层气体上液体液体(a)填料塔(b)板式塔填料塔是连续接触式传质设备,板式塔是逐级接触式传质设备。工业上常用的一些填料如下图所示:
1.4 传质设备简介 工业上广泛使用的传质设备是塔式设备,分 为填料塔和板式塔两大类,两类塔的简图见 下图: 填料塔是连续接触式传质设备,板式塔是逐 级接触式传质设备。 工业上常用的一些填料如下图所示:

气补圳耗的形妆(0)期装(万金显装年(29月件()送饮发料)2吸收与解吸2.1概述吸收:使气体混合物与适当液体接触,利用混合物中各组分的溶解度不同而将其分离的操作。吸收操作的传质方向:由气相→液相。分离的依据:混合气体中各组分溶解性不同。解(脱)吸:吸收操作的逆过程。几个名词:吸收剂(或溶剂)L:吸收操作所用的液体;溶质(吸收质)A:溶解在液体中的组分;情性气体(载体)V:不溶于液体中的组分。2.2汽液相平衡
2 吸收与解吸 2.1 概述 吸收:使气体混合物与适当液体接触,利用 混合物中各组分的溶解度不同而将其分离 的操作。 吸收操作的传质方向:由气相→液相。 分离的依据:混合气体中各组分溶解性不 同。 解(脱)吸:吸收操作的逆过程。 几个名词: 吸收剂(或溶剂)L:吸收操作所用的液体; 溶质(吸收质)A:溶解在液体中的组分; 惰性气体(载体)V:不溶于液体中的组分。 2.2 汽液相平衡

2.2.1气体在液体中的溶解度在恒定温度和压强下,使气体和液体相接触达平衡时气体在液体中的饱和浓度。平衡分压P:平衡时溶质在汽相中的分压。溶解度与平衡分压p之间的关系如图7-7。一般,溶解度C=f(溶质,溶剂,T,P*)T+,C↓; P*+, C↑。加压和降温可以提高气体的溶解度,故加压和降温有利于吸收操作;反之,升温和减压则有利于解吸过程。2.2.2亨利定律当总压不高(一般约小于 500 kPa)时,在一定温度下,稀溶液上方汽相中溶质的平衡分压与液相中溶质的摩尔分数成正比,即PA=Ex式中:P-溶质A在汽相中的平衡分压,kPa;X-液相中溶质的摩尔分数;E-亨利系数,kPa。上式称为亨利定律。E=f (T),T↑,E↑。易溶气体的E值小,难溶气体的E值大。常
2.2.1 气体在液体中的溶解度 在恒定温度和压强下,使气体和液体相接触 达平衡时气体在液体中的饱和浓度。 平衡分压P* :平衡时溶质在汽相中的分压。 溶解度与平衡分压p* 之间的关系如图 7-7。 一般,溶解度 C=f(溶质,溶剂,T,P*) T↑,C↓;P* ↑,C↑。 加压和降温可以提高气体的溶解度,故 加压和降温有利于吸收操作;反之,升温和 减压则有利于解吸过程。 2.2.2 亨利定律 当总压不高(一般约小于 500 kPa)时,在一 定温度下,稀溶液上方汽相中溶质的平衡分 压 与液相中溶质的摩尔分数成正比,即 PA * =Ex 式中:PA * -溶质A在汽相中的平衡分压,kPa; x-液相中溶质的摩尔分数; E-亨利系数,kPa。 上式称为亨利定律。 E=f(T),T↑,E↑。 易溶气体的 E 值小,难溶气体的 E 值大。常