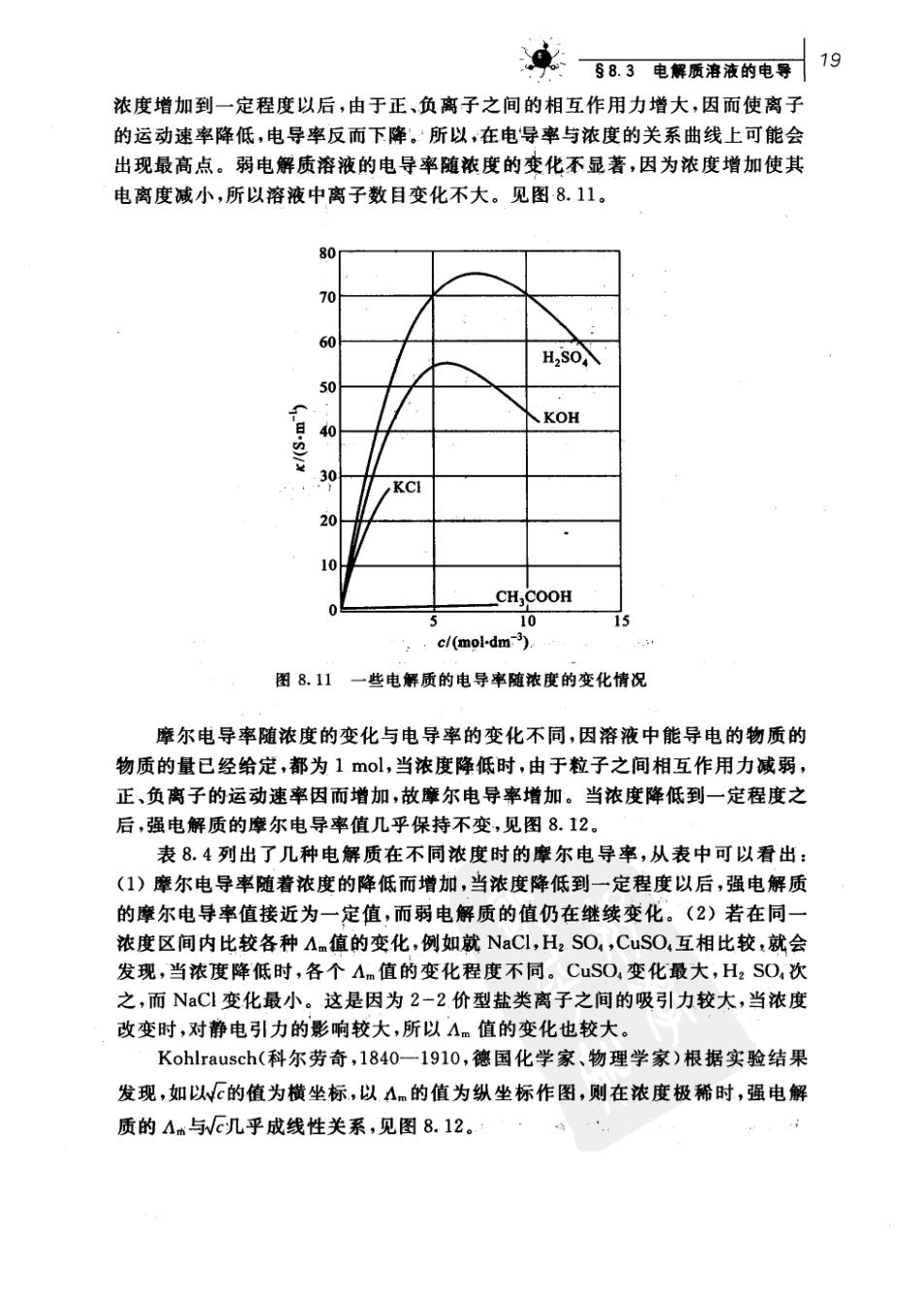
文百8日电解质语液的电导19 浓度增加到一定程度以后,由于正、负离子之间的相互作用力增大,因而使离子 的运动速率降低,电导率反而下降。所以,在电导率与浓度的关系曲线上可能会 出现最高点。弱电解质溶液的电导率随浓度的变化不显著,因为浓度增加使其 电离度减小,所以溶液中离子数目变化不大。见图8.11。 80i 、KOH % KCI CH,COOH 0 15 c/(mol-dm) 图8.11一些电解质的电导率随浓度的变化情况 摩尔电导率随浓度的变化与电导率的变化不同,因溶液中能导电的物质的 物质的量已经给定,都为1mol,当浓度降低时,由于粒子之间相互作用力减弱, 正、负离子的运动速率因而增加,故摩尔电导率增加。当浓度降低到一定程度之 后,强电解质的摩尔电导率值几乎保持不变,见图8.12。 表8.4列出了几种电解质在不同浓度时的摩尔电导率,从表中可以看出: (1)摩尔电导率随着浓度的降低而增加,当浓度降低到一定程度以后,强电解质 的摩尔电导率值接近为一定值,而弱电解质的值仍在继续变化。(2)若在同一 浓度区间内比较各种An值的变化,例如就NaCl,HzSO,CuSO,互相比较,就会 发现,当浓度降低时,各个A值的变化程度不同。CuSO,变化最大,HSO,次 之,而NaCl变化最小。这是因为2-2价型盐类离子之间的吸引力较大,当浓度 改变时,对静电引力的影响较大,所以Am值的变化也较大。 Kohlrausch(科尔劳奇,1840一1910,德国化学家、物理学家)根据实验结果 发现,如以√的值为横坐标,以A的值为纵坐标作图,则在浓度极稀时,强电解 质的A与几乎成线性关系,见图8.12
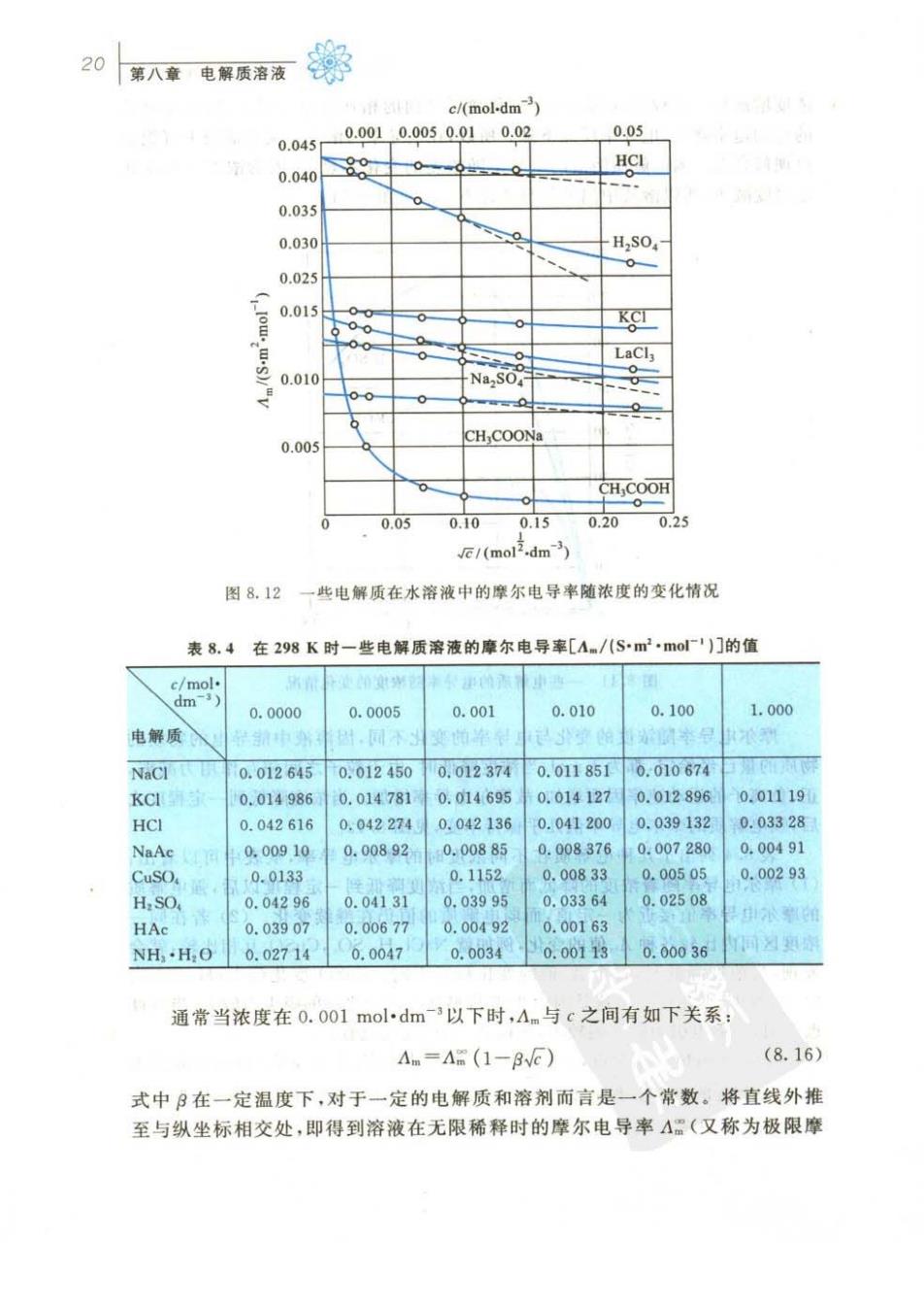
20人电质素务 e/(moldm) 0.0010.0050.010.02 0.05 0.045 0.0408o HCI 0.035 0.030 0.025 日) LaC 0.010 Na.SO 0.00 CH COON CH,COOH 0.05 0.10 0.15 0.20 0.25 (mol.dm 图8.12 一些电解质在水溶液中的摩尔电导率随浓度的变化情况 表8.4在298K时一些电解质溶液的摩尔电异率[A/八Sm2mo1)门的值 0.0000 0.0005 0.001 0.010 0.100 1.000 由解质 NaCl 0.012645 0.012450 0.012374 0.0118510.010674 KCI 0014986 0.014781 0.014695 0.014127 0.012896 0.01119 HCI 0.042616 0.0422740.042136 0.041200 0.039132 0.03328 NaA 0.00910 0.00892 0.0088 0.008376 0.007280 0.00491 CusO 0.0133 0.1152 0.00833 0.00505 0.00293 H.SO 0.04296 004131 0.03995 003364 0.02508 HAc 0.03901 0.00677 0.00492 0.00163 NH·H,O 0.02714 0.0047 0.0034 0.00113 0.00036 通常当浓度在0.001 mol.dm3以下时,Am与c之间有如下关系 Am=A(1-3V) (8.16) 式中B在一定温度下,对于一定的电解质和溶剂而言是一个常数。将直线外推 至与纵坐标相交处,即得到溶液在无限稀释时的摩尔电导率A。(又称为极限摩
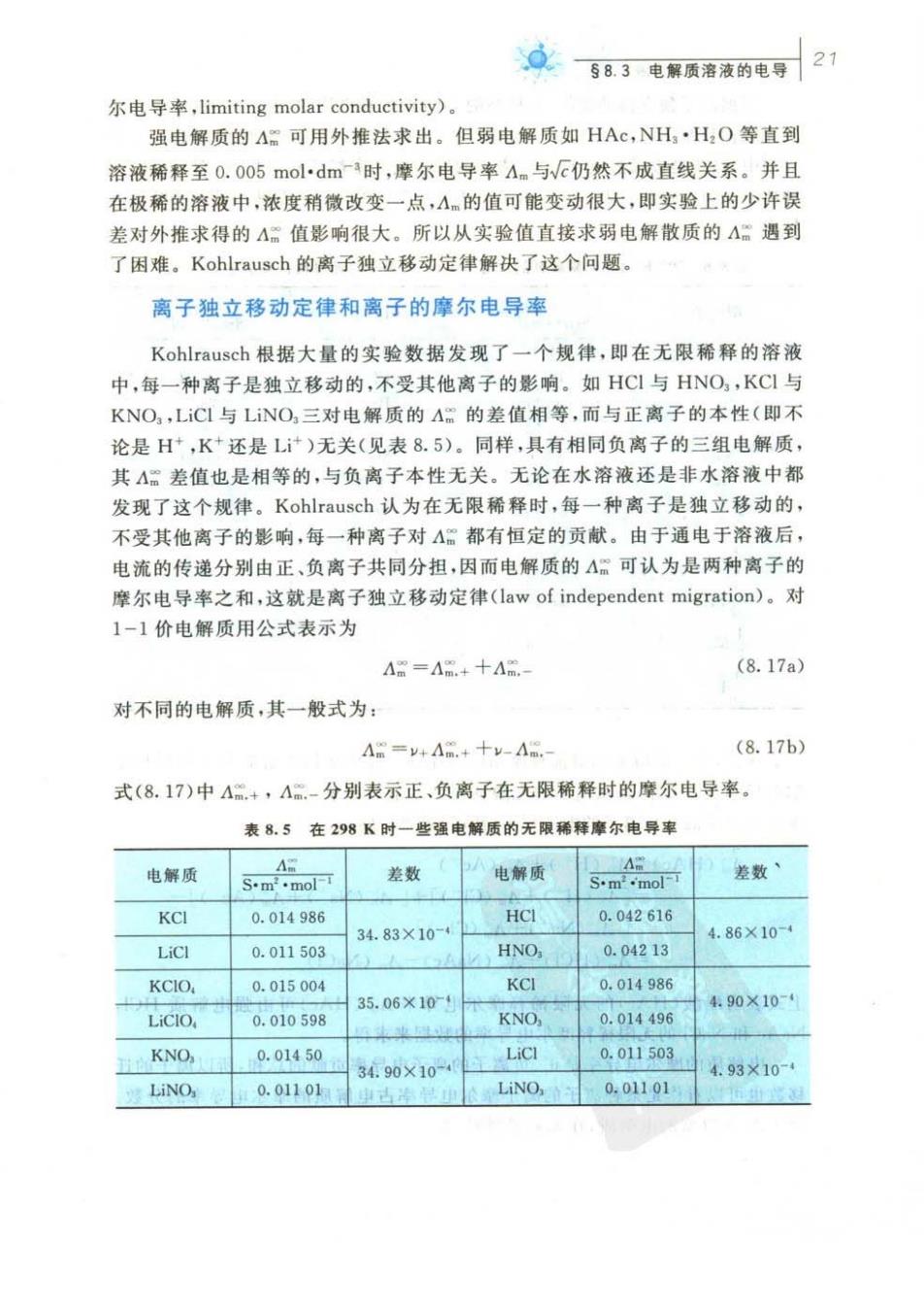
众583电解质溶液的电导21 尔电导率,limiting molar conductivity)。 强电解质的A可用外推法求出。但弱电解质如HAc,NH·HO等直到 溶液稀释至0.0o5mol·dm时,摩尔电导率4m与仍然不成直线关系。并且 在极稀的溶液中,浓度稍微改变一点,A的值可能变动很大,即实验上的少许误 差对外推求得的A:值影响很大。所以从实验值直接求弱电解散质的A:遇到 了困难。Kohlrausch的离子独立移动定律解决了这个问题, 离子独立移动定律和离子的摩尔电导率 Kohlrausch根据大量的实验数据发现了一个规律,即在无限稀释的溶液 中,每一种离子是独立移动的,不受其他离子的影响。如HC1与HNO,KC1与 KNO,LiC1与LiNO,三对电解质的A:的差值相等,而与正离子的本性(即不 论是H,K+还是L)无关(见表8.5)。同样,具有相同负离子的三组电解质, 其A需差值也是相等的,与负离子本性无关。无论在水溶液还是非水溶液中都 发现了这个规律。Kohlrausch认为在无限稀释时,每一种离子是独立移动的, 不受其他离子的影响,每一种离子对A都有恒定的贡献。由于通电于溶液后, 电流的传递分别由正、负离子共同分担,因而电解质的A。可认为是两种离子的 摩尔电导率之和,这就是离子独立移动定律(law of independent migration)。对 1-1价电解质用公式表示为 A量=Am.+十Am (8.17a) 对不同的电解质,其一般式为: Am=+Am.+十-A (8.17b) 式(8.17)中A“+,A.-分别表示正、负离子在无限稀释时的摩尔电导率。 表8.5在298K时一些强电解质的无限稀释摩尔电导率 电解质 差数 电解质 差数 KCI 0.014986 HCI 0.042616 34.83×10-4 4.86×10- LiCl 0.011503 HNO, 0.04213 KCIO, 0.015004 KCI 0.014986 35.06×10-4 4.90×10- LiCIO 0.010598 KNO, 0.014496 KNO, 0.01450 34.90X10-4 0.011503 4.93×10-4 LiNO 0.01101单古 Lino 0.01101

2八电质 根据离子独立移动定律,在极稀的HCI溶液和极稀的HAc溶液中,氢离子 的无限稀释摩尔电导率A+是相同的。也就是说,凡在一定的温度和一定的 溶剂中,只要是极稀溶液,同一种离子的摩尔电导率都是同一数值,而不论另一 种离子是何种离子。表8.6列出了一些离子在无限稀释水溶液中的离子摩尔电 导率 表8.6298K时在无限稀释的水溶液中,一些离子的无限稀释摩尔电导率A。 用离子 阴离子目 H 7349.821 OHM 198.0 L计 38.69 76.34 50.11 78.4 K 76.8 海NH时 73.4 71.44 中所Ag 61.92 CH:COO- -40.9 59.50 68.0 63.64 7s0 79.8 号sr2 D59.46 Mg' 53.06 69.6 这样,弱电解质的无限稀释摩尔电导率A”就可从强电解质的无限稀释摩 尔电导率A:求算,或从离子的无限稀释摩尔电导率求得。而离子的无限稀释 摩尔电导率值可从离子的电迁移率(淌度)求得。例如, A (HAc)=A (H)+A (Ac) =[A=(H)+A=(CI)]+[A=(Na+)+A(Ac)] [A=(Na+)+Am(C1)] =A (HCI)+A (NaAc)-Am (NaCl) 上式表明醋酸(HAc)的无限稀释摩尔电导率A(HAc)可由强电解质HCI NaAc和NaCl的无限稀释摩尔电导率的数据来求得 电解质的摩尔电导率是正、负离子的离子电导率贡献的总和,所以离子的迁 移数也可以看作是某种离子的离子摩尔电导率占电解质的摩尔电导率的分数, 对于1-1价型的电解质,在无限稀释时,有

众58.)电解质洛液的电号29 A==Am+十4m (8.18) 对于浓度不太大的强电解质溶液,设它完全解离,可近似有 Am=Am.+十Am. (8.19) t+,t-和A的值都可以由实验测得,从而就可以计算离子的摩尔电导率。 离子的摩尔电导率可由离子的电迁移率求得。设图8.6的实验中电场是均 匀的则訾在数值上等于号,又因为=“竖=:号放式(85)可写成 I=ca+A(u4十M-)5F (8.20) 已知 6片-片 将式(8.20)代入上式,并整理得: k=cxaz+(u+十u-)F 根据摩尔电导率的定义,这时电解质的浓度为xz+,所以有 K=a(u+十)F (8.21) 对无限稀释的电解质溶液,a=1,故 Am=(u罕+)F (8.22) 又因为 A=Am++Am.- 所以 A.+=uTF Am-=uF (8.23) 对于浓度不太大的强电解质溶液,设它完全解离,可近似有 An.t=utF An.-=u-F (8.24) 将式(8.24)与式(8.18)结合,可把t,u,Am.+,A-和Am几个物理量联系在 起,从而可从实验易测的量来计算实验不易测的量或未知的量。 例题有一电导池,电极的有效面积A为2×10·m2,两极片间的距离为 0.10m,电极间充以1-1价型的强电解质MN的水溶液,浓度为30molm一 两电极间的电势差E为3V,电流强度I为0.003A。已知正离子M的迁移数 t,=0.4