
18 实验七 肉制品中亚硝酸盐与硝酸盐的测定 一、亚硝酸盐测定 (一)原理:样品经沉淀蛋白质,除去脂肪后,在弱酸条件下与对氨基苯磺酸重氮化以 后,再与 N-1-萘基乙二胺偶合形成紫红色染料,与标准比较定量。 (二)试剂 1. 氯化铵缓冲液:在 1L 玻璃烧杯中,加入 500ml 水,准确加入 20ml 盐酸,混匀,准 确加入 50ml 氨水,必要时用稀盐酸和稀氨水调试至 pH9.6-9.7。 2. 硫酸锌溶液(0.42mol/L):称取 120g 硫酸锌用水溶解,并稀释至 1000ml。 3. 氢氧化钠溶液(20g/L):称取 20g 氢氧化钠用水溶解,稀释至 1000ml。 4. 对氨基苯磺酸溶液:称取 1g 对氨基苯磺酸,溶于 70ml 水和 30ml 醋酸中,置棕色瓶 中混匀,室温保存。 5. N-1-萘基乙二胺溶液:称取 0.1gN-1-萘基乙二胺,加 60%醋酸溶解,并稀释至 100ml, 混匀后,置棕色瓶中,在冰箱中保存,一周内稳定。 6. 显色剂:临用前将 N-1-萘基乙二胺和对氨基苯磺酸溶液等体积混合。 7. 亚硝酸钠标准溶液:准确称取 0.2500g 于硅胶干燥器中干燥 24h 的亚硝酸钠,加水 溶解移入 500ml 容量瓶中,加 100ml 氯化铵缓冲液,加水稀释至刻度,混匀,在 4℃避光保 存,此溶液每亳升相当于 500ug 的亚硝酸钠,作准备液。 8. 亚硝酸钠标准使用液:临用前,吸取亚硝酸钠标准溶液 1.0ml 置于 100ml 容量瓶中, 加水稀至刻度,此溶液每毫升相当于 5.0ug 亚硝酸钠。 (三)仪器:小型绞肉机,匀浆器,分光光度计。 (四)操作方法 1. 样品处理:称取约 10.0g(粮食取 5g)经绞碎混匀的样品,置于匀浆器中,加 70ml 水和 12ml 的氢氧化钠溶液,混匀,用氢氧化钠溶液调样品 pH=8,定量转移至 250ml 容量瓶 中,加 10ml 硫酸锌溶液,混匀,如不产生白色沉淀,再补加 2-5ml 氢氧化钠,混匀,置 60℃ 水浴中加热 10min,取出后冷至室温,加水至刻度,混匀。放置 0.5h,除去上层脂肪,用滤 纸过滤,弃去初滤液 20ml,收集滤液备用。 2. 测定 (1)亚硝酸盐标准曲线的制备:吸取 0、0.5,1.0,2.0,3.0,4.0,5.0ml 亚硝酸钠 标准使用液分别置于 25ml 具塞比色管中,于标准管中分别加入 4.5ml 氯化铵缓冲,加 2.5ml60%醋酸后,立即加入 5.0ml 显色剂,加水至零点,于波长 550nm 处测吸光度,绘制标 准曲线,求出回归方程。 低含量样品以制备低含量标准曲线计算,标准系列为 0,0.4,0.8,1.2,1.6,2.0ml 亚硝酸盐标准使用液(相当于 0,2,4,8,1.0 ug 亚硝酸钠) (2)样品测定:吸取 10 样品滤液于 25ml 具塞红色管中,其它试剂按标准系列法操作, 同时做试剂空白。 二、硝酸盐测定 (一)原理:样品经沉淀蛋白质,除去脂肪后,溶液通过镉柱,使其中的硝酸根离子还 原成亚硝酸根离子,在弱酸性条件下,亚硝酸根与对氨基苯磺酸重氮化后,再与 N-1-萘基 乙二胺偶合形成红色染料,测得亚硝酸盐总量,由总量减去亚硝酸盐含量即得硝酸盐含量。 (二)试剂
18 实验七 肉制品中亚硝酸盐与硝酸盐的测定 一、亚硝酸盐测定 (一)原理:样品经沉淀蛋白质,除去脂肪后,在弱酸条件下与对氨基苯磺酸重氮化以 后,再与 N-1-萘基乙二胺偶合形成紫红色染料,与标准比较定量。 (二)试剂 1. 氯化铵缓冲液:在 1L 玻璃烧杯中,加入 500ml 水,准确加入 20ml 盐酸,混匀,准 确加入 50ml 氨水,必要时用稀盐酸和稀氨水调试至 pH9.6-9.7。 2. 硫酸锌溶液(0.42mol/L):称取 120g 硫酸锌用水溶解,并稀释至 1000ml。 3. 氢氧化钠溶液(20g/L):称取 20g 氢氧化钠用水溶解,稀释至 1000ml。 4. 对氨基苯磺酸溶液:称取 1g 对氨基苯磺酸,溶于 70ml 水和 30ml 醋酸中,置棕色瓶 中混匀,室温保存。 5. N-1-萘基乙二胺溶液:称取 0.1gN-1-萘基乙二胺,加 60%醋酸溶解,并稀释至 100ml, 混匀后,置棕色瓶中,在冰箱中保存,一周内稳定。 6. 显色剂:临用前将 N-1-萘基乙二胺和对氨基苯磺酸溶液等体积混合。 7. 亚硝酸钠标准溶液:准确称取 0.2500g 于硅胶干燥器中干燥 24h 的亚硝酸钠,加水 溶解移入 500ml 容量瓶中,加 100ml 氯化铵缓冲液,加水稀释至刻度,混匀,在 4℃避光保 存,此溶液每亳升相当于 500ug 的亚硝酸钠,作准备液。 8. 亚硝酸钠标准使用液:临用前,吸取亚硝酸钠标准溶液 1.0ml 置于 100ml 容量瓶中, 加水稀至刻度,此溶液每毫升相当于 5.0ug 亚硝酸钠。 (三)仪器:小型绞肉机,匀浆器,分光光度计。 (四)操作方法 1. 样品处理:称取约 10.0g(粮食取 5g)经绞碎混匀的样品,置于匀浆器中,加 70ml 水和 12ml 的氢氧化钠溶液,混匀,用氢氧化钠溶液调样品 pH=8,定量转移至 250ml 容量瓶 中,加 10ml 硫酸锌溶液,混匀,如不产生白色沉淀,再补加 2-5ml 氢氧化钠,混匀,置 60℃ 水浴中加热 10min,取出后冷至室温,加水至刻度,混匀。放置 0.5h,除去上层脂肪,用滤 纸过滤,弃去初滤液 20ml,收集滤液备用。 2. 测定 (1)亚硝酸盐标准曲线的制备:吸取 0、0.5,1.0,2.0,3.0,4.0,5.0ml 亚硝酸钠 标准使用液分别置于 25ml 具塞比色管中,于标准管中分别加入 4.5ml 氯化铵缓冲,加 2.5ml60%醋酸后,立即加入 5.0ml 显色剂,加水至零点,于波长 550nm 处测吸光度,绘制标 准曲线,求出回归方程。 低含量样品以制备低含量标准曲线计算,标准系列为 0,0.4,0.8,1.2,1.6,2.0ml 亚硝酸盐标准使用液(相当于 0,2,4,8,1.0 ug 亚硝酸钠) (2)样品测定:吸取 10 样品滤液于 25ml 具塞红色管中,其它试剂按标准系列法操作, 同时做试剂空白。 二、硝酸盐测定 (一)原理:样品经沉淀蛋白质,除去脂肪后,溶液通过镉柱,使其中的硝酸根离子还 原成亚硝酸根离子,在弱酸性条件下,亚硝酸根与对氨基苯磺酸重氮化后,再与 N-1-萘基 乙二胺偶合形成红色染料,测得亚硝酸盐总量,由总量减去亚硝酸盐含量即得硝酸盐含量。 (二)试剂

19 1. 氯化铵缓冲溶液。 2. 硫酸镉溶液:称取 37g 硫酸镉用水溶解,稀释至 1000ml。 3. 盐酸溶液:吸取 8.4ml 浓盐酸,用水稀释至 1000ml。 4. 硝酸钠标准溶液:准确称取 0.5000g 于 110-120℃干燥恒 重的硝酸钠,加水溶解,移至 500ml 容量瓶中,加 50ml 氯化铵缓 冲液,用水稀释至刻度,混匀,在 4 度冰箱中避光,保存,此溶 液每 ml 相当于 1mg 硝酸钠。 5. 硝酸钠标准使用液:临用时吸取硝酸钠标准溶液 1ml,置于 100ml 容量瓶中,加水稀释至刻度,混匀,临用时现配,此溶液每 毫升相当于 10ug 硝酸钠。 6. 亚硝酸钠标准使用液,同一。 7. 镉柱及制备:于 500ml 硫酸镉溶液中,投入足够的锌棒经 3-4h,当其中的镉全部被锌置换后,用玻璃棒轻轻刮下,取出残余 锌棒,使镉沉淀,倾去上层清液,以水用倾斜法多次洗涤,然后移 入粉碎机中,加 500ml 水捣散约 2 秒,用水将金属细粒洗至标准筛 上,取 20-40 目之间的部分,置试剂瓶中,用水封盖保存,备用。 镉柱还原效率的测定,取 25ml 酸式滴定管数支,向柱底压入 图 4 镉柱装置图(cm) 1cm 高的玻璃棉作垫,上置一小漏斗,将新置的镉柱带水加入柱内,边装边轻敲击术,排除 柱内空气,加镉粉至 8-10cm 高,上面用 1cm 高的玻璃棉覆盖,上置一贮液漏斗。 当镉柱填装好后,先用 25ml 盐酸洗涤,再以水洗两次,每次 25ml,调节术流速度至 3-5ml/min,镉柱不用时用水封盖,随时都要保持水平面在镉层之上,不得使镉层夹有气泡。 镉柱每次使用完毕后,应先以 25ml 盐酸洗涤,再以水洗两次,每次 25 后用水覆盖镉柱。 柱先加 25ml 氯化铵缓冲液,至液面接近海绵镉时,吸取 2ml 硝酸钠标准使用液,控制流速, 用 50ml 容量瓶接收,加入 5ml 氯化铵缓冲液,液面接近海绵镉时,加入 15ml 水洗柱,还原 液和洗涤一并流入 50 容量瓶中,加 60%醋酸,10ml 显色剂,加水稀释至刻度,混匀。暗处 放置 25min,用 1cm 比色杯,以标准零管调节零点,于波长 550nm 处测吸光度,根据亚硝酸 盐标准溶液计算还原效率(如镉柱还原率小于 95%,应经盐酸浸泡活化处理)。 m3×1.232 X2= ×100 20 式中:X2——还原效率,% 20——硝酸盐的质量,ug 1.232——亚硝酸盐换算成硝酸盐的系数 (三)操作方法:经活化的镉术,先加 25ml 氯化铵缓冲液,到液面接近海绵镉时,准 确吸取样品滤液 10ml,加入镉术还原,以下按镉术还原率测定法依法操作。 (四)计算 (m5-m6)×1.232×1000 X4= ×100 m5 ×(V4/V3)×1000 式中:X4——样品中硝酸盐的含量 mg/kg m4——样品的质量 g m5——经镉粉还原后测得亚硝酸钠的总量,ug m6——直接测得亚硝酸盐的含量,ug 1.232——亚硝酸盐换算成硝酸盐的系数;
19 1. 氯化铵缓冲溶液。 2. 硫酸镉溶液:称取 37g 硫酸镉用水溶解,稀释至 1000ml。 3. 盐酸溶液:吸取 8.4ml 浓盐酸,用水稀释至 1000ml。 4. 硝酸钠标准溶液:准确称取 0.5000g 于 110-120℃干燥恒 重的硝酸钠,加水溶解,移至 500ml 容量瓶中,加 50ml 氯化铵缓 冲液,用水稀释至刻度,混匀,在 4 度冰箱中避光,保存,此溶 液每 ml 相当于 1mg 硝酸钠。 5. 硝酸钠标准使用液:临用时吸取硝酸钠标准溶液 1ml,置于 100ml 容量瓶中,加水稀释至刻度,混匀,临用时现配,此溶液每 毫升相当于 10ug 硝酸钠。 6. 亚硝酸钠标准使用液,同一。 7. 镉柱及制备:于 500ml 硫酸镉溶液中,投入足够的锌棒经 3-4h,当其中的镉全部被锌置换后,用玻璃棒轻轻刮下,取出残余 锌棒,使镉沉淀,倾去上层清液,以水用倾斜法多次洗涤,然后移 入粉碎机中,加 500ml 水捣散约 2 秒,用水将金属细粒洗至标准筛 上,取 20-40 目之间的部分,置试剂瓶中,用水封盖保存,备用。 镉柱还原效率的测定,取 25ml 酸式滴定管数支,向柱底压入 图 4 镉柱装置图(cm) 1cm 高的玻璃棉作垫,上置一小漏斗,将新置的镉柱带水加入柱内,边装边轻敲击术,排除 柱内空气,加镉粉至 8-10cm 高,上面用 1cm 高的玻璃棉覆盖,上置一贮液漏斗。 当镉柱填装好后,先用 25ml 盐酸洗涤,再以水洗两次,每次 25ml,调节术流速度至 3-5ml/min,镉柱不用时用水封盖,随时都要保持水平面在镉层之上,不得使镉层夹有气泡。 镉柱每次使用完毕后,应先以 25ml 盐酸洗涤,再以水洗两次,每次 25 后用水覆盖镉柱。 柱先加 25ml 氯化铵缓冲液,至液面接近海绵镉时,吸取 2ml 硝酸钠标准使用液,控制流速, 用 50ml 容量瓶接收,加入 5ml 氯化铵缓冲液,液面接近海绵镉时,加入 15ml 水洗柱,还原 液和洗涤一并流入 50 容量瓶中,加 60%醋酸,10ml 显色剂,加水稀释至刻度,混匀。暗处 放置 25min,用 1cm 比色杯,以标准零管调节零点,于波长 550nm 处测吸光度,根据亚硝酸 盐标准溶液计算还原效率(如镉柱还原率小于 95%,应经盐酸浸泡活化处理)。 m3×1.232 X2= ×100 20 式中:X2——还原效率,% 20——硝酸盐的质量,ug 1.232——亚硝酸盐换算成硝酸盐的系数 (三)操作方法:经活化的镉术,先加 25ml 氯化铵缓冲液,到液面接近海绵镉时,准 确吸取样品滤液 10ml,加入镉术还原,以下按镉术还原率测定法依法操作。 (四)计算 (m5-m6)×1.232×1000 X4= ×100 m5 ×(V4/V3)×1000 式中:X4——样品中硝酸盐的含量 mg/kg m4——样品的质量 g m5——经镉粉还原后测得亚硝酸钠的总量,ug m6——直接测得亚硝酸盐的含量,ug 1.232——亚硝酸盐换算成硝酸盐的系数;

20 V4——样品处理液总体积 ml, V3——测定用样液体积,ml。 结果的表述,报告算术平均值的两位有效数字。 允许差:相对相差≤10%。 三、说明 1. 根据 GB5198-84 食品中亚硝酸盐限量卫生标准规定(表 1-11): 表 1-11 肉品中亚硝酸盐限量卫生标准 品种 指标(以 NaNO2 计),mg/kg 鱼类(鲜) 3 肉类(鲜) 3 蛋类(鲜) 5 乳粉 2 GB2760-80 规定: 肉类罐头最大使用量 0.50g/kg,残留量≤50mg/kg; 肉制品 0.15g/kg,残留量≤30mg/kg; 净肉制盐水火腿残留量≤70mg/kg; 2. 本方法亚硝酸盐方法检出限为 1mg/kg,硝酸盐方法检出限为 1.4mg/kg 3. 硝酸盐和亚硝酸盐是食品添加剂中发色剂,添加在制品中后转化为亚硝酸,它极易 分解出亚硝基,与肌红蛋白反应生成鲜艳的亮红色的亚硝基血色原,从而赋予食品鲜艳的红 色,另外,亚硝酸盐对抑制微生物增殖有一定作用,与食盐并用,可增加抑菌,对肉毒梭状 芽孢杆菌有特殊抑制作用。 4. 亚硝酸盐摄入量过多会对人体产生毒害作用。在 pH6.0-7.0 从-18-22℃温度范围内, 亚硝酸盐与仲胺反应生成亚硝胺,具有致癌作用,已得到公认,另外误食亚硝酸钠为食盐在 国内也屡屡发生,过多地摄入亚硝酸盐会引起正常血红蛋白转变为高铁血红蛋白,而失去携 氧功能,导致组织缺氧,引起肠原性青紫症。 5. 硫酸锌溶液,在 pH=8.0 产生氢氧化锌是蛋白质沉淀剂,这是 GB/T5009.33-1996 方 法和过去 GB5009.33-85 不同的地方,后者采用亚铁氢化钾和乙酸锌溶液,产生亚铁氰化锌 沉淀与蛋白质产生共沉淀,另还应饱和硼砂溶液,也是蛋白质沉淀剂。 6. 显色反应式 镉柱还原可定量地将 NO3 -还原成 NO2 - Cd+ NO3 - → CdO+ NO2 - 镉柱经使用后,用稀盐酸除去表面氧化镉可重新使用 CdO+2HCl → CdCl2+H2O
20 V4——样品处理液总体积 ml, V3——测定用样液体积,ml。 结果的表述,报告算术平均值的两位有效数字。 允许差:相对相差≤10%。 三、说明 1. 根据 GB5198-84 食品中亚硝酸盐限量卫生标准规定(表 1-11): 表 1-11 肉品中亚硝酸盐限量卫生标准 品种 指标(以 NaNO2 计),mg/kg 鱼类(鲜) 3 肉类(鲜) 3 蛋类(鲜) 5 乳粉 2 GB2760-80 规定: 肉类罐头最大使用量 0.50g/kg,残留量≤50mg/kg; 肉制品 0.15g/kg,残留量≤30mg/kg; 净肉制盐水火腿残留量≤70mg/kg; 2. 本方法亚硝酸盐方法检出限为 1mg/kg,硝酸盐方法检出限为 1.4mg/kg 3. 硝酸盐和亚硝酸盐是食品添加剂中发色剂,添加在制品中后转化为亚硝酸,它极易 分解出亚硝基,与肌红蛋白反应生成鲜艳的亮红色的亚硝基血色原,从而赋予食品鲜艳的红 色,另外,亚硝酸盐对抑制微生物增殖有一定作用,与食盐并用,可增加抑菌,对肉毒梭状 芽孢杆菌有特殊抑制作用。 4. 亚硝酸盐摄入量过多会对人体产生毒害作用。在 pH6.0-7.0 从-18-22℃温度范围内, 亚硝酸盐与仲胺反应生成亚硝胺,具有致癌作用,已得到公认,另外误食亚硝酸钠为食盐在 国内也屡屡发生,过多地摄入亚硝酸盐会引起正常血红蛋白转变为高铁血红蛋白,而失去携 氧功能,导致组织缺氧,引起肠原性青紫症。 5. 硫酸锌溶液,在 pH=8.0 产生氢氧化锌是蛋白质沉淀剂,这是 GB/T5009.33-1996 方 法和过去 GB5009.33-85 不同的地方,后者采用亚铁氢化钾和乙酸锌溶液,产生亚铁氰化锌 沉淀与蛋白质产生共沉淀,另还应饱和硼砂溶液,也是蛋白质沉淀剂。 6. 显色反应式 镉柱还原可定量地将 NO3 -还原成 NO2 - Cd+ NO3 - → CdO+ NO2 - 镉柱经使用后,用稀盐酸除去表面氧化镉可重新使用 CdO+2HCl → CdCl2+H2O

21 7. 氨缓冲液除控制溶液的 pH 条件外,又可缓解镉对亚硝酸根的还原,还可作为络合剂, 以防止反应生成的 Cd2+与 OH-形成沉淀。 8. 在制取海绵状镉和装镉术时最好在水中进行,勿使镉粒暴露于空气中以免氧化,每 次使用完毕后,应先以 25ml0.1mol/L 盐酸洗涤,再以水洗两次,每次 25ml,最后用水覆盖 镉信,镉柱还原率应当经常检查。 9. 本法是国家标准食品中亚硝酸盐和硝酸盐的测定方法(GB/T5009.33-1996)。 实验八 肉及肉制品中肉毒梭菌和肉毒毒素的检验 肉毒梭菌广泛分布于自然界特别是土壤中,易于污染食品,于适宜条件下可在食品中 产生毒性极强的嗜神经性毒素,能引起以神经麻痹为主要症状且病死度甚高的食品中毒。婴 儿肉毒中毒虽属感染型中毒,但中毒原因有时也与食品或餐具肉毒梭菌污染有关。故检验食 品特别是不经加热处理而直接食用的食品中有无肉毒毒素或肉毒梭菌,至为重要。 肉毒梭毒为专性厌氧的革兰氏阳性的粗大杆菌,形成近端位的卵圆形芽孢,在庖肉培 养基中生长时,混浊、产气、发散奇臭,有的能消化肉渣。 肉毒梭菌按其所产毒素的抗原特异性分为 A、B、C、D、E、F、G 等七个型,故肉毒梭 菌的检验目标主要是其毒素,不论食品中的肉毒毒素检验或肉毒梭菌的检验,均以毒素的检 测及定型试验为判定的主要依据。 一、设备和材料 1. 均质器;2. 离心机及离心管;3. 温箱:30℃,35℃,37℃ 4. 显微镜;5. 吸管 1ml,10ml6. 注射器:1ml;7. 平皿 8. 接种环;9. 小白鼠:15-20 只;10. 载玻片; 11. 厌氧培养装置:常温催化除氧式或碱性焦性没食子酸除氧式。 二、培养基和试剂 1. 庖肉培养基; 2. 卵黄琼脂培养基; 3. 明胶磷酸盐缓冲液 4. 肉毒分型抗毒诊断血清;5. 胰酶:活力 1:250 6. 革兰氏染色液 三、检验程序
21 7. 氨缓冲液除控制溶液的 pH 条件外,又可缓解镉对亚硝酸根的还原,还可作为络合剂, 以防止反应生成的 Cd2+与 OH-形成沉淀。 8. 在制取海绵状镉和装镉术时最好在水中进行,勿使镉粒暴露于空气中以免氧化,每 次使用完毕后,应先以 25ml0.1mol/L 盐酸洗涤,再以水洗两次,每次 25ml,最后用水覆盖 镉信,镉柱还原率应当经常检查。 9. 本法是国家标准食品中亚硝酸盐和硝酸盐的测定方法(GB/T5009.33-1996)。 实验八 肉及肉制品中肉毒梭菌和肉毒毒素的检验 肉毒梭菌广泛分布于自然界特别是土壤中,易于污染食品,于适宜条件下可在食品中 产生毒性极强的嗜神经性毒素,能引起以神经麻痹为主要症状且病死度甚高的食品中毒。婴 儿肉毒中毒虽属感染型中毒,但中毒原因有时也与食品或餐具肉毒梭菌污染有关。故检验食 品特别是不经加热处理而直接食用的食品中有无肉毒毒素或肉毒梭菌,至为重要。 肉毒梭毒为专性厌氧的革兰氏阳性的粗大杆菌,形成近端位的卵圆形芽孢,在庖肉培 养基中生长时,混浊、产气、发散奇臭,有的能消化肉渣。 肉毒梭菌按其所产毒素的抗原特异性分为 A、B、C、D、E、F、G 等七个型,故肉毒梭 菌的检验目标主要是其毒素,不论食品中的肉毒毒素检验或肉毒梭菌的检验,均以毒素的检 测及定型试验为判定的主要依据。 一、设备和材料 1. 均质器;2. 离心机及离心管;3. 温箱:30℃,35℃,37℃ 4. 显微镜;5. 吸管 1ml,10ml6. 注射器:1ml;7. 平皿 8. 接种环;9. 小白鼠:15-20 只;10. 载玻片; 11. 厌氧培养装置:常温催化除氧式或碱性焦性没食子酸除氧式。 二、培养基和试剂 1. 庖肉培养基; 2. 卵黄琼脂培养基; 3. 明胶磷酸盐缓冲液 4. 肉毒分型抗毒诊断血清;5. 胰酶:活力 1:250 6. 革兰氏染色液 三、检验程序
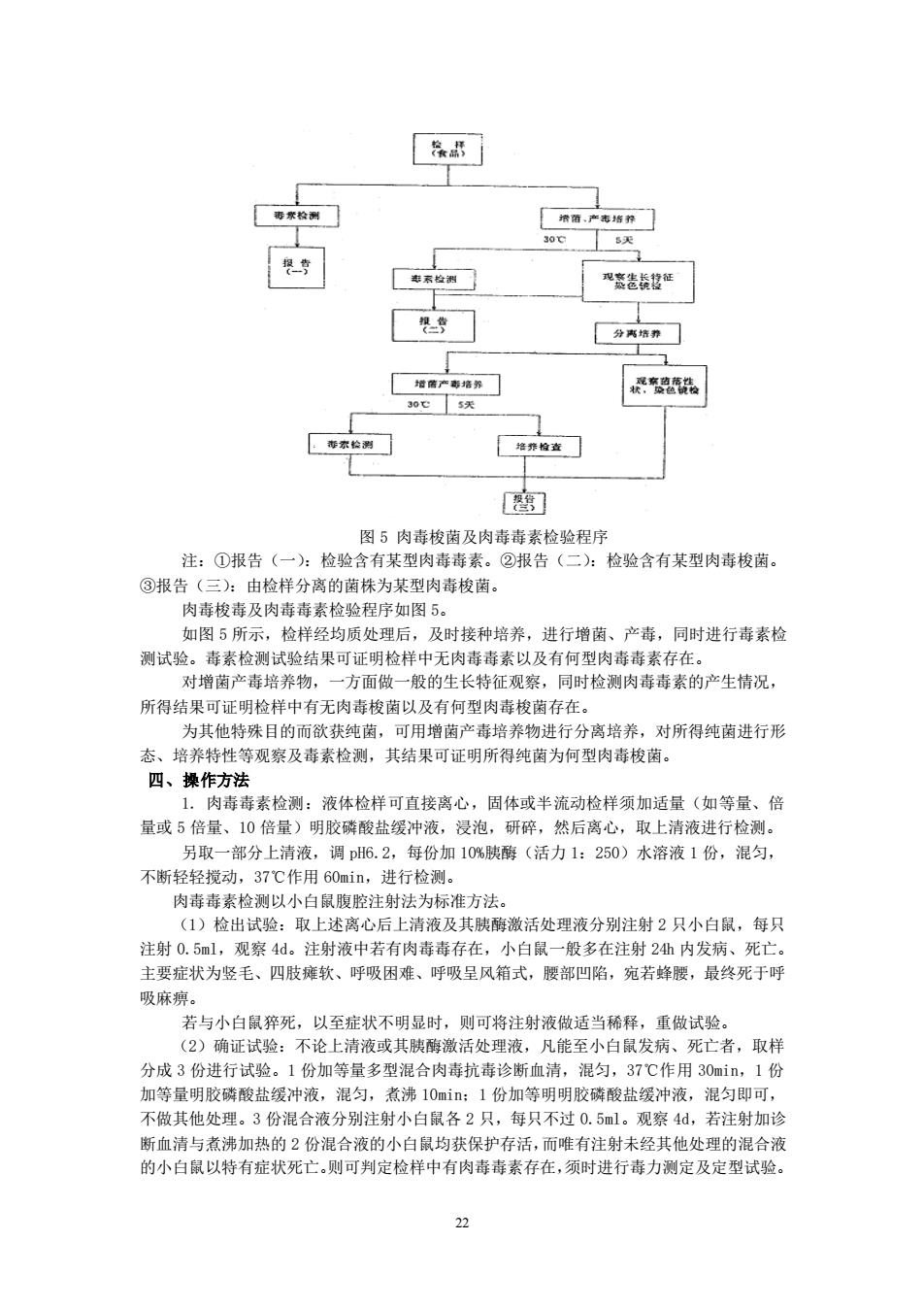
22 图 5 肉毒梭菌及肉毒毒素检验程序 注:①报告(一):检验含有某型肉毒毒素。②报告(二):检验含有某型肉毒梭菌。 ③报告(三):由检样分离的菌株为某型肉毒梭菌。 肉毒梭毒及肉毒毒素检验程序如图 5。 如图 5 所示,检样经均质处理后,及时接种培养,进行增菌、产毒,同时进行毒素检 测试验。毒素检测试验结果可证明检样中无肉毒毒素以及有何型肉毒毒素存在。 对增菌产毒培养物,一方面做一般的生长特征观察,同时检测肉毒毒素的产生情况, 所得结果可证明检样中有无肉毒梭菌以及有何型肉毒梭菌存在。 为其他特殊目的而欲获纯菌,可用增菌产毒培养物进行分离培养,对所得纯菌进行形 态、培养特性等观察及毒素检测,其结果可证明所得纯菌为何型肉毒梭菌。 四、操作方法 1. 肉毒毒素检测:液体检样可直接离心,固体或半流动检样须加适量(如等量、倍 量或 5 倍量、10 倍量)明胶磷酸盐缓冲液,浸泡,研碎,然后离心,取上清液进行检测。 另取一部分上清液,调 pH6.2,每份加 10%胰酶(活力 1:250)水溶液 1 份,混匀, 不断轻轻搅动,37℃作用 60min,进行检测。 肉毒毒素检测以小白鼠腹腔注射法为标准方法。 (1)检出试验:取上述离心后上清液及其胰酶激活处理液分别注射 2 只小白鼠,每只 注射 0.5ml,观察 4d。注射液中若有肉毒毒存在,小白鼠一般多在注射 24h 内发病、死亡。 主要症状为竖毛、四肢瘫软、呼吸困难、呼吸呈风箱式,腰部凹陷,宛若蜂腰,最终死于呼 吸麻痹。 若与小白鼠猝死,以至症状不明显时,则可将注射液做适当稀释,重做试验。 (2)确证试验:不论上清液或其胰酶激活处理液,凡能至小白鼠发病、死亡者,取样 分成 3 份进行试验。1 份加等量多型混合肉毒抗毒诊断血清,混匀,37℃作用 30min,1 份 加等量明胶磷酸盐缓冲液,混匀,煮沸 10min;1 份加等明明胶磷酸盐缓冲液,混匀即可, 不做其他处理。3 份混合液分别注射小白鼠各 2 只,每只不过 0.5ml。观察 4d,若注射加诊 断血清与煮沸加热的 2 份混合液的小白鼠均获保护存活,而唯有注射未经其他处理的混合液 的小白鼠以特有症状死亡。则可判定检样中有肉毒毒素存在,须时进行毒力测定及定型试验
22 图 5 肉毒梭菌及肉毒毒素检验程序 注:①报告(一):检验含有某型肉毒毒素。②报告(二):检验含有某型肉毒梭菌。 ③报告(三):由检样分离的菌株为某型肉毒梭菌。 肉毒梭毒及肉毒毒素检验程序如图 5。 如图 5 所示,检样经均质处理后,及时接种培养,进行增菌、产毒,同时进行毒素检 测试验。毒素检测试验结果可证明检样中无肉毒毒素以及有何型肉毒毒素存在。 对增菌产毒培养物,一方面做一般的生长特征观察,同时检测肉毒毒素的产生情况, 所得结果可证明检样中有无肉毒梭菌以及有何型肉毒梭菌存在。 为其他特殊目的而欲获纯菌,可用增菌产毒培养物进行分离培养,对所得纯菌进行形 态、培养特性等观察及毒素检测,其结果可证明所得纯菌为何型肉毒梭菌。 四、操作方法 1. 肉毒毒素检测:液体检样可直接离心,固体或半流动检样须加适量(如等量、倍 量或 5 倍量、10 倍量)明胶磷酸盐缓冲液,浸泡,研碎,然后离心,取上清液进行检测。 另取一部分上清液,调 pH6.2,每份加 10%胰酶(活力 1:250)水溶液 1 份,混匀, 不断轻轻搅动,37℃作用 60min,进行检测。 肉毒毒素检测以小白鼠腹腔注射法为标准方法。 (1)检出试验:取上述离心后上清液及其胰酶激活处理液分别注射 2 只小白鼠,每只 注射 0.5ml,观察 4d。注射液中若有肉毒毒存在,小白鼠一般多在注射 24h 内发病、死亡。 主要症状为竖毛、四肢瘫软、呼吸困难、呼吸呈风箱式,腰部凹陷,宛若蜂腰,最终死于呼 吸麻痹。 若与小白鼠猝死,以至症状不明显时,则可将注射液做适当稀释,重做试验。 (2)确证试验:不论上清液或其胰酶激活处理液,凡能至小白鼠发病、死亡者,取样 分成 3 份进行试验。1 份加等量多型混合肉毒抗毒诊断血清,混匀,37℃作用 30min,1 份 加等量明胶磷酸盐缓冲液,混匀,煮沸 10min;1 份加等明明胶磷酸盐缓冲液,混匀即可, 不做其他处理。3 份混合液分别注射小白鼠各 2 只,每只不过 0.5ml。观察 4d,若注射加诊 断血清与煮沸加热的 2 份混合液的小白鼠均获保护存活,而唯有注射未经其他处理的混合液 的小白鼠以特有症状死亡。则可判定检样中有肉毒毒素存在,须时进行毒力测定及定型试验