
蛋白质(Proteir)是生物体的基本组成成份。在人体内蛋白质的含量很多,约占人体固体成分的45%,它的分布很广,几乎所有的器官组织 都含蛋白质,并且它又与所有的生命活动密切联系。例如,机体新陈代谢过程中的一系列化学反应几乎都依赖于生物催化剂·酶的作用,而本 科的质就是蛋白质:调节物质代谢的激素有许多也是蛋白质或它的衍生物:其它诸如肌肉的收缩,血液的凝固,免疫功能,组织修复以及生 长、繁殖等主要功能无一不与蛋白质相关。近代分子生物学的研究表明,蛋白质在遗传信息的控制、细胞膜的通透性、神经冲动的发生和传导 以及高等动物的记忆等方面都起着重要的作用。 第一节蛋白质分子的组成 一、蛋白质的元素组成 单纯蛋白质的元素组成为碳50~55%、氢6%~7%、氧19%~24%、氨13%~19%,除此之外还有硫0~4%。有的蛋白质含有磷、碘。少数 含铁、铜、锌、锰、钴、钼等金属元素。 各种蛋白质的含氮量很接近,平均为16%。由于体内组织的主要含氨物是蛋白质,因此,只要测定生物样品中的氨含量,就可以按下式推 算出蛋白质大致含量。 每克样品中含氮克数×6.25×100=100克样品中蛋白质含量(克%) 二、蛋白质的基本组成单位—氨基酸 蛋白质可以受酸、碱或酶的作用而水解。例如,一种单纯蛋白质用6盐酸在真空下110℃水解约16小时,可达到完全水解(酸水解的条件 下,色氨酸、酪氨酸易被破坏)。利用层析等手段分析水解液,就可证明组成蛋白质分子的基本单位是氨基酸。构成天然蛋白质的氨基酸共20 种。 这些氨基酸为L-a-氨基酸(L-a-amino acid),其结构通式如下 COO- C00 H;N+-C-H HC—N+H R R L-口-氨基酸 D-氮基酸 生物界中也发现一些D系氨基酸,主要存在于某些抗菌素以及个别植物的生物碱中。 三、氨基酸的分类 组成蛋白质的氨基酸按其α-碳原子上侧链R的结构分为20种,20种氨基酸按R的结构和极性的不同有以下两种分类方法。 (一)根据R的结构不同分类(见表1-1):
蛋白质(Protein)是生物体的基本组成成份。在人体内蛋白质的含量很多,约占人体固体成分的45%,它的分布很广,几乎所有的器官组织 都含蛋白质,并且它又与所有的生命活动密切联系。例如,机体新陈代谢过程中的一系列化学反应几乎都依赖于生物催化剂-酶的作用,而本 科的质就是蛋白质;调节物质代谢的激素有许多也是蛋白质或它的衍生物;其它诸如肌肉的收缩,血液的凝固,免疫功能,组织修复以及生 长、繁殖等主要功能无一不与蛋白质相关。近代分子生物学的研究表明,蛋白质在遗传信息的控制、细胞膜的通透性、神经冲动的发生和传导 以及高等动物的记忆等方面都起着重要的作用。 第一节 蛋白质分子的组成 一、蛋白质的元素组成 单纯蛋白质的元素组成为碳50~55%、氢6%~7%、氧19%~24%、氮13%~19%,除此之外还有硫0~4%。有的蛋白质含有磷、碘。少数 含铁、铜、锌、锰、钴、钼等金属元素。 各种蛋白质的含氮量很接近,平均为16%。由于体内组织的主要含氮物是蛋白质,因此,只要测定生物样品中的氮含量,就可以按下式推 算出蛋白质大致含量。 每克样品中含氮克数×6.25×100=100克样品中蛋白质含量(克%) 二、蛋白质的基本组成单位——氨基酸 蛋白质可以受酸、碱或酶的作用而水解。例如,一种单纯蛋白质用6N盐酸在真空下110℃水解约16小时,可达到完全水解(酸水解的条件 下,色氨酸、酪氨酸易被破坏)。利用层析等手段分析水解液,就可证明组成蛋白质分子的基本单位是氨基酸。构成天然蛋白质的氨基酸共20 种。 这些氨基酸为L-α-氨基酸(L-α-amino acid),其结构通式如下: 生物界中也发现一些D系氨基酸,主要存在于某些抗菌素以及个别植物的生物碱中。 三、氨基酸的分类 组成蛋白质的氨基酸按其α-碳原子上侧链R的结构分为20种,20种氨基酸按R的结构和极性的不同有以下两种分类方法。 (一)根据R的结构不同分类(见表1-1):
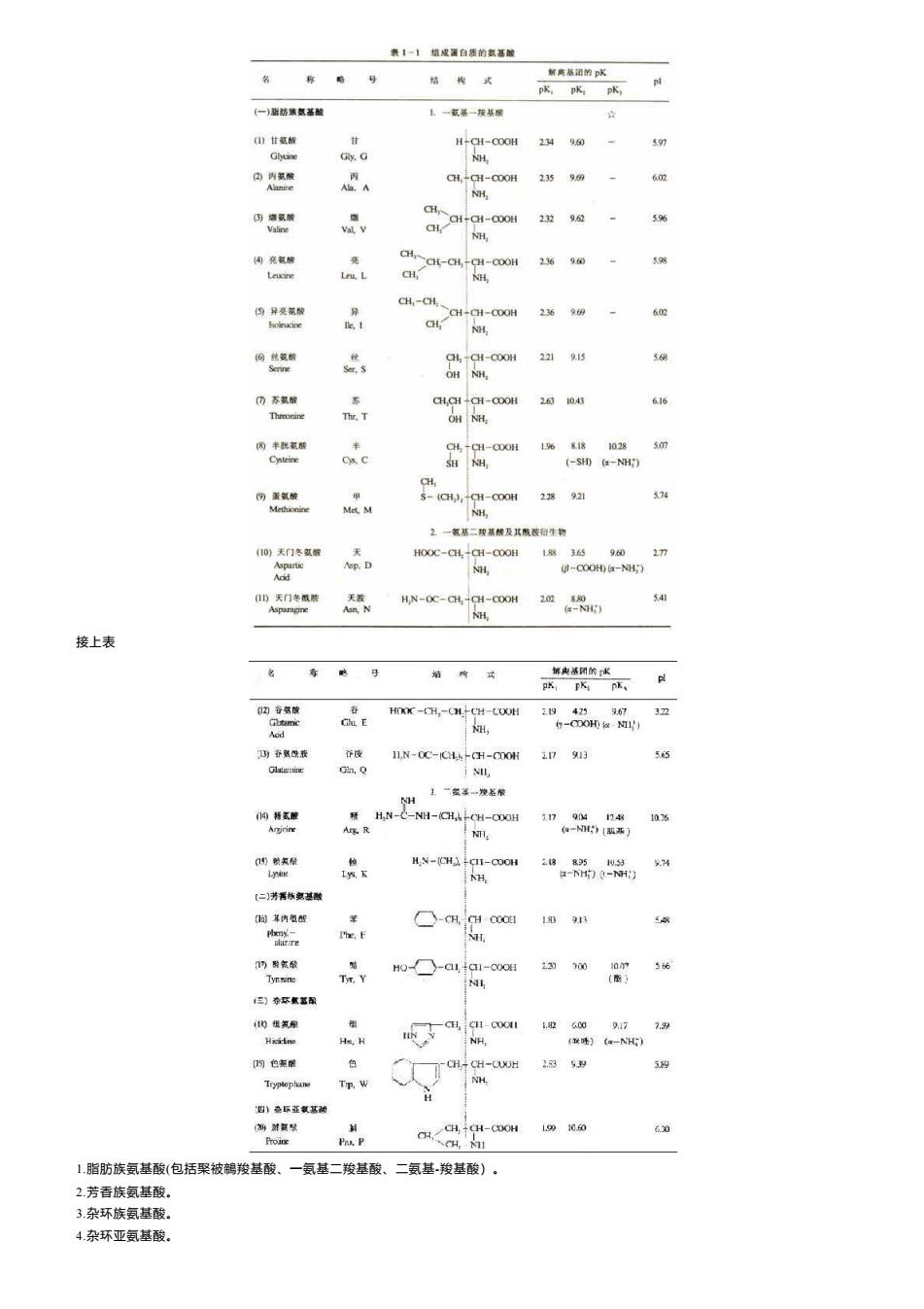
表1一1城成灌白质的氢基酸 名 称 新商基团的pK 结 式 pK.pKa pK, (一)脂防装氨基酸 1.一基一拔基 目)甘氢酸 H-CH-COOH 234960 597 Ghune Gly,G NH, 内丙家酸 CH,-CH-COOH 2359m 60m H )德氨酸 C-00 23296位 59% Valine Val,V al, NH. --0H 23站。90 59g Les.L CH NH, CH,-CH. 的异亮蒸酸 异 CH-CH-COOH 236 9明 602 Ie, GL NH, CH,-CH-COOH 2219 OH ⑦苏氢酸 CH,CH +CH-COOH 2位04 616 Thronine Thr.T OH NH, 半 CH,-CH-COOH 1681塔 1028 50m Cysteine Cs.C SH NH -sa-NH 份藏氢酸 甲 S-(CH,):+CH-COOH 21珠921 574 Methionine Met,M H 2一氯基二攻基酸及其酸蔽和生物 (10)天门冬氢酸 HOOC-CH,+CH-C0OH 183659602 Aop.D NH (-COOH)(-NH:) D天门冬酰 H.N-OC-CH,+CH-COOH 202 54 NH, 接上表 解脚基闭的K 0的音氢酸 HOXK-CH,-CH.-CH-COOH 29425673卫 Gl E NH, h-D0H1与 Aod 因香氨我 夺股 II,N-OC-ICH -CH-COOH 17913 55 Glale山 Gn,Q 王.一盆萃一发左袋 H 问转氨醛 #H.N-C-NH-(CH-CH-C0OH 1179M n48 1036 Argirine Arg.R NH. (a-N》1题器) )额氯限 H.N-(CH)CII-COOH 288351059 失74 Lyin IW.下 NH. a-H时)0-丽) 【二芳香栋氨基磁 们问时养内氢征 Phxmny- ☐-aqcc 1313 Phe. darre 门醉氢酸 H0☐-a1a-oooE 230300 56 Tx.Y NL 整 但)种本氯驱军 的组氧种 -CH,q1-C001 600917 7.9 He,H NH, (跳)《e-NH) 口均色泰酿 -CH CH-CUUH 2.53 5型 Tryplephine Tp,W H 四)杂环亚氢基葡 新游氨发 CH./CH CH-COOH 1.991060 630 Proine Pro.P 1.脂肪族氨基酸(包括聚被鹤羧基酸、一氨基二羧基酸、二氨基羧基酸)。 2.芳香族氨基酸。 3.杂环族氨基酸。 4.杂环亚氨基酸
接上表 1.脂肪族氨基酸(包括棸被鶙羧基酸、一氨基二羧基酸、二氨基-羧基酸)。 2.芳香族氨基酸。 3.杂环族氨基酸。 4.杂环亚氨基酸

(二)根据侧链R的极性不同分为非极性和极性氨基酸 氨基酸的R基团不带电荷或极性极微弱的属于非极性中性氨基酸,如:甘氨酸、丙氨酸、缬氨酸、亮氨酸、异亮氨酸、蛋氨酸、苯丙氨 酸、色氨酸、脯氨酸。它们的R基团具有疏水性。 氨基酸的R基团带电荷或有极性的属于极性氨基酸,它们又可分为: (1)极性中性氨基酸:R基团有极性,但不解离,或仅极弱地解离,它们的R基团有亲水性。如:丝氨酸、苏氨酸、半胱氨酸、酪氨酸、谷 氨酰胺、天门冬酰胺。 (2)酸性氨基酸:R基团有极性,且解离,在中性溶液中显酸性,亲水性强。如天门冬氨酸、谷氨酸。 (仔)碱性氨基酸:R基团有极性,且解离,在中性溶液中显碱性,亲水性强。如组氨酸、赖氨酸、精氨酸。 这20种氨基酸都有各自的遗传密码,它们是生物合成蛋白质的构件,无种属差异。在体内,一些特殊蛋白质分子中还含有其它氨基酸,如 甲状腺球蛋白中碘代酪氨酸,胶原蛋白中的羟脯氨酸及羟赖氨酸,某些蛋白质分子中的胱氨酸等,它们都是在蛋白质生物合成之后(或合成过 程中),相应的氨基酸残基被修饰形成的。还有的是在物质代谢过程中产生,如鸟氨酸(由精氨酸转变来的等,这些氨基酸在生物体内都没有相 应的遗传密码。 第二节 蛋白质分子中氨基酸的连接方式 在蛋白质分子中,氨基酸之间是以肽键(peptide bond)相连的。肽键就是一个氨基酸的a-羧基与另一个氨基酸的a-氨基脱水缩合形成的键。 0 NH-CH-C-OH+H-N-CH-COOH-HONH-CH-C-N+CH-COOH R H R R.HR; 氨基酸之间通过肽键联结起来的化合物称为肽(peptide)。两个氨基酸形成的肽叫二肽,三个氨基酸形成的肽叫三肽,十个氨基酸形成 的肽叫十肽,一般将十肽以下称为寡肽(oligopeptide),以上者称多肽(polypeptide)或称多肽链。 组成多肽链的氨基酸在相互结合时,失去了一分子水,因此把多肽中的氨基酸单位称为氨基酸残基(amino acid residue). 在多肽链中,肽链的一端保留着一个α·氨基,另一端保留一个α·羧基,带α·氨基的未端称氨基末端(N端):带a·羧基的末端称羧基末 端(C端)。书写多肽链时可用略号,N端写于左侧,用H?做标帆,C端于右侧用桹H表示。肽详细命名时为×酰×酰×酸。 ·甘·异,缬谷胺·半·半·苏·丝·异…半…丝…天胺0H 或者 H.Gly.lle.Val.Gin Cys+Cys.ThrSer lleCys.Ser.Asn-OH 例如谷胱甘肽是由谷氨酸、半胱复酸和甘氨酸三个氨基酸所组成的三肽,全名是y·谷氨酰半胱氨酰甘氨酸,简称谷胱甘肽(glutachione,.简 写GSH)。其中N未端的谷氨酸是通过y·羧基与半胱氨酸的氨基相连,这是一个例外。 COOH CH,SH HN-CH-CH,-CH,-CO-NH-CH-CO-NH-CH2-COOH ¥一谷氨碳 半胱氨酰 甘氢酸 容脱甘肽 第三节蛋白质的结构及其功能 蛋白质为生物高分子物质之一,具有三维空间结构,因而执行复杂的生物学功能。蛋白质结构与功能之间的关系非常密切。在研究中,一 般将蛋白质分子的结构分为一级结构与空间结构两类。 一、蛋白质的一级结构 蛋白质的一级结构(primarystructure)就是蛋白质多肽链中氨基酸残基的排列顺序(sequence),也是蛋白质最基本的结构。它是由基因上遗 传密码的排列顺序所决定的。各种氨基酸按遗传密码的顺序,通过肽键连接起来,成为多肽链,故肽键是蛋白质结构中的主键。 迄今已有约一千种左右蛋白质的一级结构被研究确定,如胰岛素,胰核糖核酸酶、胰蛋白酶等。 蛋白质的一级结构决定了蛋白质的二级、三级等高级结构,成百亿的天然蛋白质各有其特殊的生物学活性,决定每一种蛋白质的生物学活 性的结构特点,首先在于其肽链的氨基酸序列,由于组成蛋白质的20种氨基酸各具特殊的侧链,侧链基团的理化性质和空间排布各不相同,当 它们按照不同的序列关系组合时,就可形成多种多样的空间结构和不同生物学活性的蛋白质分子
(二)根据侧链R的极性不同分为非极性和极性氨基酸 氨基酸的R基团不带电荷或极性极微弱的属于非极性中性氨基酸,如:甘氨酸、丙氨酸、缬氨酸、亮氨酸、异亮氨酸、蛋氨酸、苯丙氨 酸、色氨酸、脯氨酸。它们的R基团具有疏水性。 氨基酸的R基团带电荷或有极性的属于极性氨基酸,它们又可分为: (1)极性中性氨基酸:R基团有极性,但不解离,或仅极弱地解离,它们的R基团有亲水性。如:丝氨酸、苏氨酸、半胱氨酸、酪氨酸、谷 氨酰胺、天门冬酰胺。 (2)酸性氨基酸:R基团有极性,且解离,在中性溶液中显酸性,亲水性强。如天门冬氨酸、谷氨酸。 (3)碱性氨基酸:R基团有极性,且解离,在中性溶液中显碱性,亲水性强。如组氨酸、赖氨酸、精氨酸。 这20种氨基酸都有各自的遗传密码,它们是生物合成蛋白质的构件,无种属差异。在体内,一些特殊蛋白质分子中还含有其它氨基酸,如 甲状腺球蛋白中碘代酪氨酸,胶原蛋白中的羟脯氨酸及羟赖氨酸,某些蛋白质分子中的胱氨酸等,它们都是在蛋白质生物合成之后(或合成过 程中),相应的氨基酸残基被修饰形成的。还有的是在物质代谢过程中产生,如鸟氨酸(由精氨酸转变来的等,这些氨基酸在生物体内都没有相 应的遗传密码。 第二节 蛋白质分子中氨基酸的连接方式 在蛋白质分子中,氨基酸之间是以肽键(peptide bond)相连的。肽键就是一个氨基酸的α-羧基与另一个氨基酸的α-氨基脱水缩合形成的键。 氨基酸之间通过肽键联结起来的化合物称为肽(peptide)。两个氨基酸形成的肽叫二肽,三个氨基酸形成的肽叫三肽……,十个氨基酸形成 的肽叫十肽,一般将十肽以下称为寡肽(oligopeptide),以上者称多肽(polypeptide)或称多肽链。 组成多肽链的氨基酸在相互结合时,失去了一分子水,因此把多肽中的氨基酸单位称为氨基酸残基(amino acid residue)。 在多肽链中,肽链的一端保留着一个α-氨基,另一端保留一个α-羧基,带α-氨基的末端称氨基末端(N端);带α-羧基的末端称羧基末 端(C端)。书写多肽链时可用略号,N端写于左侧,用H?做标帜,C端于右侧用桹H表示。肽详细命名时为××酰××酰……××酸。 例如谷胱甘肽是由谷氨酸、半胱氨酸和甘氨酸三个氨基酸所组成的三肽,全名是γ-谷氨酰半胱氨酰甘氨酸,简称谷胱甘肽(glutachione,简 写GSH)。其中N末端的谷氨酸是通过γ-羧基与半胱氨酸的氨基相连,这是一个例外。 第三节 蛋白质的结构及其功能 蛋白质为生物高分子物质之一,具有三维空间结构,因而执行复杂的生物学功能。蛋白质结构与功能之间的关系非常密切。在研究中,一 般将蛋白质分子的结构分为一级结构与空间结构两类。 一、蛋白质的一级结构 蛋白质的一级结构(primarystructure)就是蛋白质多肽链中氨基酸残基的排列顺序(sequence),也是蛋白质最基本的结构。它是由基因上遗 传密码的排列顺序所决定的。各种氨基酸按遗传密码的顺序,通过肽键连接起来,成为多肽链,故肽键是蛋白质结构中的主键。 迄今已有约一千种左右蛋白质的一级结构被研究确定,如胰岛素,胰核糖核酸酶、胰蛋白酶等。 蛋白质的一级结构决定了蛋白质的二级、三级等高级结构,成百亿的天然蛋白质各有其特殊的生物学活性,决定每一种蛋白质的生物学活 性的结构特点,首先在于其肽链的氨基酸序列,由于组成蛋白质的20种氨基酸各具特殊的侧链,侧链基团的理化性质和空间排布各不相同,当 它们按照不同的序列关系组合时,就可形成多种多样的空间结构和不同生物学活性的蛋白质分子
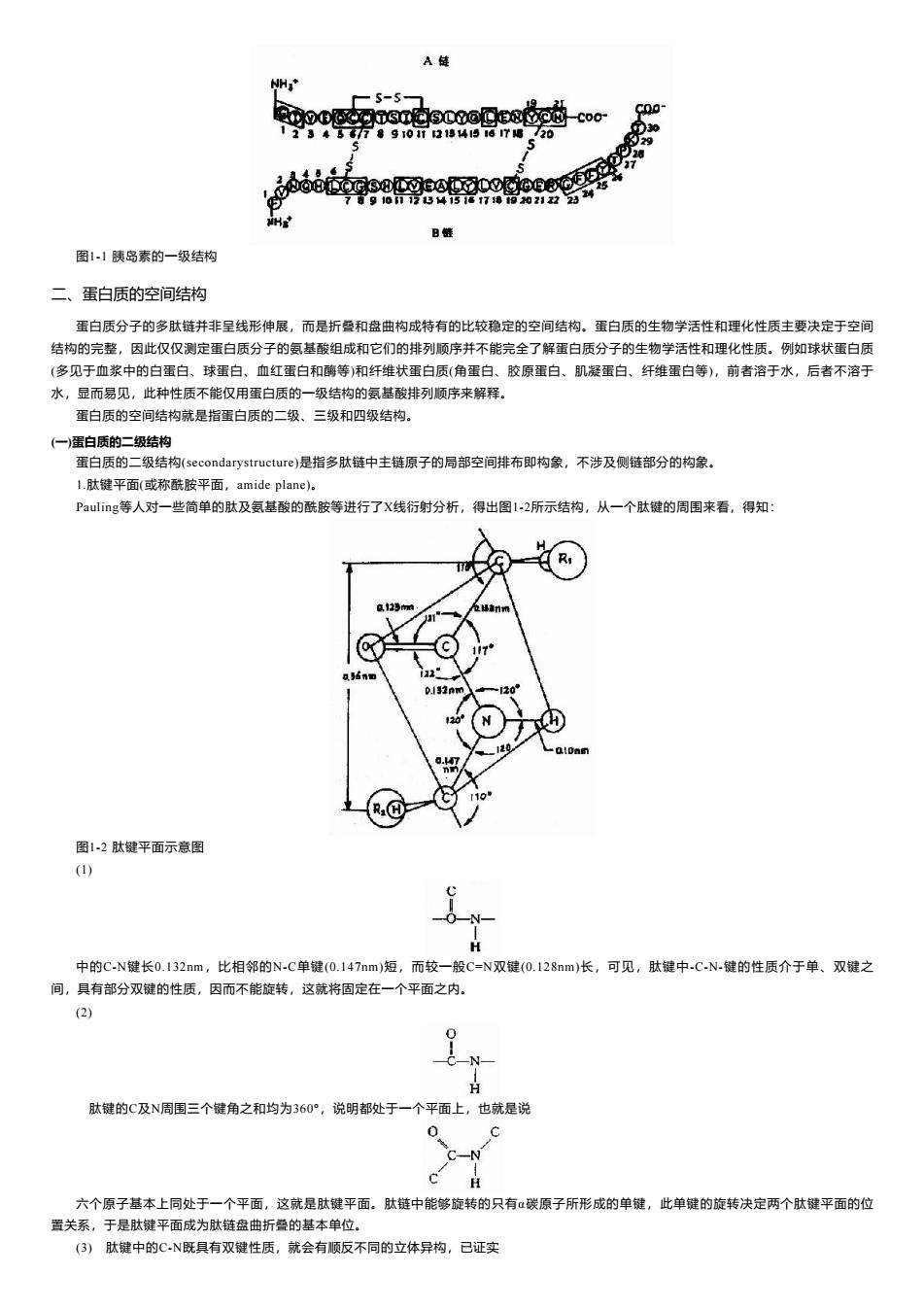
A链 NHT S-5 9江 中00女00宽30@@e9 -coo- CQo 12345G77890t21棒4567喝720 829 28 27 c0架88ee09866e 真45 7910123415117202122 日链 图1-1胰岛素的一级结构 二、蛋白质的空间结构 蛋白质分子的多肽链并非呈线形伸展,而是折叠和盘曲构成特有的比较稳定的空间结构。蛋白质的生物学活性和理化性质主要决定于空间 结构的完整,因此仅仅测定蛋白质分子的氨基酸组成和它们的排列顺序并不能完全了解蛋白质分子的生物学活性和理化性质。例如球状蛋白质 (多见于血浆中的白蛋白、球蛋白、血红蛋白和酶等)和纤维状蛋白质(角蛋白、胶原蛋白、肌凝蛋白、纤维蛋白等),前者溶于水,后者不溶于 水,显而易见,此种性质不能仅用蛋白质的一级结构的氨基酸排列顺序来解释。 蛋白质的空间结构就是指蛋白质的二级、三级和四级结构。 (一蛋白质的二级结构 蛋白质的二级结构(secondarystructure)是指多肽链中主链原子的局部空间排布即构象,不涉及侧链部分的构象。 L.肽键平面(或称酰胺平面,amide plane)。 Pauling等人对一些简单的肽及氨基酸的酰胺等进行了X线衍射分析,得出图1-2所示结构,从一个肽键的周围来看,得知: R a.123m 1 0.132nw 24 12 图1-2肽键平面示意图 (1) 中的C-N键长0.132nm,比相邻的N-C单键(0.147nm)短,而较一般C=N双键(0.128nm)长,可见,肽键中.C-N.键的性质介于单、双键之 间,具有部分双键的性质,因而不能旋转,这就将固定在一个平面之内。 (2) CN- 肽键的C及N周围三个键角之和均为360°,说明都处于一个平面上,也就是说 0 C-N 六个原子基本上同处于一个平面,这就是肽键平面。肽链中能够旋转的只有α碳原子所形成的单键,此单键的旋转决定两个肽键平面的位 置关系,于是肽键平面成为肽链盘曲折叠的基本单位。 (3)肽键中的CN既具有双键性质,就会有顺反不同的立体异构,已证实
图1-1 胰岛素的一级结构 二、蛋白质的空间结构 蛋白质分子的多肽链并非呈线形伸展,而是折叠和盘曲构成特有的比较稳定的空间结构。蛋白质的生物学活性和理化性质主要决定于空间 结构的完整,因此仅仅测定蛋白质分子的氨基酸组成和它们的排列顺序并不能完全了解蛋白质分子的生物学活性和理化性质。例如球状蛋白质 (多见于血浆中的白蛋白、球蛋白、血红蛋白和酶等)和纤维状蛋白质(角蛋白、胶原蛋白、肌凝蛋白、纤维蛋白等),前者溶于水,后者不溶于 水,显而易见,此种性质不能仅用蛋白质的一级结构的氨基酸排列顺序来解释。 蛋白质的空间结构就是指蛋白质的二级、三级和四级结构。 (一)蛋白质的二级结构 蛋白质的二级结构(secondarystructure)是指多肽链中主链原子的局部空间排布即构象,不涉及侧链部分的构象。 1.肽键平面(或称酰胺平面,amide plane)。 Pauling等人对一些简单的肽及氨基酸的酰胺等进行了X线衍射分析,得出图1-2所示结构,从一个肽键的周围来看,得知: 图1-2 肽键平面示意图 (1) 中的C-N键长0.132nm,比相邻的N-C单键(0.147nm)短,而较一般C=N双键(0.128nm)长,可见,肽键中-C-N-键的性质介于单、双键之 间,具有部分双键的性质,因而不能旋转,这就将固定在一个平面之内。 (2) 肽键的C及N周围三个键角之和均为360°,说明都处于一个平面上,也就是说 六个原子基本上同处于一个平面,这就是肽键平面。肽链中能够旋转的只有α碳原子所形成的单键,此单键的旋转决定两个肽键平面的位 置关系,于是肽键平面成为肽链盘曲折叠的基本单位。 (3) 肽键中的C-N既具有双键性质,就会有顺反不同的立体异构,已证实
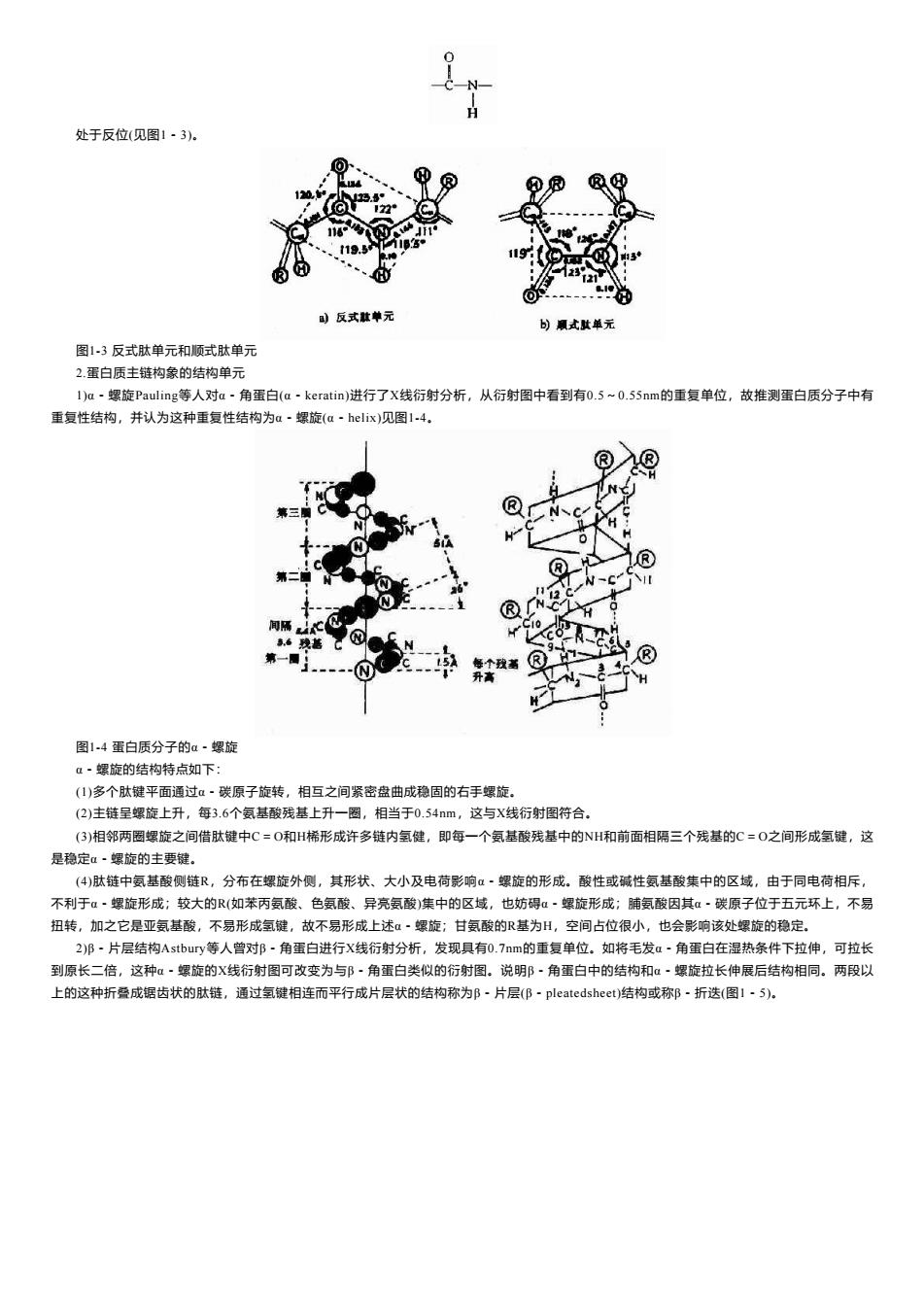
处于反位(见图1-3)。 下1 1 ⊙ 反式款单元 )顺式世单元 图13反式肽单元和顺式肽单元 2.蛋白质主链构象的结构单元 I)a·螺旋Pauling等人对a·角蛋白(a·keratin)进行了X线衍射分析,从衍射图中看到有0.5~0.S5nm的重复单位,故推测蛋白质分子中有 重复性结构,并认为这种重复性结构为a·螺旋(a·helix)见图1-4。 ® H 图1-4蛋白质分子的α·螺旋 α·螺旋的结构特点如下: (1)多个肽键平面通过α~碳原子旋转,相互之间紧密盘曲成稳固的右手螺旋。 (2)主链呈螺旋上升,每3.6个氨基酸残基上升一圈,相当于0.54m,这与X线衍射图符合。 (3)相邻两圈螺旋之间借肽键中C=O和H稀形成许多链内氢健,即每一个氨基酸残基中的NH和前面相隔三个残基的C=O之间形成氢键,这 是稳定α·螺旋的主要键。 (4)肽链中氨基酸侧链R,分布在螺旋外侧,其形状、大小及电荷影响α·螺旋的形成。酸性或碱性氨基酸集中的区域,由于同电荷相斥, 不利于α·螺旋形成;较大的R(如苯丙氨酸、色氨酸、异亮氨酸)集中的区域,也妨碍a~螺旋形成;脯氨酸因其a·碳原子位于五元环上,不易 扭转,加之它是亚氨基酸,不易形成氢键,故不易形成上述α~螺旋;甘氨酸的R基为H,空间占位很小,也会影响该处螺旋的稳定。 2)B·片层结构Astbury等人曾对邯·角蛋白进行X线衍射分析,发现具有0.7nm的重复单位。如将毛发a·角蛋白在湿热条件下拉伸,可拉长 到原长二倍,这种α·螺旋的X线衍射图可改变为与阝-角蛋白类似的衍射图。说明β·角蛋白中的结构和α·螺旋拉长伸展后结构相同。两段以 上的这种折叠成锯齿状的肽链,通过氢键相连而平行成片层状的结构称为B·片层(B·pleatedsheet)结构或称邓·折迭(图1·5)
处于反位(见图1-3)。 图1-3 反式肽单元和顺式肽单元 2.蛋白质主链构象的结构单元 1)α-螺旋Pauling等人对α-角蛋白(α-keratin)进行了X线衍射分析,从衍射图中看到有0.5~0.55nm的重复单位,故推测蛋白质分子中有 重复性结构,并认为这种重复性结构为α-螺旋(α-helix)见图1-4。 图1-4 蛋白质分子的α-螺旋 α-螺旋的结构特点如下: (1)多个肽键平面通过α-碳原子旋转,相互之间紧密盘曲成稳固的右手螺旋。 (2)主链呈螺旋上升,每3.6个氨基酸残基上升一圈,相当于0.54nm,这与X线衍射图符合。 (3)相邻两圈螺旋之间借肽键中C=O和H桸形成许多链内氢健,即每一个氨基酸残基中的NH和前面相隔三个残基的C=O之间形成氢键,这 是稳定α-螺旋的主要键。 (4)肽链中氨基酸侧链R,分布在螺旋外侧,其形状、大小及电荷影响α-螺旋的形成。酸性或碱性氨基酸集中的区域,由于同电荷相斥, 不利于α-螺旋形成;较大的R(如苯丙氨酸、色氨酸、异亮氨酸)集中的区域,也妨碍α-螺旋形成;脯氨酸因其α-碳原子位于五元环上,不易 扭转,加之它是亚氨基酸,不易形成氢键,故不易形成上述α-螺旋;甘氨酸的R基为H,空间占位很小,也会影响该处螺旋的稳定。 2)β-片层结构Astbury等人曾对β-角蛋白进行X线衍射分析,发现具有0.7nm的重复单位。如将毛发α-角蛋白在湿热条件下拉伸,可拉长 到原长二倍,这种α-螺旋的X线衍射图可改变为与β-角蛋白类似的衍射图。说明β-角蛋白中的结构和α-螺旋拉长伸展后结构相同。两段以 上的这种折叠成锯齿状的肽链,通过氢键相连而平行成片层状的结构称为β-片层(β-pleatedsheet)结构或称β-折迭(图1-5)