
血液由有形成分红细胞、白细胞和血小板,以及无形的液体成分血浆(plasma)组成。血液凝固后析出淡黄色透明液体,称为血清(serum)。 血清与血浆的区别在于血清中没有纤维蛋白原,但含有一些在凝血过程中生成的分解产物。 生理情况下,血液经血管在全身不断流动,转运各种物质与组织之间。血浆,组织间液以及其它细胞外液共同构成机体的内环境。因此血 液在沟通内外环境,维持内环境的相对稳定(如H、渗透压、各种化学成分的浓度等),物质的运输(营养物、代谢产物、代谢调节物),免疫防 御及凝血与抗凝血作用等方面都起着重要作用。 第一节 血浆蛋白质 血浆蛋白是血浆中最主要的固体成分,含量为60~80gL,血浆蛋白质种类繁多,功能各异。用不同的分离方法可将血浆蛋白质分为不同 的种类。最初用盐析法只是将血浆蛋白分为白蛋白和球蛋白,后来用分段盐析法可细分为白蛋白、拟球蛋白、优球蛋白和纤维蛋白等组分。用 醋酸纤维薄膜电泳法可分为白蛋白、α1球蛋白、α2球蛋白、阝·球蛋白和y-球蛋白等5条区带,而用分辨力较高的聚丙烯酰胺凝脉电泳法则可分 为30多条区带。用等电聚焦电泳与聚丙烯酰胺电泳组合的双向电泳,分辨力更高,可将血浆蛋白分成一百余种。目前临床较多采用简便快速的 醋酸纤维薄膜电泳法,所获得的血浆蛋白种类及正常含量见表10-1。 表10-1血浆蛋白的种类、生成部位、 主要功能和正常含量 血浆蛋白种类 生成部位 主要功能 正常含量 维持血浆渗透 (克/100毫升血浆) 白蛋白 肝脏 压、运输、营养 3.8-4.8 a1球蛋白 球蛋白 主要在肝脏 运输 2球蛋白 1.5-3.0 球蛋白 大部分在肝脏 运输 球蛋白 主要在肝外 免疫 纤维蛋白原 肝脏 凝血 0.2-0.4 近年来已知的血浆蛋白质有二百多种,有些蛋白质的功能尚未阐明。将其中主要的血浆蛋白质含量及功能归纳如表10-2。 表10-2 血浆蛋白各组分的名称、浓度及生物学活性 名称 符号 正常血浆中浓度(毫克/100毫升) 生物学活性 白蛋白: 前白蛋白 PA/Pre-AL 28-35 结合甲状腺素 白蛋白 Alb 4,200±700 维持血浆胶体渗透压、运输、营养 α1球蛋白: 脂蛋白(HDL) 217-270 磺酯、甘油三酯、胆固醇、脂溶性维生素的运输 α1酸性糖蛋白 alAGP 75-100 又称乳清类粘蛋白、感染初期活性物质,抑制黄体酮 α抗胰蛋白酶 alAT 210-500 抗胰蛋白确和糜蛋白酶 运钴胺素蛋白1 与维生素B12结合 运皮质醇蛋白 TSC 5-7 运输皮质醇 甲胎蛋白 AFP 0.5-2.0×10-3 a2球蛋白: α2神经氨酸糖蛋白 CIsI 24+10 抑制补体第一成分C1s (C1s酯酶抑制物) 酯璃的抑制物 甲状腺素结合球蛋白 TBG 1-2 和甲状腺素(T4)结合 a2HS糖蛋白 a2HS 炎症时被激活 铜兰蛋白 CP 27-63 有氧化酶活性,与铜结合,参与铜的代谢,急性时权反应物 凝血酶原 5-10 参加凝血作用 a2巨球蛋白 a2M 200+60 抑制纤溶酶和胰蛋白酶,活化生长激纱和胰岛素,也可和其它低分子物质结合,急性时相反应幸 胆硷酯磷 ChE 1+0.2 水解乙酰胆碱 缚珠蛋白(结合珠蛋白) Hp 100(30-190) 和Hb结合 血管紧张素原 使血管收缩,升高血压;促进醛固 红细跑生成素 酮分泌促进RBC生成 2脂蛋白(VLDL) a2Lp 28-71(随年龄性别而异) 运输脂类(主要是甘油三酯)、脂溶性维生素和激素 球蛋白: 脂蛋白(LDL) BLp 219-340随年龄性别而异) 运输脂类(胆固醇、磷脂等)脂溶性维生素、激素 运铁蛋白 Tf 250±40 运输铁、抗菌、抗病素 运血红素蛋白 Hpx 80-100 与血红素结合 C反应蛋白 CRP <12 与肺炎球菌的C多糖起反应 运钴铵素蛋白 与维生素B12结合 纤溶酶原 Pm 3042 有纤溶确活性 纤维蛋白原 Fib 350(200-00) 凝血因子刊,急性时相反应物 球蛋白: 免疫球蛋白A IgA 247±87 抗体活性,分泌型抗体 免疫球蛋白D IgD 3(0.3-40) 抗体活性 免球蛋白E IgE 0.033 反应素活性 (0.01-0.13) 免疫球蛋白M IgM 146+56 抗体活性 兔疫球蛋白G IgG 1280±260 抗体活性 血浆蛋白质多种多样,各种血浆蛋白有其独特的功能,除按分离方法分类外。目前亦采用功能分类法。可分为以下8类:①凝血系统蛋白 质,包括12种凝血固子(除C2+外)。②纤溶系统蛋白质,包括纤溶酶原、纤溶酶、激活剂及抑制剂等。③补体系统蛋白质。④免疫球蛋白
血液由有形成分红细胞、白细胞和血小板,以及无形的液体成分血浆(plasma)组成。血液凝固后析出淡黄色透明液体,称为血清(serum)。 血清与血浆的区别在于血清中没有纤维蛋白原,但含有一些在凝血过程中生成的分解产物。 生理情况下,血液经血管在全身不断流动,转运各种物质与组织之间。血浆,组织间液以及其它细胞外液共同构成机体的内环境。因此血 液在沟通内外环境,维持内环境的相对稳定(如pH、渗透压、各种化学成分的浓度等),物质的运输(营养物、代谢产物、代谢调节物),免疫防 御及凝血与抗凝血作用等方面都起着重要作用。 第一节 血浆蛋白质 血浆蛋白是血浆中最主要的固体成分,含量为60~80g/L,血浆蛋白质种类繁多,功能各异。用不同的分离方法可将血浆蛋白质分为不同 的种类。最初用盐析法只是将血浆蛋白分为白蛋白和球蛋白,后来用分段盐析法可细分为白蛋白、拟球蛋白、优球蛋白和纤维蛋白等组分。用 醋酸纤维薄膜电泳法可分为白蛋白、α1球蛋白、α2球蛋白、β-球蛋白和γ-球蛋白等5条区带,而用分辨力较高的聚丙烯酰胺凝脉电泳法则可分 为30多条区带。用等电聚焦电泳与聚丙烯酰胺电泳组合的双向电泳,分辨力更高,可将血浆蛋白分成一百余种。目前临床较多采用简便快速的 醋酸纤维薄膜电泳法,所获得的血浆蛋白种类及正常含量见表10-1。 表10-1 血浆蛋白的种类、生成部位、主要功能和正常含量 血浆蛋白种类 生成部位 主要功能 正常含量 (克/100毫升血浆) 白蛋白 肝脏 维持血浆渗透 压、运输、营养 3.8-4.8 α球蛋白 α1球蛋白 主要在肝脏 运输 1.5-3.0 α2球蛋白 β球蛋白 大部分在肝脏 运输 γ球蛋白 主要在肝外 免疫 纤维蛋白原 肝脏 凝血 0.2-0.4 近年来已知的血浆蛋白质有二百多种,有些蛋白质的功能尚未阐明。将其中主要的血浆蛋白质含量及功能归纳如表10-2。 表10-2 血浆蛋白各组分的名称、浓度及生物学活性 名称 符号 正常血浆中浓度(毫克/100毫升) 生物学活性 白蛋白: 前白蛋白 PA/Pre-AL 28-35 结合甲状腺素 白蛋白 AIb 4,200±700 维持血浆胶体渗透压、运输、营养 α1球蛋白: α脂蛋白(HDL) aLP 217-270 磷酯、甘油三酯、胆固醇、脂溶性维生素的运输 α1酸性糖蛋白 α1AGP 75-100 又称乳清类粘蛋白、感染初期活性物质,抑制黄体酮 α1抗胰蛋白酶 α1AT 210-500 抗胰蛋白酶和糜蛋白酶 运钴胺素蛋白Ⅰ 与维生素B12结合 运皮质醇蛋白 TSC 5-7 运输皮质醇 甲胎蛋白 AFP 0.5-2.0×10-3 ? α2球蛋白: α2神经氨酸糖蛋白 C1s I 24±10 抑制补体第一成分C1s (C1s酯酶抑制物) 酯酶的抑制物 甲状腺素结合球蛋白 TBG 1-2 和甲状腺素(T4)结合 α2HS糖蛋白 α2HS ? 炎症时被激活 铜兰蛋白 CP 27-63 有氧化酶活性,与铜结合,参与铜的代谢,急性时权反应物 凝血酶原 5-10 参加凝血作用 α2巨球蛋白 α2M 200±60 抑制纤溶酶和胰蛋白酶,活化生长激纱和胰岛素,也可和其它低分子物质结合,急性时相反应物 胆硷酯酶 ChE 1±0.2 水解乙酰胆碱 缚珠蛋白(结合珠蛋白) Hp 100(30-190) 和Hb结合 血管紧张素原 使血管收缩,升高血压;促进醛固 红细胞生成素 酮分泌促进RBC生成 α2脂蛋白(VLDL) α2Lp 28-71(随年龄性别而异) 运输脂类(主要是甘油三酯)、脂溶性维生素和激素 β球蛋白: β脂蛋白(LDL) βLp 219-340(随年龄性别而异) 运输脂类(胆固醇、磷脂等)脂溶性维生素、激素 运铁蛋白 Tf 250±40 运输铁、抗菌、抗病素 运血红素蛋白 Hpx 80-100 与血红素结合 C反应蛋白 CRP <1.2 与肺炎球菌的C多糖起反应 运钴铵素蛋白Ⅱ 与维生素B12结合 纤溶酶原 Pm 30±2 有纤溶酶活性 纤维蛋白原 Fib 350(200-00) 凝血因子Ⅰ,急性时相反应物 γ球蛋白: 免疫球蛋白A IgA 247±87 抗体活性,分泌型抗体 免疫球蛋白D IgD 3(0.3-40) 抗体活性 免疫球蛋白E IgE 0.033 反应素活性 (0.01-0.13) 免疫球蛋白M IgM 146±56 抗体活性 免疫球蛋白G IgG 1280±260 抗体活性 血浆蛋白质多种多样,各种血浆蛋白有其独特的功能,除按分离方法分类外。目前亦采用功能分类法。可分为以下8类:①凝血系统蛋白 质,包括12种凝血固子(除Ca2+外)。②纤溶系统蛋白质,包括纤溶酶原、纤溶酶、激活剂及抑制剂等。③补体系统蛋白质。④免疫球蛋白

⑤脂蛋白。⑥血浆蛋白酶抑制剂,包括酶原激活抑制剂、血液凝固抑制剂、纤溶酶抑制剂、激肽释放抑制剂、内源性蛋白酶及其他蛋白酶抑制 剂。⑦载体蛋白。⑧未知功能的血浆蛋白质。 血浆蛋白质具有以下共同特征: 1血浆蛋白质绝大部分由肝脏合成。除球蛋白由浆细胞合成,内皮细胞合成少量血浆蛋白质外. 2.血浆蛋白质为分泌型蛋白质。在与肉质网结合的多核糖体(pllyribosome)上合成,分泌入血浆前经历了剪切信号肽、糖基化、磷酸化等翻 译后修饰加工过程,成为成熟蛋白质。 3.血浆蛋白质几乎都是糖蛋白,含有N-或O-连接的寡糖链。仅白蛋白、视黄醇结合蛋白和C·反应蛋白等少数不含糖。糖链可参与血浆 蛋白分子的三级结构的形成,具有多种功能。 4.各种血浆蛋白质都具有其特征性的循环半衰期。 5.许多血浆蛋白质有多态性(polymorphism)。多态性指在同种属人群中,有两种以上,发生频率不低于1%的表现型。最典型的是ABO血型 物质。此外,α1抗胰蛋白酶、结合珠蛋白、铁转运蛋白、血浆铜蓝蛋白等都显示多态性。研究血浆蛋白多态性对遗传学及临床医学均有重要意 义。 6.当急性炎症或组织损伤时,某些血浆蛋白水平增高。这些血浆蛋白被称为急性期蛋白质(acute phaseprotein)。包括C?反应蛋白(CRP) α1抗胰蛋白酶、α2酸性糖蛋白及纤维蛋白原等。急性期蛋白在人体炎症反应中发挥一定作用。 血浆蛋白的主要功能可归纳为以下几个方面: 1维持血浆胶体渗透压。主要靠血浆白蛋白,因其含量多而分子小,血浆胶体渗透压的75~80%由它维持。 2.调节血浆pH值,维持酸碱平衡。血浆蛋白的等电点大部分在H4~6,血浆中蛋白多以负离子形式存在,以 (Pr表示血浆蛋白)形式构成血浆中的缓冲对。 3运输血浆蛋白中许多组分具有运输功能,可送输营养物质、代谢物、激素、药物及金属离子等。 4凝血和抗凝血作用。各种凝血因子及抗凝血因子在减少出血,防止循环阻塞中发挥重要作用。 5免疫作用,抵御感染。主要靠抗体和补体系统发挥作用。 一、白蛋白 人血浆白蛋白(albumin)是人血浆含量最多的蛋白质,约45g/L,占血浆总蛋白的60%。肝脏每天合成12g白蛋白,占肝脏分泌蛋白的50%. 人血浆白蛋白基因位于第4号染色体上,其初级翻译产物为前白蛋白原(preproalbumin)。在分泌过程中切除信号肽,生成白蛋白原 (proalbumis)。继而在高尔基氏体经组织蛋白酶B切除N末端的一个6肽片断(精·甘·缬-苯丙·精·精),成为成熟的白蛋白。由585个氨基酸 组成的一条多肽链,含17个二硫键,分子量约为69,000。白蛋白的分子呈椭园形,其长短轴分别为150?和38?,较球蛋白和纤维蛋白原分子 对称,故白蛋白粘性较低。白蛋白等电点为H4.7,比血浆蛋白其他组分的PI低,所以在常用的弱碱性电泳缓冲液中所带负电荷多,加之分子 量小,故电泳迁移速度快。 血浆白蛋白主要有两方面生理功能:①维持血浆胶体渗透压。因血浆中白蛋白含量最高,且分子量较小,故血浆中它的分子数最多。因此 在血浆胶体渗透压中起主要作用,提供75-80%的血浆总胶体渗透压。②与各种配体(ligands)结合,起运输功能。许多物质如游离脂肪酸、胆 红素、性激素、甲状腺素、肾上腺素、金属离子、磺胺药、青霉素G、双香豆素、阿斯匹林等药物都能与白蛋白结合,增加亲水性而便于运 输。 二、金属结合蛋白 1.结合珠蛋白(haptoglobin:Hp)是一种血浆糖蛋白,分子量约为90.000。能与红细胞外血红蛋白(Hb)结合形成紧密的非共价复合物Hb-Hp。 每100ml血浆中具有足以结合40?80mg血红蛋白的Hp。每天降解的Hb约有10%释入血循环中,成为红细胞外游离的Hb,Hb与Hp结合成Hb-Hp 复合物后分子量可达155.000,不能透过肾小球,从而防止游离血红蛋白从肾脏丢失,避免Hb所含铁的丢失。保证铁再用于合成代谢. 溶血性贫血患者血浆结合珠蛋白浓度下降。由于溶血时大量的Hb释出,H与游离Hb结合成复合物而被肝细胞摄取、清除。此外,Hp也是 一种急性期蛋白,患各种炎症时其血浆中含量升高。 2.铁转运蛋白(transferrin,Tf)铁转运蛋白属β球蛋白。是由肝脏内合成的糖蛋白,分子量约80.000。具高度多态性,目前已发现20多种不 同类型的Tf。每分子Tf可结合2分子的Fε3+。铁转运蛋白的生理功能是将铁运送到需要铁的组织与细胞。每天血红蛋白分解代谢,释出25mg 左右的铁。游离铁有毒性,它与T结合后不仅毒性降低而且还将铁运送到需铁部位。铁是许多含铁蛋白质生物活性的发挥所必不可少的,如血 红蛋白、肌红蛋白、细胞色素、过氧化物酶等。因此,任何生长、增殖细胞的膜上都有铁转运蛋白的受体。携带F3+的Tf与受体结合后经内 吞作用进入细胞内,供细胞内合成利用。 三、铜蓝蛋白(ceruloplasmin;Cp) 铜蓝蛋白(ceruloplosminCp)属a2球蛋白。也是由脏脏合成的一种糖蛋白、分子量为160,000,由8个分子量1.8万的亚基组成。每分子Cp 可牢固地结合6个铜离子,并因携铜而呈蓝色。Cp除作为铜的载体外,还具有氧化酶的活性,可将F2+氧化为Fε3+,利于铁掺入铁转运蛋 白,促进铁的运输。 正常人体内含铜约100?50mg,主要位于骨、脏脏和肌肉中。血浆中的铜90%由Cp转运,10%与白蛋白结合而送输。成人每日摄取铜2mg, 主要在小肠上段吸收,同白蛋白结合送输到肝,即掺入肝细胞合成C印。部分铜可从胆汁中排出。肝病时铜蓝蛋白合成减少,血浆Cp含量降
⑤脂蛋白。⑥血浆蛋白酶抑制剂,包括酶原激活抑制剂、血液凝固抑制剂、纤溶酶抑制剂、激肽释放抑制剂、内源性蛋白酶及其他蛋白酶抑制 剂。⑦载体蛋白。⑧未知功能的血浆蛋白质。 血浆蛋白质具有以下共同特征: 1.血浆蛋白质绝大部分由肝脏合成。除γ球蛋白由浆细胞合成,内皮细胞合成少量血浆蛋白质外。 2.血浆蛋白质为分泌型蛋白质。在与肉质网结合的多核糖体(pllyribosome)上合成,分泌入血浆前经历了剪切信号肽、糖基化、磷酸化等翻 译后修饰加工过程,成为成熟蛋白质。 3.血浆蛋白质几乎都是糖蛋白,含有N-或O-连接的寡糖链。仅白蛋白、视黄醇结合蛋白和C-反应蛋白等少数不含糖。糖链可参与血浆 蛋白分子的三级结构的形成,具有多种功能。 4.各种血浆蛋白质都具有其特征性的循环半衰期。 5.许多血浆蛋白质有多态性(polymorphism)。多态性指在同种属人群中,有两种以上,发生频率不低于1%的表现型。最典型的是ABO血型 物质。此外,α1抗胰蛋白酶、结合珠蛋白、铁转运蛋白、血浆铜蓝蛋白等都显示多态性。研究血浆蛋白多态性对遗传学及临床医学均有重要意 义。 6.当急性炎症或组织损伤时,某些血浆蛋白水平增高。这些血浆蛋白被称为急性期蛋白质(acute phaseprotein)。包括C?反应蛋白(CRP)、 α1抗胰蛋白酶、α2酸性糖蛋白及纤维蛋白原等。急性期蛋白在人体炎症反应中发挥一定作用。 血浆蛋白的主要功能可归纳为以下几个方面: 1.维持血浆胶体渗透压。主要靠血浆白蛋白,因其含量多而分子小,血浆胶体渗透压的75~80%由它维持。 2.调节血浆pH值,维持酸碱平衡。血浆蛋白的等电点大部分在pH4~6,血浆中蛋白多以负离子形式存在,以 (Pr表示血浆蛋白)形式构成血浆中的缓冲对。 3.运输 血浆蛋白中许多组分具有运输功能,可送输营养物质、代谢物、激素、药物及金属离子等。 4.凝血和抗凝血作用。各种凝血因子及抗凝血因子在减少出血,防止循环阻塞中发挥重要作用。 5.免疫作用,抵御感染。主要靠抗体和补体系统发挥作用。 一、白蛋白 人血浆白蛋白(albumin)是人血浆含量最多的蛋白质,约45g/L,占血浆总蛋白的60%。肝脏每天合成12g白蛋白,占肝脏分泌蛋白的50%。 人 血 浆 白 蛋 白 基 因 位 于 第 4 号 染 色 体 上 , 其 初 级 翻 译 产 物 为 前 白 蛋 白 原 (preproalbumin) 。 在 分 泌 过 程 中 切 除 信 号 肽 , 生 成 白 蛋 白 原 (proalbumis)。继而在高尔基氏体经组织蛋白酶B切除N末端的一个6肽片断(精-甘-缬-苯丙-精-精),成为成熟的白蛋白。由585个氨基酸 组成的一条多肽链,含17个二硫键,分子量约为69,000。白蛋白的分子呈椭园形,其长短轴分别为150?和38?,较球蛋白和纤维蛋白原分子 对称,故白蛋白粘性较低。白蛋白等电点为pH4.7,比血浆蛋白其他组分的PI低,所以在常用的弱碱性电泳缓冲液中所带负电荷多,加之分子 量小,故电泳迁移速度快。 血浆白蛋白主要有两方面生理功能:①维持血浆胶体渗透压。因血浆中白蛋白含量最高,且分子量较小,故血浆中它的分子数最多。因此 在血浆胶体渗透压中起主要作用,提供75-80%的血浆总胶体渗透压。②与各种配体(ligands)结合,起运输功能。许多物质如游离脂肪酸、胆 红素、性激素、甲状腺素、肾上腺素、金属离子、磺胺药、青霉素G、双香豆素、阿斯匹林等药物都能与白蛋白结合,增加亲水性而便于运 输。 二、金属结合蛋白 1.结合珠蛋白(haptoglobin;Hp)是一种血浆糖蛋白,分子量约为90.000。能与红细胞外血红蛋白(Hb)结合形成紧密的非共价复合物Hb-Hp。 每100ml血浆中具有足以结合40?80mg血红蛋白的Hp。每天降解的Hb约有10%释入血循环中,成为红细胞外游离的Hb,Hb与Hp结合成Hb-Hp 复合物后分子量可达155.000,不能透过肾小球,从而防止游离血红蛋白从肾脏丢失,避免Hb所含铁的丢失。保证铁再用于合成代谢。 溶血性贫血患者血浆结合珠蛋白浓度下降。由于溶血时大量的Hb释出,Hp与游离Hb结合成复合物而被肝细胞摄取、清除。此外,Hp也是 一种急性期蛋白,患各种炎症时其血浆中含量升高。 2.铁转运蛋白(transferrin;Tf) 铁转运蛋白属β球蛋白。是由肝脏内合成的糖蛋白,分子量约80.000。具高度多态性,目前已发现20多种不 同类型的Tf。每分子Tf可结合2分子的Fe3+。铁转运蛋白的生理功能是将铁运送到需要铁的组织与细胞。每天血红蛋白分解代谢,释出25mg 左右的铁。游离铁有毒性,它与Tf结合后不仅毒性降低而且还将铁运送到需铁部位。铁是许多含铁蛋白质生物活性的发挥所必不可少的,如血 红蛋白、肌红蛋白、细胞色素、过氧化物酶等。因此,任何生长、增殖细胞的膜上都有铁转运蛋白的受体。携带Fe3+的Tf与受体结合后经内 吞作用进入细胞内,供细胞内合成利用。 三、铜蓝蛋白(ceruloplasmin;Cp) 铜蓝蛋白(ceruloplosminCp)属α2球蛋白。也是由脏脏合成的一种糖蛋白、分子量为160,000,由8个分子量1.8万的亚基组成。每分子Cp 可牢固地结合6个铜离子,并因携铜而呈蓝色。Cp除作为铜的载体外,还具有氧化酶的活性,可将Fe2+氧化为Fe3+,利于铁掺入铁转运蛋 白,促进铁的运输。 正常人体内含铜约100?50mg,主要位于骨、脏脏和肌肉中。血浆中的铜90%由Cp转运,10%与白蛋白结合而送输。成人每日摄取铜2mg, 主要在小肠上段吸收,同白蛋白结合送输到肝,即掺入肝细胞合成Cp。部分铜可从胆汁中排出。肝病时铜蓝蛋白合成减少,血浆Cp含量降

低。肝豆状核变性(ws0病)是一种遗传病,可能因为肝细胞溶酶体不能将来自铜蓝蛋白的铜排入胆汁,导致铜在肝、肾、脑及红细胞中聚积, 发生铜中毒。肝中铜含量增加,抑制铜和Cp结合,血中Cp含量下降(<20mgl)。可出现溶血性贫血、慢性肝病,以及神经系统症状.由于角 膜内铜的沉着,在角膜周围出现绿色或金黄色的色素环,称为Kayse?Fleischer3环,是肝豆状核变性的一种特征性改变,具有诊断价值。减少铜 摄入,服用D青霉胺鳌合铜离子,可对肝豆状核变性进行治疗。 第二节血液凝固 血液的可凝固性质对机体有重要保护作用。当血管系统受伤时,必须迅速可靠地封闭起来,以尽可能减少出血。血小板变形(粘性变态)参 于封闭作用,此种封闭作用要靠纤维蛋白凝结物的支持,而后者的形成是多种凝血因子相互作用,发生一系列酶促反应的结果。目前已发现的 凝血因子有14种(表10-3)。 这些凝血因子除C2+外均为蛋白质,大多是由肝脏合成的血浆糖蛋白,它们大多属蛋白水解酶类。有7种为蛋白酶原,在凝血过程中被激 活。无活性的凝血因子用罗马数码表示,其活性型以附加的下角码字来表示。 内源性系统 外源性系统 凝血因子活化 凝血因子活化 凝血酶原激活物生成 凝血酶生成 ↓ 凝胶生成 图10-1血液凝固过程 一、血液凝固的机理 血液凝固的化学本质是溶胶状态的纤维蛋白原转变为凝胶状态的纤维蛋白,催化此反应的主要是凝血酶。而正常血液中以无活性的凝血 酶原形式存在,在一定条件下被激活而成为凝血酶。凝血酶原激活物是由活化的凝血固子与磷脂胶粒和钙形成的复合物。因此,凝血因子的活 化是导致血液凝固的触发机制。据触发凝血过程的方式不同,又有内源性(intrinsic)与外源性(extrinsic))凝血之分。内源性凝血指因心血管内膜 受损或血液抽出体外接触异物表面而触发的,仅有血管内凝血因子参与的凝血过程;而外源性凝血则指有受损组织释放的组织凝血活素所参与 的凝血过程。血液凝固过程的梗概可图解如下:(图10·1) 二、凝血酶原激活物的生成 凝血酶原激活物由活化的凝血因子Xa、Va、Ca++及磷脂胶粒构成的复合体。因子X被激活为Xa是此过程的关键步骤。因子X的激活有两 条途径:即内源性和外源性途径。 表103凝血因于命名及其部分特性 凝血因同义名 合成场所 分子量 亚基数目含糖量% 血浆浓度 衍生物 mg% 纤维蛋白原(Fibrinogen) 肝 340,000(人,牛)3×2 34 200-400 纤维蛋E 8.2(人) 68,700(人) 凝血酶原(Prothrombin) 肝 10-14 10-15 72,000(牛) 凝血确 (牛) 330,00 组织凝血活素(Tissue Thromboplastin) 各组织细胞 220,000(牛) IV 钙离子(Calcium Ion)】 前加速素(Proaccelerin) 290,000-400,000 多聚 11-18 5-10 IV (Va) 血清凝血活商转变加速素(Convertin)又称SPCA) 肝 63,000(人) 9.1 0.4-0.7 VIla 抗甲种笛以病球蛋白(Antihemotpilic Globulin简写AHG) 肝为主 1,100,000(人. 6(人) 15-20 牛) 9(牛) IX 血浆凝血活素成分Plasma Thromboplastin简写PTC)又名抗乙种血友病因子 肝 55,400(人,牛) 1 26 3-5 IXa X Stuart-Prower因子 吸 55,000(人,牛) 1 10 5-10 Xa 血浆凝血活话素前质Plasma Thro mboplastin Antecedenti简写PTA)又名抗丙种血友肝?网状内皮系 Xla 病因子 统2 160,000(人,牛)2 白 0.5-0.9 90,00(牛) XⅫ 接因子Hageman因子) 网状内皮系统? 82,000(人) 2 15 0.1-0.5 320,000(血浆) 146,000- XI 纤维蛋白稳定因子Fibrin Stabilizing Factor简写FSK) 血水板?肝? 5(血 165.,000 1-2 XIla 浆) 形成桥 (血小板) 前激肽释放(Prekallidrein) 肝 80,000 10 1-2 激肽释宜
低。肝豆状核变性(wilso病)是一种遗传病,可能因为肝细胞溶酶体不能将来自铜蓝蛋白的铜排入胆汁,导致铜在肝、肾、脑及红细胞中聚积, 发生铜中毒。肝中铜含量增加,抑制铜和Cp结合,血中Cp含量下降(<20mg/dl)。可出现溶血性贫血、慢性肝病,以及神经系统症状。由于角 膜内铜的沉着,在角膜周围出现绿色或金黄色的色素环,称为Kayse?Fleischer环,是肝豆状核变性的一种特征性改变,具有诊断价值。减少铜 摄入,服用D青霉胺鳌合铜离子,可对肝豆状核变性进行治疗。 第二节 血液凝固 血液的可凝固性质对机体有重要保护作用。当血管系统受伤时,必须迅速可靠地封闭起来,以尽可能减少出血。血小板变形(粘性变态)参 于封闭作用,此种封闭作用要靠纤维蛋白凝结物的支持,而后者的形成是多种凝血因子相互作用,发生一系列酶促反应的结果。目前已发现的 凝血因子有14种(表10-3)。 这些凝血因子除Ca2+外均为蛋白质,大多是由肝脏合成的血浆糖蛋白,它们大多属蛋白水解酶类。有7种为蛋白酶原,在凝血过程中被激 活。无活性的凝血因子用罗马数码表示,其活性型以附加的下角码a字来表示。 图10-1 血液凝固过程 一、血液凝固的机理 血液凝固的化学本质是溶胶状态的纤维蛋白原转变为凝胶状态的纤维蛋白,催化此反应的主 要是凝血酶。而正常血液中以无活性的凝血 酶原形式存在,在一定条件下被激活而成为凝血酶。凝血酶原激活物是由活化的凝血固子与磷脂胶粒和钙形成的复合物。因此,凝血因子的活 化是导致血液凝固的触发机制。据触发凝血过程的方式不同,又有内源性(intrinsic)与外源性(extrinsic)凝血之分。内源性凝血指因心血管内膜 受损或血液抽出体外接触异物表面而触发的,仅有血管内凝血因子参与的凝血过程;而外源性凝血则指有受损组织释放的组织凝血活素所参与 的凝血过程。血液凝固过程的梗概可图解如下:(图10-1) 二、凝血酶原激活物的生成 凝血酶原激活物由活化的凝血因子Xa、Va、Ca++及磷脂胶粒构成的复合体。因子X被激活为Xa是此过程的关键步骤。因子X的激活有两 条途径:即内源性和外源性途径。 表10-3 凝血因于命名及其部分特性 凝血因 子 同义名 合成场所 分子量 亚基数目 含糖量% 血浆浓度 mg% 衍生物 Ⅰ 纤维蛋白原(Fibrinogen) 肝 340,000(人,牛) 3×2 3-4 200-400 纤维蛋白 Ⅱ 凝血酶原(Prothrombin) 肝 68,700(人) 72,000(牛) 1 8.2(人) 10-14 (牛) 10-15 凝血酶 Ⅲ 组织凝血活素(Tissue Thromboplastin) 各组织细胞 330,00 220,000(牛) Ⅳ 钙离子(Calcium Ion) Ⅴ 前加速素(Proaccelerin) 肝 290,000-400,000 多聚 11-18 5-10 Ⅳ(Va) Ⅶ 血清凝血活酶转变加速素(Convertin)又称SPCA) 肝 63,000(人) 1 9.1 0.4-0.7 Ⅶa Ⅷ 抗甲种箇以病球蛋白(Antihemotpilic Globulin简写AHG) 肝为主 1,100,000(人, 牛) ? 6(人) 9(牛) 15-20 Ⅷa Ⅸ 血浆凝血活素成分(Plasma Thromboplastin简写PTC)又名抗乙种血友病因子 肝 55,400(人,牛) 1 26 3-5 Ⅸa Ⅹ Stuart-Prower因子 肝 55,000(人,牛) 1 10 5-10 Ⅹa Ⅺ 血浆凝血活素前质(Plasma Thro mboplastin Antecedent简写PTA)又名抗丙种血友 病因子 肝?网状内皮系 统? 160,000(人,牛) 2 12 0.5-0.9 Ⅺa Ⅻ 接因子(Hageman因子) 网状内皮系统? 90,00(牛) 82,000(人) 3 15 0.1-0.5 Ⅻa XⅢ 纤维蛋白稳定因子(Fibrin Stabilizing Factor简写FSK) 血水板?肝? 320,000(血浆) 146,000- 165,000 (血小板) 5(血 浆) 1-2 Ⅻa 形成桥键 前激肽释放酶(Prekallidrein) 肝 80,000 1 10 1-2 激肽释放 酶
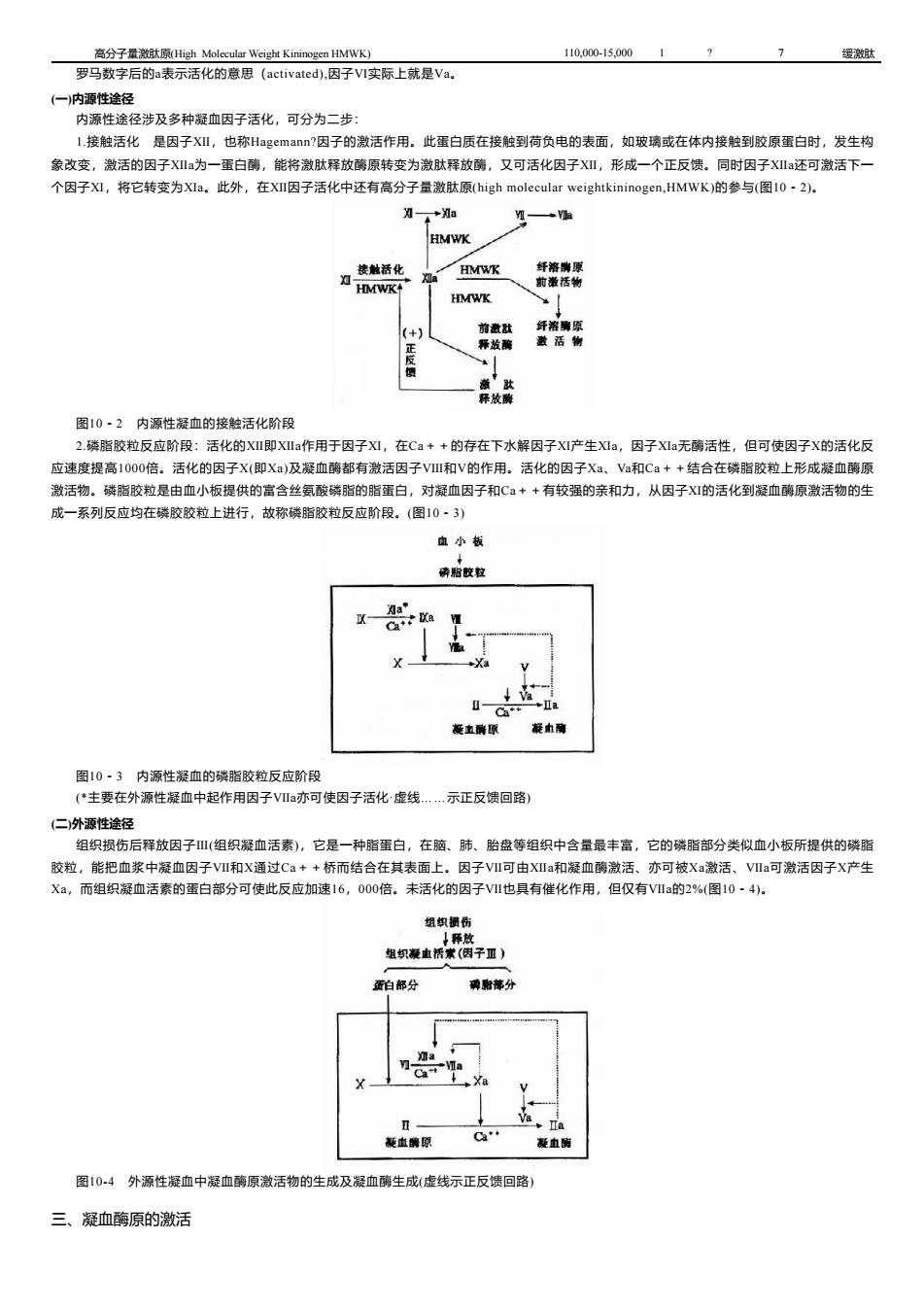
高分子量激肽原(High Molecular Weight Kininogen HMWK) 110,000-15,0001? 7 缓激肽 罗马数字后的a表示活化的意思(activated),因子VI实际上就是Va。 (一)内源性途径 内源性途径涉及多种凝血因子活化,可分为二步 1.接触活化是因子XⅫ,也称Hagemann?因子的激活作用。此蛋白质在接触到荷负电的表面,如玻璃或在体内接触到胶原蛋白时,发生构 象改变,激活的因子XⅫ为一蛋白酶,能将激肽释放酶原转变为激肽释放酶,又可活化因子XI,形成一个正反馈。同时因子XIa还可激活下一 个因子XI,将它转变为XIa。此外,在XII因子话化中还有高分子量激肽原(high molecular weightkininogen,HMWK)的参与(图10-2)。 *力a HMWK 接触话化 HMWK 纤溶南原 知a HMWK↑ 前滋活物 HMWK (+) 前激肚 纤溶骗原 释故酶 激活制 反 释放酶 图10·2内源性凝血的接触活化阶段 2.磷脂胶粒反应阶段:活化的XⅫ即XⅫa作用于因子XⅪ,在Ca++的存在下水解因子XⅪ产生XⅪa,因子XⅪa无酶活性,但可使因子X的活化反 应速度提高1000倍。活化的因子X(即Xa)及凝血酶都有激活因子VⅢ和V的作用。活化的因子Xa、Va和Ca++结合在磷脂胶粒上形成凝血酶原 激活物。磷脂胶粒是由血小板提供的富含丝氨酸磷脂的脂蛋白,对凝血因子和C++有较强的亲和力,从因子XI的活化到凝血酶原激活物的生 成一系列反应均在磷胶胶粒上进行,故称磷脂胶粒反应阶段。(图10·3) 血小板 碎胎胶粒 Xla X +Ⅱa 凝宝磷原 凝h璃 图10·3内源性凝血的磷脂胶粒反应阶段 (体主要在外源性凝血中起作用因子VIa亦可使因子活化虚线…示正反馈回路) (二)外源性途径 组织损伤后释放因子Ⅲ(组织凝血活素),它是一种脂蛋白,在脑、肺、胎盘等组织中含量最丰富,它的磷脂部分类似血小板所提供的磷脂 胶粒,能把血浆中凝血因子VI和X通过Ca++桥而结合在其表面上。因子VI可由XⅫla和凝血酶激活、亦可被Xa激活、VIa可激活因子X产生 X,而组织凝血活素的蛋白部分可使此反应加速16,000倍。未活化的因子VI也具有催化作用,但仅有VIa的2%(图10·4). 组织损伤 1释放 组织凝血活常(因子Ⅲ) 蛋白部分 确贴部分 n XIa X Ⅱa 疑血集原 凝血酶 图10-4外源性凝血中凝血酶原激活物的生成及凝血酶生成(虚线示正反馈回路) 三、凝血酶原的激活
高分子量激肽原(High Molecular Weight Kininogen HMWK) 110,000-15,000 1 ? 7 缓激肽 罗马数字后的a表示活化的意思(activated),因子Ⅵ实际上就是Ⅴa。 (一)内源性途径 内源性途径涉及多种凝血因子活化,可分为二步: 1.接触活化 是因子Ⅻ,也称Hagemann?因子的激活作用。此蛋白质在接触到荷负电的表面,如玻璃或在体内接触到胶原蛋白时,发生构 象改变,激活的因子Ⅻa为一蛋白酶,能将激肽释放酶原转变为激肽释放酶,又可活化因子Ⅻ,形成一个正反馈。同时因子Ⅻa还可激活下一 个因子Ⅺ,将它转变为Ⅺa。此外,在Ⅻ因子活化中还有高分子量激肽原(high molecular weightkininogen,HMWK)的参与(图10-2)。 图10-2 内源性凝血的接触活化阶段 2.磷脂胶粒反应阶段:活化的Ⅻ即Ⅻa作用于因子Ⅺ,在Ca++的存在下水解因子Ⅺ产生Ⅺa,因子Ⅺa无酶活性,但可使因子X的活化反 应速度提高1000倍。活化的因子X(即Xa)及凝血酶都有激活因子Ⅷ和Ⅴ的作用。活化的因子Xa、Va和Ca++结合在磷脂胶粒上形成凝血酶原 激活物。磷脂胶粒是由血小板提供的富含丝氨酸磷脂的脂蛋白,对凝血因子和Ca++有较强的亲和力,从因子Ⅺ的活化到凝血酶原激活物的生 成一系列反应均在磷胶胶粒上进行,故称磷脂胶粒反应阶段。(图10-3) 图10-3 内源性凝血的磷脂胶粒反应阶段 (*主要在外源性凝血中起作用因子Ⅶa亦可使因子活化·虚线……示正反馈回路) (二)外源性途径 组织损伤后释放因子Ⅲ(组织凝血活素),它是一种脂蛋白,在脑、肺、胎盘等组织中含量最丰富,它的磷脂部分类似血小板所提供的磷脂 胶粒,能把血浆中凝血因子Ⅶ和X通过Ca++桥而结合在其表面上。因子Ⅶ可由Ⅻa和凝血酶激活、亦可被Xa激活、Ⅶa可激活因子X产生 Xa,而组织凝血活素的蛋白部分可使此反应加速16,000倍。未活化的因子Ⅶ也具有催化作用,但仅有Ⅶa的2%(图10-4)。 图10-4 外源性凝血中凝血酶原激活物的生成及凝血酶生成(虚线示正反馈回路) 三、凝血酶原的激活
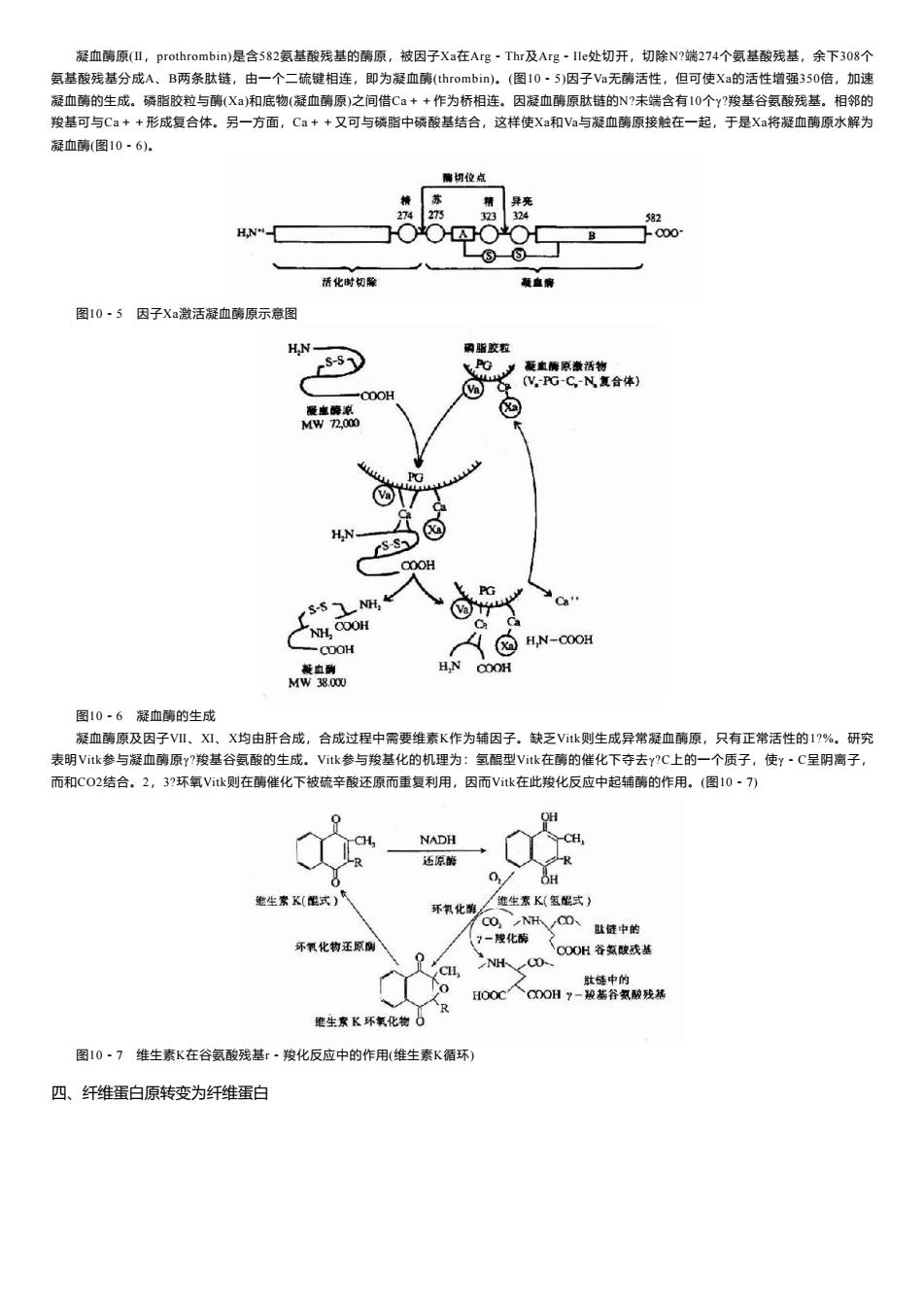
凝血酶原(l,prothrombin)是含582氨基酸残基的酶原,被因子Xa在Arg·Thr及Arg-Ile处切开,切除N?端274个氨基酸残基,余下308个 氨基酸残基分成A、B两条肽链,由一个二硫键相连,即为凝血酶(thrombin)。(图10-5)因子Va无酶活性,但可使Xa的活性增强350倍,加速 凝血酶的生成。磷脂胶粒与酶(X)和底物(凝血酶原)之间借Ca++作为桥相连。因凝血酶原肽链的N?未端含有10个y?羧基谷氨酸残基。相邻的 羧基可与Ca++形成复合体。另一方面,Ca++又可与磷脂中磷酸基结合,这样使Xa和Va与凝血酶原接触在一起,于是Xa将凝血酶原水解为 凝血酶(图10·6). 聊切位点 苏 异亮 274 275 23 324 582 HN Q00 活化时切除 凝血樂 图10·5因子Xa激活凝血酶原示意图 HN- 丽脂胶粒 S-S1 飞Gy 凝血酶原激活物 V,PG-C-N复合体) 餐血晚原 ② MW72,000 ●3 HN. S-Sp 00H PG S-S NH, NH,COOH -COOH ③H,N-ooOH 凝血酬 HN COOH MW38.00 图10·6凝血酶的生成 凝血酶原及因子VI、XⅪ、X均由肝合成,合成过程中需要维素K作为辅因子。缺乏Vtk则生成异常凝血酶原,只有正常活性的1?%。研究 表明Vitk参与凝血酶原y?羧基谷氨酸的生成。Vitk参与羧基化的机理为:氢醌型Vitk在的催化下夺去y?C上的一个质子,使y~C呈阴离子, 而和CO2结合。2,3?环氧Vitk则在酶催化下被硫辛酸还原而重复利用,因而Vtk在此羧化反应中起辅酶的作用。(图10·7) NADH 还原酶 OH 维生索K(能式) 维生素K(氢式) 环氧化南 O,NHR√C0、肚链中的 环氧化物还原倒 ?一我化酶 p COOH谷氢酸残基 CH 肚链中的 0 HO0 CCOOH-骏基谷氢酸残基 维生素K环氧化物O 图10·7维生素K在谷氨酸残基r·羧化反应中的作用(维生素K循环) 四、纤维蛋白原转变为纤维蛋白
凝血酶原(Ⅱ,prothrombin)是含582氨基酸残基的酶原,被因子Xa在Arg-Thr及Arg-Ile处切开,切除N?端274个氨基酸残基,余下308个 氨基酸残基分成A、B两条肽链,由一个二硫键相连,即为凝血酶(thrombin)。(图10-5)因子Va无酶活性,但可使Xa的活性增强350倍,加速 凝血酶的生成。磷脂胶粒与酶(Xa)和底物(凝血酶原)之间借Ca++作为桥相连。因凝血酶原肽链的N?未端含有10个γ?羧基谷氨酸残基。相邻的 羧基可与Ca++形成复合体。另一方面,Ca++又可与磷脂中磷酸基结合,这样使Xa和Va与凝血酶原接触在一起,于是Xa将凝血酶原水解为 凝血酶(图10-6)。 图10-5 因子Xa激活凝血酶原示意图 图10-6 凝血酶的生成 凝血酶原及因子Ⅶ、Ⅺ、Ⅹ均由肝合成,合成过程中需要维素K作为辅因子。缺乏Vitk则生成异常凝血酶原,只有正常活性的1?%。研究 表明Vitk参与凝血酶原γ?羧基谷氨酸的生成。Vitk参与羧基化的机理为:氢醌型Vitk在酶的催化下夺去γ?C上的一个质子,使γ-C呈阴离子, 而和CO2结合。2,3?环氧Vitk则在酶催化下被硫辛酸还原而重复利用,因而Vitk在此羧化反应中起辅酶的作用。(图10-7) 图10-7 维生素K在谷氨酸残基r-羧化反应中的作用(维生素K循环) 四、纤维蛋白原转变为纤维蛋白