
第一节概述 体内大部分物质都可进行氧化反应,在生物体内进行的氧化反应与体外氧化反应有许多共同之处:它们都遵循氧化反应的一般规律,常见 的氧化方式有脱电子、脱氢和加氧等类型;最终氧化分解产物是C02和H20,同时释放能量。但是生物氧化反应又有其特点:①体外氧化反应 主要以热能形式释放能量;而生物氧化主要以生成ATP方式释放能量,为生物体所利用。②其最大区别在于:体外氧化往往在高温,强酸,强 碱或强氧化剂的催化下进行;而生物氧化是在恒温(37℃)和中性H环境下进行,催化氧化反应的催化剂是酶。 一、生物氧化酶类 体内催化氧化反应的酶有许多种,按照其催化氧化反应方式不同可分为三大类。 (一)脱氢氧化酶类 这一类中依据其反应受氢体或氧化产物不同,又可以分为三种, 1.氧化酶类(oxidases) 氧化酶直接作用于底物,以氧作为受氢体或受电子体,生成产物是水。氧化酶均为结合蛋白质,辅基常含有C2+,如细胞色素氧化酶、酚 氧化酶、抗坏血酸氧化酶等。抗坏血酸氧化酶可催化下述反应: 抗坏血酸越年复化通脱氢抗坏直酸十H,0 +1/202 2.需氧脱氢酶类(aerobic dehydrogenases) 需氧脱氢酶以FAD或FMN为辅基,以氧为直接受氢体,产物为H2O2或超氧离子(O2),某些色素如甲烯蓝(methylene blue,MB)、铁氰化钾 (【K3F(CN)6]、二氯酚靛酚可以作为这类酶的人工受氢体。如D?氨基酸氧化酶(辅基FAD)、L-氨基酸氧化酶(辅基FMN)、黄嘌呤氧化酶(辅 基FAD)、醛脱氢酶(辅基FAD)、单胺氧化酶(辅基FAD)、二胺氧化酶等。 胺YO,+H0 次黄呤(或黄吟)HO+O 醛人H,O,+NH 黄票岭(成尿酸) 人H0, 单胺氧化醇(含FAD) 黄琴吟氧化醇(含FAD.Mo.Fe) 粒细胞中NADH氧化酶和NADPH氧化酶也是需氧脱氢酶,它们催化下述反应: NAD(P)H+20,NADP)H氯化鹰NAD(P)+205+H+ 超氧离子在超氧化物歧化酶(superoxidedismutase,SOD)催化下生成H202与O2: 0+05+2Ht00H,0,+0, 3.不需氧脱氢酶类(anaerobic dehydrogenases) 这是人体内主要的脱氢酶类,其直接受氢体不是O2,而只能是某些辅酶(NAD+、NADP+)或辅基(FAD、FMN),辅酶或辅基还原后又将氢 原子传递至线粒体氧化呼吸链,最后将电子传给氧生成水,在此过程中释放出来的能量使ADP磷酸化生成ATP,如3?磷酸甘油醛脱氢酶、琥珀 酸脱氢酶、细胞色素体系等。 3-磷酸甘油醛)YNAD+B 琥珀酸YFAD 1,3-二醉酸廿袖酸人NADH+H 延胡索酸入FADH 3一映酸甘油醛脱氢酶 琥珀酸脱氢酶(SDH) 4.加氧酶类(oxygenases) 顾名思义,加氧酶催化加氧反应。根据向底物分子中加入氧原子的数目,又可分为加单氧酶(monooxygenase)和加双氧酶(dioxygenase): (I)加单氧酶又称为多功能氧化酶、混合功能氧化酶(mixed function oxidase)、羟化酶(hydroxylase)。加单氧酶催化O2分子中的一个原子 加到底物分子上使之羟化,另一个氧原子被NDPH+H+提供的氢还原生成水,在此氧化过程中无高能磷酸化合物生成,反应如下: RH+NADPH+H+O,加#毫ROH+NADP+HO 加单氧酶实际上是含有黄素酶及细胞色素的酶体系,常常是由细胞色素P450、NADPH细胞色素P450还原酶、NADPH和磷脂组成的复合 物。细胞色素P450是一种以血色素为辅基的b族细胞色素,其中的Fe3+可被Na2S203等还原为Fe2+,还原型的细胞色素P450与C0结合后在 450nm有最大吸收峰,故名细胞色素P450,它的作用类似于细胞色素aa3,能与氧直接反应,将电子传递给氧,因此也是一种终末氧化酶. 加单氧酶主要分布在肝、肾组织微粒体中,少数加单氧酶也存在于线粒体中,加单氧酶主要参与类固醇激素(性激素、肾上腺皮质激素)、 胆汁酸盐、胆色素、活性维生素D的生成和某些药物、毒物的生物转化过程。加单氧酶可受底物诱导,而且细胞色素P450基质特异性低,一种 基质提高了加单氧酶的活性便可同时加快几种物质的代谢速度,这与体内的药物代谢关系十分密切,例如以苯巴比妥作诱导物,可以提高机体 代谢胆红素、睾酮、氢化可地松、香豆素、洋地黄毒苷的速度,临床用药时应予考虑
第一节 概 述 体内大部分物质都可进行氧化反应,在生物体内进行的氧化反应与体外氧化反应有许多共同之处:它们都遵循氧化反应的一般规律,常见 的氧化方式有脱电子、脱氢和加氧等类型;最终氧化分解产物是CO2和H2O,同时释放能量。但是生物氧化反应又有其特点:①体外氧化反应 主要以热能形式释放能量;而生物氧化主要以生成ATP方式释放能量,为生物体所利用。②其最大区别在于:体外氧化往往在高温,强酸,强 碱或强氧化剂的催化下进行;而生物氧化是在恒温(37℃)和中性pH环境下进行,催化氧化反应的催化剂是酶。 一、生物氧化酶类 体内催化氧化反应的酶有许多种,按照其催化氧化反应方式不同可分为三大类。 (一)脱氢氧化酶类 这一类中依据其反应受氢体或氧化产物不同,又可以分为三种。 1.氧化酶类(oxidases) 氧化酶直接作用于底物,以氧作为受氢体或受电子体,生成产物是水。氧化酶均为结合蛋白质,辅基常含有Cu2+,如细胞色素氧化酶、酚 氧化酶、抗坏血酸氧化酶等。抗坏血酸氧化酶可催化下述反应: 2.需氧脱氢酶类(aerobic dehydrogenases) 需氧脱氢酶以FAD或FMN为辅基,以氧为直接受氢体,产物为H2O2或超氧离子(O2),某些色素如甲烯蓝(methylene blue,MB)、铁氰化钾 ([K3Fe(CN)6]、二氯酚靛酚可以作为这类酶的人工受氢体。如D?氨基酸氧化酶(辅基FAD)、L-氨基酸氧化酶(辅基FMN)、黄嘌呤氧化酶(辅 基FAD)、醛脱氢酶(辅基FAD)、单胺氧化酶(辅基FAD)、二胺氧化酶等。 粒细胞中NADH氧化酶和NADPH氧化酶也是需氧脱氢酶,它们催化下述反应: 超氧离子在超氧化物歧化酶(superoxidedismutase,SOD)催化下生成H2O2与O2: 3.不需氧脱氢酶类(anaerobic dehydrogenases) 这是人体内主要的脱氢酶类,其直接受氢体不是O2,而只能是某些辅酶(NAD+、NADP+)或辅基(FAD、FMN),辅酶或辅基还原后又将氢 原子传递至线粒体氧化呼吸链,最后将电子传给氧生成水,在此过程中释放出来的能量使ADP磷酸化生成ATP,如3?磷酸甘油醛脱氢酶、琥珀 酸脱氢酶、细胞色素体系等。 4.加氧酶类(oxygenases) 顾名思义,加氧酶催化加氧反应。根据向底物分子中加入氧原子的数目,又可分为加单氧酶(monooxygenase)和加双氧酶(dioxygenase)。 (1)加单氧酶 又称为多功能氧化酶、混合功能氧化酶(mixed function oxidase)、羟化酶(hydroxylase)。加单氧酶催化O2分子中的一个原子 加到底物分子上使之羟化,另一个氧原子被NADPH+H+提供的氢还原生成水,在此氧化过程中无高能磷酸化合物生成,反应如下: 加单氧酶实际上是含有黄素酶及细胞色素的酶体系,常常是由细胞色素P450、NADPH细胞色素P450还原酶、NADPH和磷脂组成的复合 物。细胞色素P450是一种以血色素为辅基的b族细胞色素,其中的Fe3+可被Na2S2O3等还原为Fe2+,还原型的细胞色素P450与CO结合后在 450nm有最大吸收峰,故名细胞色素P450,它的作用类似于细胞色素aa3,能与氧直接反应,将电子传递给氧,因此也是一种终末氧化酶。 加单氧酶主要分布在肝、肾组织微粒体中,少数加单氧酶也存在于线粒体中,加单氧酶主要参与类固醇激素(性激素、肾上腺皮质激素)、 胆汁酸盐、胆色素、活性维生素D的生成和某些药物、毒物的生物转化过程。加单氧酶可受底物诱导,而且细胞色素P450基质特异性低,一种 基质提高了加单氧酶的活性便可同时加快几种物质的代谢速度,这与体内的药物代谢关系十分密切,例如以苯巴比妥作诱导物,可以提高机体 代谢胆红素、睾酮、氢化可地松、香豆素、洋地黄毒苷的速度,临床用药时应予考虑

(2)加双氧酶此酶催化02分子中的两个原子分别加到底物分子中构成双键的两个碳原子上,如色氨酸毗咯酶(色氨酸加双氧酶)、胡萝卜素 加双氧酶分别催化下述反应: CH,-CHCOOH 色氨酸呲咯群、0 -CH,-CHCOOH NH, (色氮酸脚双氧酶) -NHCHO NH, 色氨酸 甲酰犬尿酸元 CH。-CH=CH-C B-胡数卜常 CHCHO 加双氧群,O B一胡梦卜素 视黄醛 5.过氧化氢酶和过氧化物酶 前已叙及需氧脱氢酶和超氧化物歧化酶催化的反应中有H202生成。过氧化氢具有一定的生理作用,粒细胞和吞噬细胞中的H202可杀死吞 噬的细菌,甲状腺上皮细胞和粒细胞中的H202可使?氧化生成12,进而使蛋白质碘化,这与甲状腺素的生成和消灭细菌有关。但是H202也可 使巯基酶和蛋白质氧化失活,还能氧化生物膜磷脂分子中的多不饱和脂防酸,损伤生物膜结构、影响生物膜的功能,此外H2O2还能破坏核酸 和粘多糖。人体某些组织如肝、肾、中性粒细胞及小肠粘膜上皮细胞中的过氧化物酶体内含有过氧化氢酶(触酶)和过氧化物酶,可利用或消除 细胞内的H2O2和过氧化物,防止其含量过高而起保护作用。 (1)过氧化氢酶(Catalase)此酶催化两个H202分子的氧化还原反应,生成H20并释放出02. H,0,+H,0,过x化氢鹿2H,0+0: 过氧化氢酶的催化效率极高,每个酶分子在0℃每分钟可催化264万个过氧化氢分子分解,因此人体一般不会发生H202的蓄积中毒。 (2)过氧化物酶(Peroxidase)此酶催化H2O2或过氧化物直接氧化酚类或胺类物质. R+H202一一→R0+H20或RH2+H202一-→R+2H20 某些组织的细胞中还有一种含硒(Se)的谷胱甘肽过氧化物酶(glutathione peroxidase),可催化下述反应: H202+2G-SH- -→2H20+GSSG ROOH+2G-SH- .→ROH+GSSG+H2O 生成的GSSG又可在谷胱甘肽还原酶催化下由NADPH+H+供氢还原生成G-SH: GSSG+NADPH十H+谷肤甘#还NADP++2G一SH 临床工作中判定粪便、消化液中是否有隐血时,就是利用血细胞中的过氧化物酶活性将愈创木酯或联苯胺氧化成蓝色化合物。 二、生物氧化的基本概念 机体内进行的脱氢,加氧等氧化反应总称为生物氧化,按照生理意义不同可分为两大类,一类主要是将代谢物或药物和毒物等通过氧化反 应进行生物转化,这类反应不伴有ATP的生成;另一类是糖、脂肪和蛋白质等营养物质通过氧化反应进行分解,生成H2O和CO2,同时伴有 ATP生物能的生成,这类反应进行过程中细胞要摄取O2,释放CO2故又形象地称之为细胞呼吸(cellularrespiration). 代谢物在体内的氧化可以分为三个阶段,首行是糖、脂肪和蛋白质经过分解代谢生成乙酰辅酶A中的乙酰基;接着乙酰辅酶A进入三羧酸 循环脱氢,生成CO2并使NAD+和FAD还原成NADH+H+、FADH2;第三阶段是NADH+H+和FADH2中的氢经呼吸链将电子传递给氧生成水, 氧化过程中释放出来的能量用于ATP合成。从广义来讲,上述三个阶段均为生物氧化,狭义地说只有第三个阶段才算是生物氧化,这是体内能 量生成的主要阶段,有关的前两个阶段已在代谢各章中讲述,本章只讨论第三个阶段,即代谢物脱下的氢是如何交给氧生成水的?细胞通过什 么方式将氧化过程中释放的能量转变成ATP分子中的高能键的? 第二节呼吸链 呼吸链(respiratorychain)是由一系列的递氢体(hydrogen transfer)和递电子体(eletron transfer)按一定的顺序排列所组成的连续反应体系, 它将代谢物脱下的成对氢原子交给氧生成水,同时有ATP生成。实际上呼吸链的作用代表着线粒体最基本的功能,呼吸链中的递氢体和递电子 体就是能传递氢原子或电子的载体,由于氢原子可以看作是由H+和组成的,所以递氢体也是递电子体,递氢体和递电子体的本质是酶、辅 酶、铺基或辅因子。 一、呼吸链的组成 构成呼吸链的递氢体和递电子体主要分为以下五类 (一)尼克酰胺腺嘌呤二核苷酸NAD+)或称辅酶I(Co。 为体内很多脱氢酶的辅酶,是连接作用物与呼吸链的重要环节,分子中除含尼克酰胺(维生素PP)外,还含有核糖、磷酸及一分子腺苷酸 (AMP),其结构如下:
(2)加双氧酶 此酶催化O2分子中的两个原子分别加到底物分子中构成双键的两个碳原子上,如色氨酸吡咯酶(色氨酸加双氧酶)、胡萝卜素 加双氧酶分别催化下述反应: 5.过氧化氢酶和过氧化物酶 前已叙及需氧脱氢酶和超氧化物歧化酶催化的反应中有H2O2生成。过氧化氢具有一定的生理作用,粒细胞和吞噬细胞中的H2O2可杀死吞 噬的细菌,甲状腺上皮细胞和粒细胞中的H2O2可使I?氧化生成I2,进而使蛋白质碘化,这与甲状腺素的生成和消灭细菌有关。但是H2O2也可 使巯基酶和蛋白质氧化失活,还能氧化生物膜磷脂分子中的多不饱和脂肪酸,损伤生物膜结构、影响生物膜的功能,此外H2O2还能破坏核酸 和粘多糖。人体某些组织如肝、肾、中性粒细胞及小肠粘膜上皮细胞中的过氧化物酶体内含有过氧化氢酶(触酶)和过氧化物酶,可利用或消除 细胞内的H2O2和过氧化物,防止其含量过高而起保护作用。 (1)过氧化氢酶(Catalase)此酶催化两个H2O2分子的氧化还原反应,生成H2O并释放出O2。 过氧化氢酶的催化效率极高,每个酶分子在0℃每分钟可催化264万个过氧化氢分子分解,因此人体一般不会发生H2O2的蓄积中毒。 (2)过氧化物酶(Peroxidase)此酶催化H2O2或过氧化物直接氧化酚类或胺类物质。 R+H2O2——→RO+H2O或RH2+H2O2——→R+2H2O 某些组织的细胞中还有一种含硒(Se)的谷胱甘肽过氧化物酶(glutathione peroxidase),可催化下述反应: H2O2+2G-SH——→2H2O+GSSG ROOH+2G-SH——→ROH+GSSG+H2O 生成的GSSG又可在谷胱甘肽还原酶催化下由NADPH+H+供氢还原生成G-SH: 临床工作中判定粪便、消化液中是否有隐血时,就是利用血细胞中的过氧化物酶活性将愈创木酯或联苯胺氧化成蓝色化合物。 二、生物氧化的基本概念 机体内进行的脱氢,加氧等氧化反应总称为生物氧化,按照生理意义不同可分为两大类,一类主要是将代谢物或药物和毒物等通过氧化反 应进行生物转化,这类反应不伴有ATP的生成;另一类是糖、脂肪和蛋白质等营养物质通过氧化反应进行分解,生成H2O和CO2,同时伴有 ATP生物能的生成,这类反应进行过程中细胞要摄取O2,释放CO2故又形象地称之为细胞呼吸(cellularrespiration)。 代谢物在体内的氧化可以分为三个阶段,首行是糖、脂肪和蛋白质经过分解代谢生成乙酰辅酶A中的乙酰基;接着乙酰辅酶A进入三羧酸 循环脱氢,生成CO2并使NAD+和FAD还原成NADH+H+、FADH2;第三阶段是NADH+H+和FADH2中的氢经呼吸链将电子传递给氧生成水, 氧化过程中释放出来的能量用于ATP合成。从广义来讲,上述三个阶段均为生物氧化,狭义地说只有第三个阶段才算是生物氧化,这是体内能 量生成的主要阶段,有关的前两个阶段已在代谢各章中讲述,本章只讨论第三个阶段,即代谢物脱下的氢是如何交给氧生成水的?细胞通过什 么方式将氧化过程中释放的能量转变成ATP分子中的高能键的? 第二节 呼 吸 链 呼吸链(respiratorychain)是由一系列的递氢体(hydrogen transfer)和递电子体(eletron transfer)按一定的顺序排列所组成的连续反应体系, 它将代谢物脱下的成对氢原子交给氧生成水,同时有ATP生成。实际上呼吸链的作用代表着线粒体最基本的功能,呼吸链中的递氢体和递电子 体就是能传递氢原子或电子的载体,由于氢原子可以看作是由H+和e组成的,所以递氢体也是递电子体,递氢体和递电子体的本质是酶、辅 酶、辅基或辅因子。 一、呼吸链的组成 构成呼吸链的递氢体和递电子体主要分为以下五类 (一)尼克酰胺腺嘌呤二核苷酸(NAD+)或称辅酶I(CoI)。 为体内很多脱氢酶的辅酶,是连接作用物与呼吸链的重要环节,分子中除含尼克酰胺(维生素PP)外,还含有核糖、磷酸及一分子腺苷酸 (AMP),其结构如下:
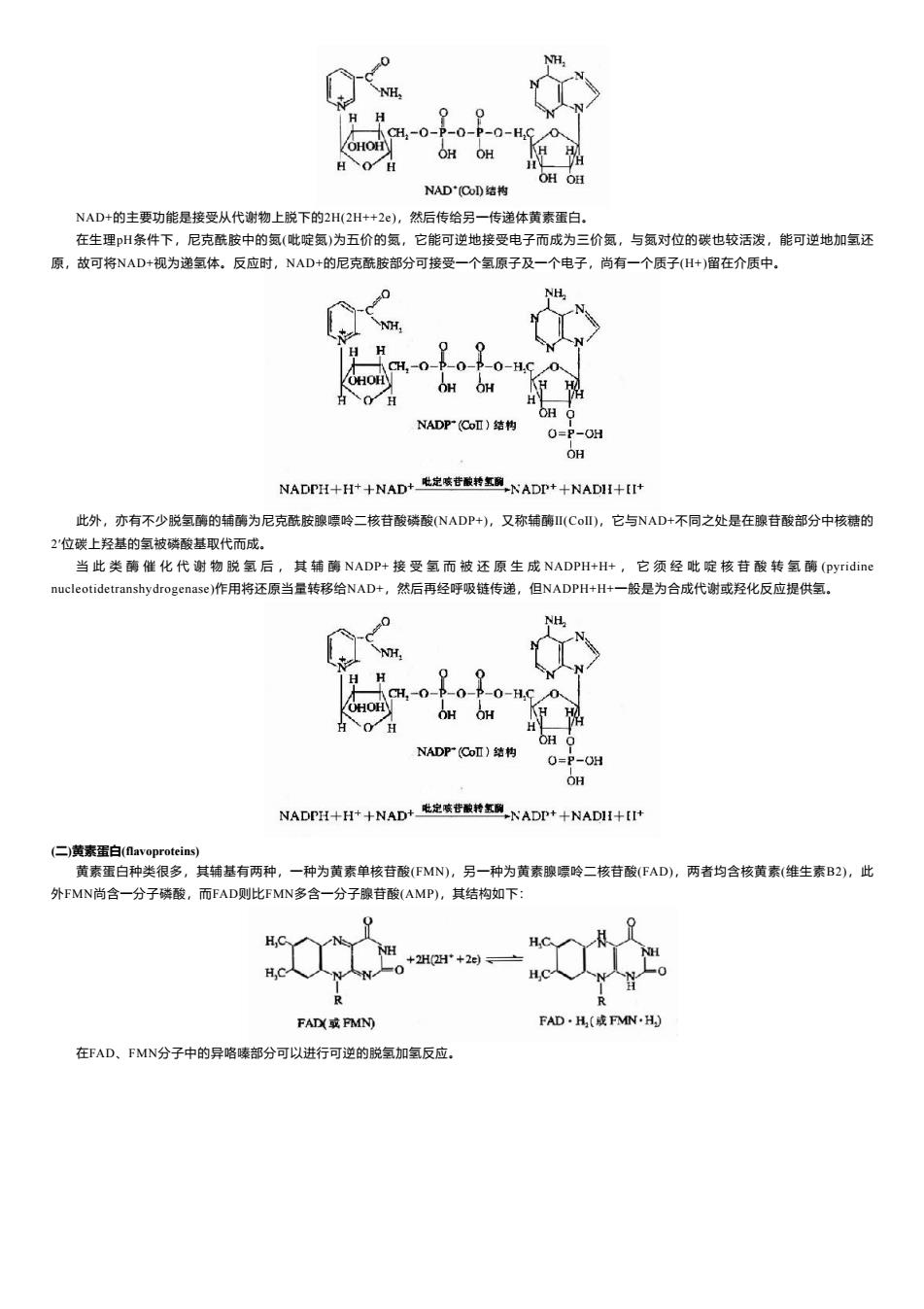
H H CH-0-P-0-P-0-H,C /OHOH OHOH H OH O NAD'(Co结构 NAD+的主要功能是接受从代谢物上脱下的2H(2H++2),然后传给另一传递体黄素蛋白。 在生理H条件下,尼克酰胺中的氨(吡啶氨)为五价的氨,它能可逆地接受电子而成为三价氨,与氨对位的碳也较活泼,能可逆地加氢还 原,故可将NAD+视为递氢体。反应时,NAD+的尼克酰胺部分可接受一个氢原子及一个电子,尚有一个质子(H+)留在介质中。 NH CH,-0-p-0-p-0-H.C OHOH OH OH H OH O NADP(Coll)结构 0=P-0H OH NADPH+-H+十NAD+定孩苷酸转氢NADP+十NADI+I时 此外,亦有不少脱氢酶的辅酶为尼克酰胺腺嘌呤二核苷酸磷酸(NADP+),又称辅酶I(CoI),它与NAD+不同之处是在腺苷酸部分中核糖的 2'位碳上羟基的氢被磷酸基取代而成。 当此类酶催化代谢物脱氢后,其辅酶NADP+接受氢而被还原生成NADPH+H+,它须经吡啶核苷酸转氢酶(pyridine nucleotidetranshydrogenase)作用将还原当量转移给NAD+,然后再经呼吸链传递,但NADPH+H+一般是为合成代谢或羟化反应提供氢。 H NH CH,-0-P-0-P-0-HC OHOH OH OH H 0 H OH Q NADP (Coll)结构 O=P-OH OH NADPH-+H+十NAD+飞定陵苷酸转氢NADP++NADI+-IIt (二)黄素蛋白(flavoproteins) 黄素蛋白种类很多,其辅基有两种,一种为黄素单核苷酸(FMN),另一种为黄素腺嘌呤二核苷酸(FAD),两者均含核黄素(维生素B2),此 外FMN尚含一分子磷酸,而FAD则比FMN多含一分子腺苷酸(AMP),其结构如下: H,9 H = +2H+2 FAD或FMN FAD·H(或FMN·H) 在FAD、FMN分子中的异咯嗪部分可以进行可逆的脱氢加氢反应
NAD+的主要功能是接受从代谢物上脱下的2H(2H++2e),然后传给另一传递体黄素蛋白。 在生理pH条件下,尼克酰胺中的氮(吡啶氮)为五价的氮,它能可逆地接受电子而成为三价氮,与氮对位的碳也较活泼,能可逆地加氢还 原,故可将NAD+视为递氢体。反应时,NAD+的尼克酰胺部分可接受一个氢原子及一个电子,尚有一个质子(H+)留在介质中。 此外,亦有不少脱氢酶的辅酶为尼克酰胺腺嘌呤二核苷酸磷酸(NADP+),又称辅酶Ⅱ(CoⅡ),它与NAD+不同之处是在腺苷酸部分中核糖的 2′位碳上羟基的氢被磷酸基取代而成。 当 此 类 酶 催 化 代 谢 物 脱 氢 后 , 其 辅 酶 NADP+ 接 受 氢 而 被 还 原 生 成 NADPH+H+ , 它 须 经 吡 啶 核 苷 酸 转 氢 酶 (pyridine nucleotidetranshydrogenase)作用将还原当量转移给NAD+,然后再经呼吸链传递,但NADPH+H+一般是为合成代谢或羟化反应提供氢。 (二)黄素蛋白(flavoproteins) 黄素蛋白种类很多,其辅基有两种,一种为黄素单核苷酸(FMN),另一种为黄素腺嘌呤二核苷酸(FAD),两者均含核黄素(维生素B2),此 外FMN尚含一分子磷酸,而FAD则比FMN多含一分子腺苷酸(AMP),其结构如下: 在FAD、FMN分子中的异咯嗪部分可以进行可逆的脱氢加氢反应

,蛋白质 a】 ●5 @ FD或FMN与酶蛋白部分之间是通过非共价键相连,但结合牢固,因此氧化与还原(即电子的失与得)都在同一个酶蛋白上进行,故黄素核 苷酸的氧化还原电位取决于和它们结合的蛋白质,所以有关的标准还原电位指的是特定的黄素蛋白,而不是游离的FMN或FAD;在电子转移反 应中它们只是在黄素蛋白的活性中心部分,而其本身不能作为作用物或产物,这和NAD+不同,NAD+与酶蛋白结合疏松,当与某酶蛋白结合 时可以从代谢物接受氢,而被还原为NADH,后者可以游离,再与另一种酶蛋白结合,释放氢后又被氧化为NAD+。 多数黄素蛋白参与呼吸链组成,与电子转移有关,如NADH脱氢酶(NADh dehydrogenase)以FMN为辅基,是呼吸链的组分之一,介于 NADH与其它电子传递体之间:琥珀酸脱氢酶,线粒体内的甘油磷酸脱氢酶(glycerol phosphate dehydrogenase)的辅基为FAD,它们可直接从 作用物转移还原当量H+e reducing equivalent)到呼吸链,此外脂肪酰CoA脱氢酶与琥珀酸脱氢酶相似,亦属于FAD为辅基的黄素蛋白类,也 能将还原当量从作用物传递进入呼吸链,但中间尚需另一电子传递体称为电子转移黄素蛋白(electron?transferring flavo?protein,ETFP,辅基为 FAD)参与才能完成。 (三)铁硫蛋白(iron?sulfur proteins,.Fe-S) 又称铁硫中心,其特点是含铁原子。铁是与无机硫原子或是蛋白质肽链上半胱氨酸残基的硫相结合,常见的铁硫蛋白有三种组合方式()单 个铁原子与4个半胱氨酸残基上的疏基硫相连。(b)两个铁原子、两个无机硫原子组成(2F-2S),其中每个铁原子还各与两个半胱氨酸残基的疏 基硫相结合。(c)由4个铁原子与4个无机硫原子相连(4F?4S),铁与硫相间排列在一个正六面体的8个顶角端;此外4个铁原子还各与一个半胱氨 酸残基上的疏基硫相连(图6-1)。 Fet Fott 图6·1铁硫蛋白结构 (a)单个铁与半胱氨酸硫相连(b)2Fe-2S(c)4Fe-4S 铁硫蛋白中的铁可以呈两价(还原型),也可呈三价(氧化型),由于铁的氧化、还原而达到传递电子作用
FAD或FMN与酶蛋白部分之间是通过非共价键相连,但结合牢固,因此氧化与还原(即电子的失与得)都在同一个酶蛋白上进行,故黄素核 苷酸的氧化还原电位取决于和它们结合的蛋白质,所以有关的标准还原电位指的是特定的黄素蛋白,而不是游离的FMN或FAD;在电子转移反 应中它们只是在黄素蛋白的活性中心部分,而其本身不能作为作用物或产物,这和NAD+不同,NAD+与酶蛋白结合疏松,当与某酶蛋白结合 时可以从代谢物接受氢,而被还原为NADH,后者可以游离,再与另一种酶蛋白结合,释放氢后又被氧化为NAD+。 多数黄素蛋白参与呼吸链组成,与电子转移有关,如NADH脱氢酶(NADh dehydrogenase)以FMN为辅基,是呼吸链的组分之一,介于 NADH与其它电子传递体之间;琥珀酸脱氢酶,线粒体内的甘油磷酸脱氢酶(glycerol phosphate dehydrogenase)的辅基为FAD,它们可直接从 作用物转移还原当量H++e reducing equivalent)到呼吸链,此外脂肪酰CoA脱氢酶与琥珀酸脱氢酶相似,亦属于FAD为辅基的黄素蛋白类,也 能将还原当量从作用物传递进入呼吸链,但中间尚需另一电子传递体称为电子转移黄素蛋白(electron?transferring flavo?protein,ETFP,辅基为 FAD)参与才能完成。 (三)铁硫蛋白(iron?sulfur proteins,Fe-S) 又称铁硫中心,其特点是含铁原子。铁是与无机硫原子或是蛋白质肽链上半胱氨酸残基的硫相结合,常见的铁硫蛋白有三种组合方式(a)单 个铁原子与4个半胱氨酸残基上的巯基硫相连。(b)两个铁原子、两个无机硫原子组成(2Fe-2S),其中每个铁原子还各与两个半胱氨酸残基的巯 基硫相结合。(c)由4个铁原子与4个无机硫原子相连(4Fe?4S),铁与硫相间排列在一个正六面体的8个顶角端;此外4个铁原子还各与一个半胱氨 酸残基上的巯基硫相连(图6-1)。 图6-1 铁硫蛋白结构 (a)单个铁与半胱氨酸硫相连 (b)2Fe-2S (c)4Fe-4S 铁硫蛋白中的铁可以呈两价(还原型),也可呈三价(氧化型),由于铁的氧化、还原而达到传递电子作用
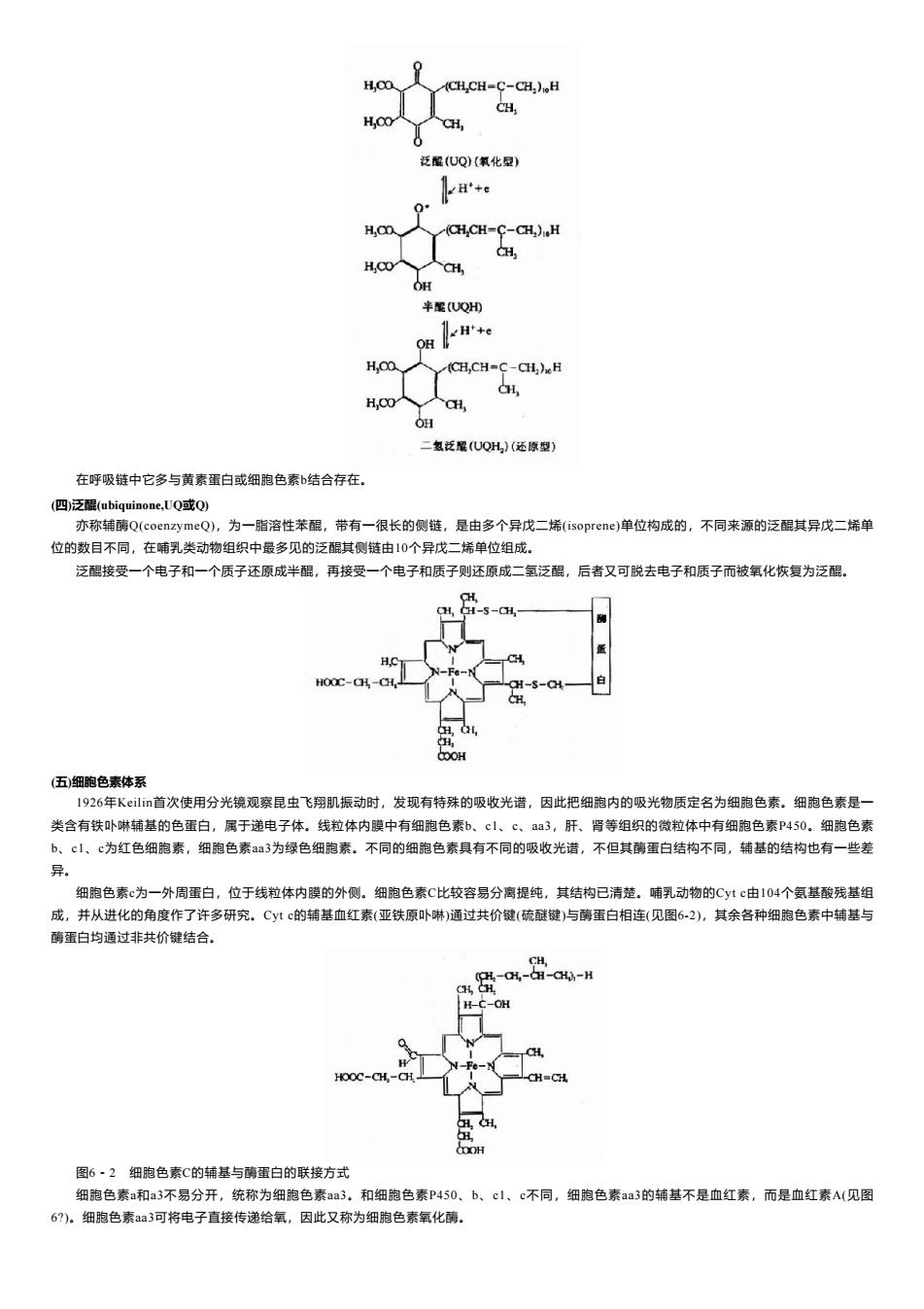
H,CO (CH,CH=C-CH)。H CH, H,CO CH, 泛鼠(UQ)(氧化型) 0* H,0 CH,CH=C-CH)。H H H,C人aH OH 半配UQH H'+e OH H,CO (CH,CH=C-CH,)H H H CO H OH 二氢泛曜(UQH)(还原型) 在呼吸链中它多与黄素蛋白或细胞色素b结合存在。 (四)泛醌(ubiquinone,Q或Q) 亦称辅酶Q(coenzymeQ),为一脂溶性苯醌,带有一很长的侧链,是由多个异戊二烯(isoprene)单位构成的,不同来源的泛醌其异戊二烯单 位的数目不同,在哺乳类动物组织中最多见的泛醌其侧链由10个异戊二烯单位组成。 泛醌接受一个电子和一个质子还原成半醌,再接受一个电子和质子则还原成二氢泛醌,后者又可脱去电子和质子而被氧化恢复为泛醌。 CH, H.H-S-●H 蛋 HC -Fe- HOOC-CH-CH- H-S- 白 (五)细胞色素体系 1926年Kεili首次使用分光镜观察昆虫飞翔肌振动时,发现有特殊的吸收光谱,因此把细胞内的吸光物质定名为细胞色素。细胞色素是一 类含有铁卟啉辅基的色蛋白,属于递电子体。线粒体内膜中有细胞色素b、cl、c、a3,肝、肾等组织的微粒体中有细胞色素P450。细胞色素 b、c1、c为红色细胞素,细胞色素aa3为绿色细胞素。不同的细胞色素具有不同的吸收光谱,不但其酶蛋白结构不同,辅基的结构也有一些差 异。 细胞色素c为一外周蛋白,位于线粒体内膜的外侧。细胞色素C比较容易分离提纯,其结构已清楚。哺乳动物的Cytc由104个氨基酸残基组 成,并从进化的角度作了许多研究。Cytc的辅基血红素(亚铁原卟琳)通过共价键(硫醚键)与酶蛋白相连(见图6-2),其余各种细胞色素中辅基与 酶蛋白均通过非共价键结合。 CH, (H-CH,--CH)-H CH,白H H-C-OH HO0C-CH-H CH=CH COOH 图6·2细胞色素C的辅基与酶蛋白的联接方式 细胞色素a和a3不易分开,统称为细胞色素aa3.和细胞色素P450、b、cl、c不同,细胞色素aa3的辅基不是血红素,而是血红素A(见图 6?)。细胞色素a3可将电子直接传递给氧,因此又称为细胞色素氧化酶
在呼吸链中它多与黄素蛋白或细胞色素b结合存在。 (四)泛醌(ubiquinone,UQ或Q) 亦称辅酶Q(coenzymeQ),为一脂溶性苯醌,带有一很长的侧链,是由多个异戊二烯(isoprene)单位构成的,不同来源的泛醌其异戊二烯单 位的数目不同,在哺乳类动物组织中最多见的泛醌其侧链由10个异戊二烯单位组成。 泛醌接受一个电子和一个质子还原成半醌,再接受一个电子和质子则还原成二氢泛醌,后者又可脱去电子和质子而被氧化恢复为泛醌。 (五)细胞色素体系 1926年Keilin首次使用分光镜观察昆虫飞翔肌振动时,发现有特殊的吸收光谱,因此把细胞内的吸光物质定名为细胞色素。细胞色素是一 类含有铁卟啉辅基的色蛋白,属于递电子体。线粒体内膜中有细胞色素b、c1、c、aa3,肝、肾等组织的微粒体中有细胞色素P450。细胞色素 b、c1、c为红色细胞素,细胞色素aa3为绿色细胞素。不同的细胞色素具有不同的吸收光谱,不但其酶蛋白结构不同,辅基的结构也有一些差 异。 细胞色素c为一外周蛋白,位于线粒体内膜的外侧。细胞色素C比较容易分离提纯,其结构已清楚。哺乳动物的Cyt c由104个氨基酸残基组 成,并从进化的角度作了许多研究。Cyt c的辅基血红素(亚铁原卟啉)通过共价键(硫醚键)与酶蛋白相连(见图6-2),其余各种细胞色素中辅基与 酶蛋白均通过非共价键结合。 图6-2 细胞色素C的辅基与酶蛋白的联接方式 细胞色素a和a3不易分开,统称为细胞色素aa3。和细胞色素P450、b、c1、c不同,细胞色素aa3的辅基不是血红素,而是血红素A(见图 6?)。细胞色素aa3可将电子直接传递给氧,因此又称为细胞色素氧化酶