
(二)Ea(activation energy)的物理意义: 1.阿氏解释: a)化学反应中分子必须碰撞 b)不是所有的碰撞都能进行化学反应 C)只有能量较高的分子碰撞后才能起 化学反应 这些高能量的分子叫做活化分子 “活化能是1mole普通分子变为活化分子 所需的能量
1 (二)Ea(activation energy)的物理意义: 1. 阿氏解释: “活化能是1 mole普通分子变为活化分子 所需的能量” a)化学反应中分子必须碰撞 b)不是所有的碰撞都能进行化学反应 C)只有能量较高的分子碰撞后才能起 化学反应 这些高能量的分子叫做活化分子

Ea=<E*>-<E> <E*>:1mole活化分子的能量 <E>:1mole普通分子的平均能量 2.为什么需要活化能: 两分子接近,发生化学反应 必使旧键断裂,新键生成 旧键从松弛到断裂需要获得能量 新键形成前两原子的相互接近也必有斥力 为克服此斥力,也必须获得能量
2 Ea = <E*> - <E> <E*>:1 mole 活化分子的能量 <E>:1 mole 普通分子的平均能量 2. 为什么需要活化能: 两分子接近,发生化学反应 必使旧键断裂,新键生成 旧键从松弛到断裂需要获得能量 新键形成前两原子的相互接近也必有斥力 为克服此斥力,也必须获得能量

例:2AB→A2+B2 A—B.B—A 体系中大部分分子具有平均能量 只有极少数能量高于平均能量的分子 即活化分子才具有克服这种阻力和斥力的 能力,才能发生化学反应 对普通分子,需要设法从外部获得这部分 活化能使之变成活化分子,才能进行反应 AB—B·A,B.A—A·B 3
3 例:2AB → A2 + B2 A—B.B—A 体系中大部分分子具有平均能量 只有极少数能量高于平均能量的分子 即活化分子才具有克服这种阻力和斥力的 能力,才能发生化学反应 对普通分子,需要设法从外部获得这部分 活化能使之变成活化分子,才能进行反应 A.B—B.A,B.A—A.B
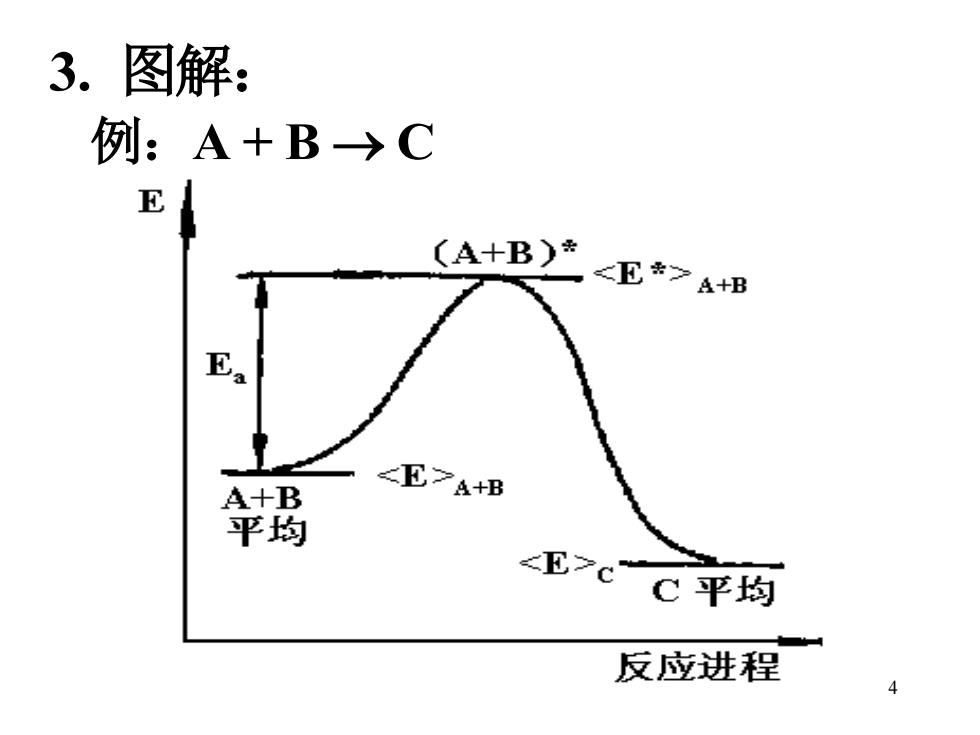
3.图解: 例:A+B→C E (A+B) <*>A+B Ea A+B EA+B 平均 <E7c C平均 反应进程
4 3. 图解: 例:A + B → C

反应物的平均能量<E>A+B* 比产物的平均能量<E>c高 但不能直接从A+B变为C 必须获得Ea的能量,使A十B由普通能量 <E>A+B变为<E*>A+B→(A+B)*→C 类似立砖不会 自动倒下来 Ea相当于化学 反应的推动能
5 反应物的平均能量<E>A+B* 比产物的平均能量<E>C高 但不能直接从 A+B 变为 C 必须获得 Ea的能量,使 A+B 由普通能量 <E>A+B变为<E*> A+B → (A+B)* →C 类似立砖不会 自动倒下来 Ea相当于化学 反应的推动能