
第五章化学平衡 化学平衡是研究化学反应体系的平衡问题: a)化学反应的方向和限度问题 b)各种状态反应的平衡常数表示式 c)各种条件对化学平衡的影响 §5.1化学反应的方向和限度 1.化学反应平衡条件 封闭体系,发生一化学反应: dG-SdT+VdP+∑μBdhg (W”=0) 等T,P,dG,p=ΣμBdhg
1 第五章 化学平衡 化学平衡是研究化学反应体系的平衡问题: a)化学反应的方向和限度问题 b)各种状态反应的平衡常数表示式 c)各种条件对化学平衡的影响 §5.1 化学反应的方向和限度 1. 化学反应平衡条件 封闭体系,发生一化学反应: dG= - SdT + VdP + Σ μB dnB (W’=0) 等 T,P,dGT,P =ΣμB dnB
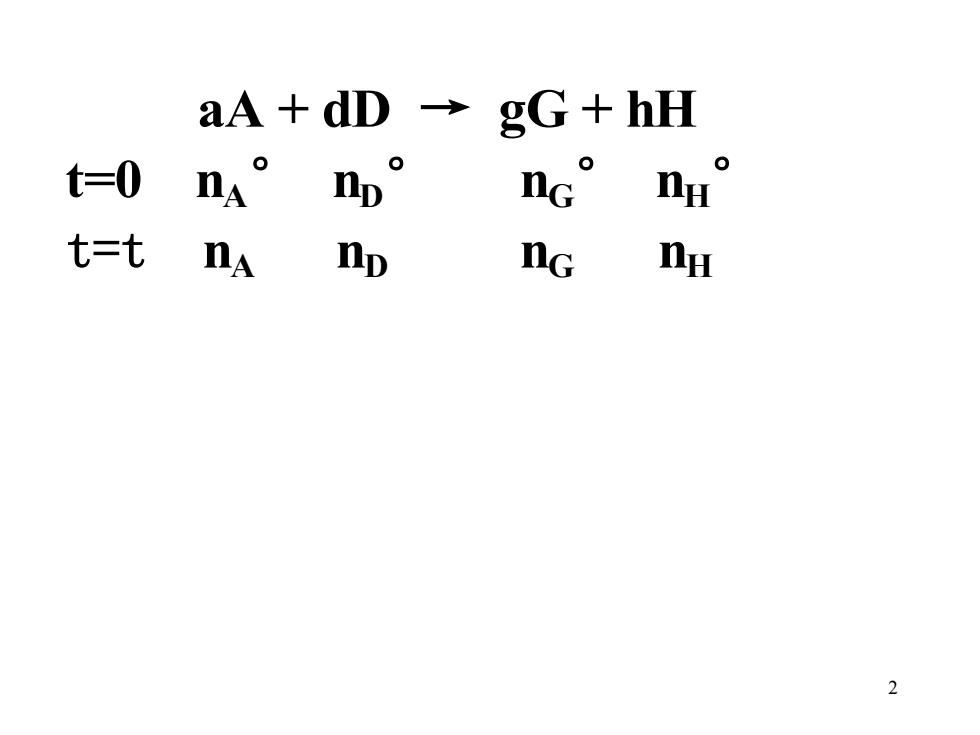
aA dD → gG+hH t=0 nA np nc nu t=t nA np nG nu 2
2 aA + dD → gG + hH t=0 nA ° nD ° nG ° nH ° t=t nA nD nG nH

名= nB-nB 定义:反应进度 VB d5= dna,dng=vads VB 等T,P,dGrP=∑μBdh=∑YB4sd5 OG △,Gm= =∑Yg 5), =(g4o+hH)-(aw4+dup) △Gm:等T,P反应的自由能随反应进度5的变化 或当dξ=lmol时,引起反应自由能的变化
3 定义:反应进度 B nB nB − = dn d dn d B B B B = , = 等 T,P,dGT,P =Σ μB dnB = B B d = = B B T P r m G G , ( ) ( ) = g G + h H − a A + d D r Gm :等 T,P 反应的自由能随反应进度 的变化 或当d = 1mol 时,引起反应自由能的变化

当△,Gm<0,(g4+h4H)<(au4+d4o) 反应物化学势高,反应向右进行自发反应 当△,Gm>0,(g4+h4H)>(a4A+duo) 产物化学势高,反应不能自发进行 当△Gm=0,产物与反应物化学势相等, 体系达平衡或可逆过程 4
4 当r Gm 0,( ) ( ) g G + h H a A + d D 反应物化学势高,反应向右进行自发反应 当r Gm 0,( ) ( ) g G + h H a A + d D 产物化学势高,反应不能自发进行 当r Gm = 0,产物与反应物化学势相等, 体系达平衡或可逆过程

化学反应的平衡条件: OG 等T,P下,△,Gm= 5 =∑B4B≤0 IT.P ∑Ys4B<0,自发进行 ∑yB4g=0,平衡,可逆 说明:VB反应计量系数,产物为“+”, 反应物为“_” 5
5 化学反应的平衡条件: 等 T,P下 , = = B B T P r m G G , ≤0 B B 0,自发进行 B B = 0,平衡,可逆 说明:νB反应计量系数,产物为“+”, 反应物为“-