
第二节配位滴定法的基本原理 一、配位平衡
第二节 配位滴定法的基本原理 一、配位平衡

(一)EDTA-金属离子的配位反应平衡 金属离子M与EDTA的反应通式为: Mn+Y4-=MYn-4 为简化,可省去电荷: M+Y-MY 反应的平衡常数表达式为: MY] KMY M]Y] KMw为一定温度时金属-EDTA配合物(MY)的稳定常数。 该常数值越大,说明配合物越稳定。因KMY通常较大, 所以实际应用时常使用IgKmy来表示。 《分析化学》第五章配位滴定法
金属离子M与EDTA的反应通式为: Mn+ + Y4- MYn-4 为简化,可省去电荷: M + Y MY 反应的平衡常数表达式为: 𝑲𝐌𝐘 = [𝐌𝐘] 𝐌 [𝐘] 𝑲𝐌𝐘为一定温度时金属-EDTA配合物(MY)的稳定常数。 该常数值越大,说明配合物越稳定。因 𝑲𝐌𝐘 通常较大, 所以实际应用时常使用lg𝑲𝐌𝐘来表示。 (一)EDTA-金属离子的配位反应平衡 《分析化学》第五章 配位滴定法 27
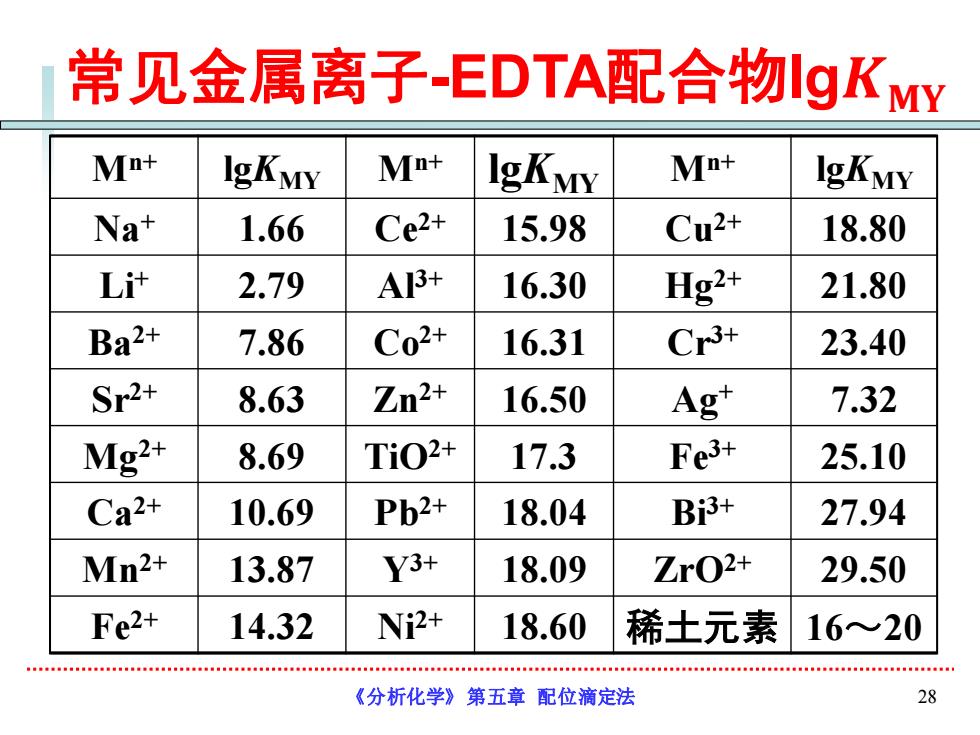
常见金属离子-EDTA配合物gKY Mn+ IgKMY Mn+ IgKMY Mn+ IgKMY Na+ 1.66 Ce2+ 15.98 Cu2+ 18.80 L计 2.79 A3+ 16.30 Hg2+ 21.80 Ba2+ 7.86 C02+ 16.31 Cr3+ 23.40 Sr2+ 8.63 Zn2+ 16.50 Ag" 7.32 Mg2+ 8.69 Ti02+ 17.3 Fe3+ 25.10 Ca2+ 10.69 Pb2+ 18.04 Bi3+ 27.94 Mn2+ 13.87 Y3+ 18.09 ZrO2+ 29.50 Fe2+ 14.32 Ni2+ 18.60 稀土元素 16≈20 《分析化学》第五章配位滴定法 28
《分析化学》第五章 配位滴定法 28 常见金属离子-EDTA配合物lg𝑲𝐌𝐘 Mn+ lgKMY Mn+ lgKMY Mn+ lgKMY Na+ 1.66 Ce2+ 15.98 Cu2+ 18.80 Li+ 2.79 Al3+ 16.30 Hg2+ 21.80 Ba2+ 7.86 Co2+ 16.31 Cr3+ 23.40 Sr2+ 8.63 Zn2+ 16.50 Ag+ 7.32 Mg2+ 8.69 TiO2+ 17.3 Fe3+ 25.10 Ca2+ 10.69 Pb2+ 18.04 Bi3+ 27.94 Mn2+ 13.87 Y3+ 18.09 ZrO2+ 29.50 Fe2+ 14.32 Ni2+ 18.60 稀土元素 16~20
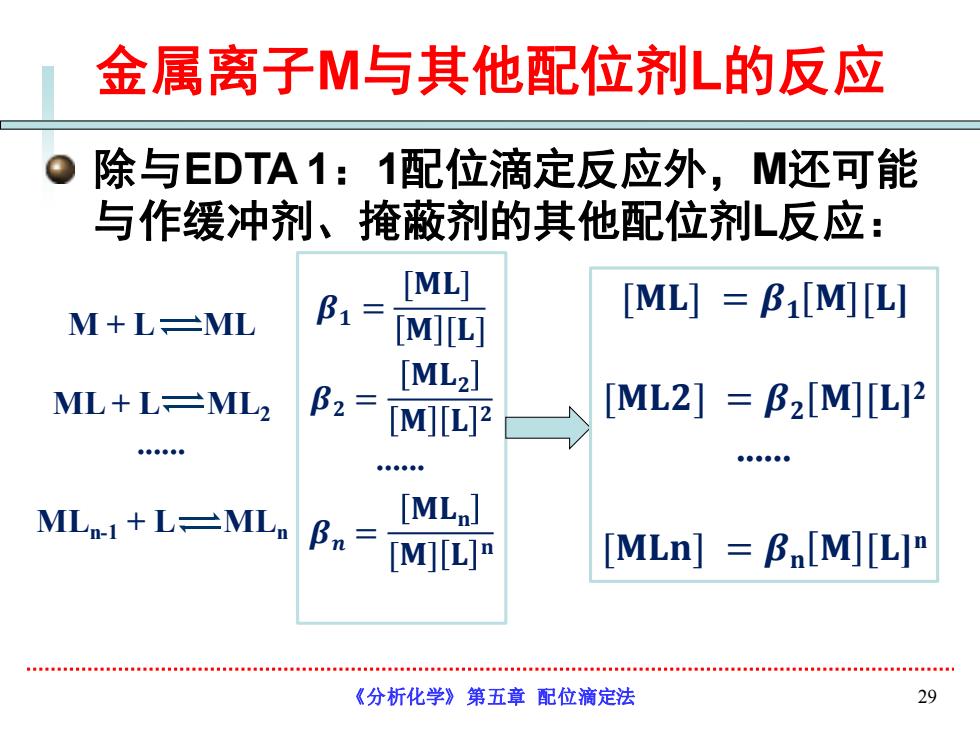
金属离子M与其他配位剂L的反应 除与EDTA1:1配位滴定反应外,M还可能 与作缓冲剂、掩蔽剂的其他配位剂L反应: [ML] [ML]=B[M][L] M+L-ML B1= [M[L] [ML2] ML+L-ML2 B2= [M][L2 [ML2]=B2[M[L2 MLn-1+L-ML [MLp] Bn= [MIL]" [MLn]B[M][L] 《分析化学》第五章配位滴定法 29
金属离子M与其他配位剂L的反应 除与EDTA 1:1配位滴定反应外,M还可能 与作缓冲剂、掩蔽剂的其他配位剂L反应: 《分析化学》第五章 配位滴定法 29 M + L ML ML + L ML2 . MLn-1 + L MLn 𝜷𝟏 = [𝐌𝐋] 𝐌 [𝐋] 𝜷𝟐 = 𝐌𝐋𝟐 𝐌 𝐋 𝟐 . 𝜷𝒏 = 𝐌𝐋𝐧 [𝐌] 𝐋 𝐧 [𝐌𝐋] = 𝜷𝟏 𝐌 [𝐋] [𝐌𝐋𝟐] = 𝜷𝟐 𝐌 [𝐋] 2 . [𝐌𝐋𝐧] = 𝜷𝐧 𝐌 [𝐋] n

金属离子M配合物溶液总浓度和平衡浓度 若金属离子M与配位剂L形成ML型配合物,则溶液 中M总浓度与平衡浓度的关系为: cM=[M+[ML]+[ML2]+.+[MLn] =[M]+B1[M[L]+B2[M[L]2++Bn[M[L]n =[M](1+B1[L+B2[L]2+.+Bn[L]) 《分析化学》第五章配位滴定法 30
金属离子M配合物溶液总浓度和平衡浓度 若金属离子M与配位剂L形成MLn型配合物,则溶液 中M总浓度与平衡浓度的关系为: cM= [M] + [ML] +[ML2 ] +. +[MLn ] = 𝐌 + 𝜷𝟏 𝐌 [𝐋] + 𝜷𝟐 𝐌 [𝐋] 2+.+𝜷𝐧 𝐌 [𝐋] n = [M](𝟏 + 𝜷𝟏 [𝐋] + 𝜷𝟐 [𝐋] 2 + . + 𝜷𝐧 [𝐋] n) 《分析化学》第五章 配位滴定法 30