
的方向,化学平衡,化学平衡的移动, 2教学基本要求: 熟练掌握:化学反应的组成变化与计算,恒温恒压下反应自发进行方向的判据,标准自由 能变化的有关计算,化学反应等温方程式,化学反应标准平衡常数的概念和表示方法,化学反 应标准自由能变化与标准平衡常数的关系。 掌握:焓、格变、等压反应热、热化学方程式,Hss定律,应用标准生成格、标准燃烧焓 进行反应烙的计算。自发过程、熵、吉布斯自由能的概念,化学平衡的移动,浓度、压力、温 度对化学平衡的影响。 了解:系统、环境、过程、状态函数、热、功、热力学能等热力学基本概念,热力学第 定律的基本内容,反应进度。热力学第二定律的基本内容。 3.教学重点难点: 重点:状态函数的特点,给定化学反应的格变、熵变、吉布斯自由能变△rGm的计算:吉 布斯方程与应用:用吉布斯自由能变化判断等温等压化学反应方向和限度:平衡常数与反应商、 标准吉布斯自由能变的关系与应用:化学反应等温式的意义与应用:化学平衡的移动。 难点:熵等热力学概念。 4教学建议: 理论与实践相结合,多媒体与版书相结合。 第六章:化学反应的速率与机理 1基本内容: 化学反应速率的基本概念,反应速率理论,浓度、温度、催化剂对反应速率的影响。 2教学基本要求: 热练掌握:化学反应速率方程的一般形式、反应级数、速率常数,元反应的质量作用定律, 一级反应、二级反应、零级反应的基本特征和有关计算。 掌握:反应速率的表示法,反应机理、基元反应、非基元反应,温度对反应速率的影响, 阿仑尼乌斯方程。 了解:碰撞理论,过渡状态理论,反应级数的确定方法,催化剂的基本特征,催化反应的 一般机理。 3教学重点难点: 重点:反应速率的意义及速率方程表达式:碰撞理论、过渡态活化络合物理论:一级反应 半衰期、速率常数及浓度计算:基元反应、复杂反应、反应级数、反应分子数、活化能等概念。 21
21 的方向,化学平衡,化学平衡的移动。 2.教学基本要求: 熟练掌握:化学反应的组成变化与计算,恒温恒压下反应自发进行方向的判据,标准自由 能变化的有关计算,化学反应等温方程式,化学反应标准平衡常数的概念和表示方法,化学反 应标准自由能变化与标准平衡常数的关系。 掌握:焓、焓变、等压反应热、热化学方程式,Hess 定律,应用标准生成焓、标准燃烧焓 进行反应焓的计算。自发过程、熵、吉布斯自由能的概念,化学平衡的移动,浓度、压力、温 度对化学平衡的影响。 了解:系统、环境、过程、状态函数、热、功、热力学能等热力学基本概念,热力学第一 定律的基本内容,反应进度。热力学第二定律的基本内容。 3.教学重点难点: 重点:状态函数的特点,给定化学反应的焓变、熵变、吉布斯自由能变 ΔrGm 的计算;吉 布斯方程与应用;用吉布斯自由能变化判断等温等压化学反应方向和限度;平衡常数与反应商、 标准吉布斯自由能变的关系与应用;化学反应等温式的意义与应用;化学平衡的移动。 难点:熵等热力学概念。 4.教学建议: 理论与实践相结合,多媒体与版书相结合。 第六章:化学反应的速率与机理 1.基本内容: 化学反应速率的基本概念,反应速率理论,浓度、温度、催化剂对反应速率的影响。 2.教学基本要求: 熟练掌握:化学反应速率方程的一般形式、反应级数、速率常数,元反应的质量作用定律, 一级反应、二级反应、零级反应的基本特征和有关计算。 掌握:反应速率的表示法,反应机理、基元反应、非基元反应,温度对反应速率的影响, 阿仑尼乌斯方程。 了解:碰撞理论,过渡状态理论,反应级数的确定方法,催化剂的基本特征,催化反应的 一般机理。 3.教学重点难点: 重点:反应速率的意义及速率方程表达式;碰撞理论、过渡态活化络合物理论;一级反应 半衰期、速率常数及浓度计算;基元反应、复杂反应、反应级数、反应分子数、活化能等概念

难点:反应速率的基本理论(碰撞理论,过渡状态理论)及活化能:用Arhenius经验公式进 行有关的计算。 4敦学建议: 理论与实践相结合,多媒体与版书相结合。 第七章:氧化还原反应 1基本内容: 氧化还原反应基本概念,电池和电池电动势,电极和电极电势。 2.教学基本要求: 熟练掌握:电池电动势与电池反应的自由能变化的关系,标淮电动势与电池反应的标准平 衡常数的关系,电极电势,电极和电池的能斯特方程,应用电极电势和电动势判断氧化剂还原 剂相对强弱、判断反应方向、计算标准平衡常数。 掌握:影响电极电势的因素。 了解:原电池的组成和电池组成式的书写,电极电势和电动势产生机理,电极的分类,电 位法测溶液p州的原理和方法。 3教学重点难点: 重点:氧化还原反应的基本概念,氧化还原方程式配平,原电池的表达方式;应用电极电 位表讨论元素不同氧化态下的氧化还原性的强弱:判断氧化还原反应的方向及平衡常数的计算: Nernst方程的应用,判断标准态下和非标准状态下氧化还原反应的方向:应用标准电极电位计 算平衡常数。 难点:原电池的表达方式,Nerst方程的应用,判断标准态下和非标准状态下氧化还原反 应的方向:应用标准电极电位计算平衡常数。 4.教学建议 理论与实践相结合,多媒体与版书相结合。 第八章:原子结构与元素周期性 1基本内容 核外电子运动状态,核外电子排布,元素周期律 2教学基本要求: 熟练掌握:四个量子数的取值规律,核外电子的排布规律,电子排布式和轨道表示式的书 写,周期与能级组、族与原子的电子组态的关系。 掌握:四个量子数的概念和物理意义,多电子原子的能级,元素周期表和周期表中元素的 22
22 难点:反应速率的基本理论(碰撞理论,过渡状态理论)及活化能;用 Arrhenius 经验公式进 行有关的计算。 4.教学建议: 理论与实践相结合,多媒体与版书相结合。 第七章:氧化还原反应 1.基本内容: 氧化还原反应基本概念,电池和电池电动势,电极和电极电势。 2.教学基本要求: 熟练掌握:电池电动势与电池反应的自由能变化的关系,标准电动势与电池反应的标准平 衡常数的关系,电极电势,电极和电池的能斯特方程,应用电极电势和电动势判断氧化剂还原 剂相对强弱、判断反应方向、计算标准平衡常数。 掌握:影响电极电势的因素。 了解:原电池的组成和电池组成式的书写,电极电势和电动势产生机理,电极的分类,电 位法测溶液 pH 的原理和方法。 3.教学重点难点: 重点:氧化还原反应的基本概念,氧化还原方程式配平,原电池的表达方式;应用电极电 位表讨论元素不同氧化态下的氧化还原性的强弱;判断氧化还原反应的方向及平衡常数的计算; Nernst 方程的应用,判断标准态下和非标准状态下氧化还原反应的方向;应用标准电极电位计 算平衡常数。 难点:原电池的表达方式,Nernst 方程的应用,判断标准态下和非标准状态下氧化还原反 应的方向;应用标准电极电位计算平衡常数。 4.教学建议: 理论与实践相结合,多媒体与版书相结合。 第八章:原子结构与元素周期性 1.基本内容: 核外电子运动状态,核外电子排布,元素周期律。 2.教学基本要求: 熟练掌握:四个量子数的取值规律,核外电子的排布规律,电子排布式和轨道表示式的书 写,周期与能级组、族与原子的电子组态的关系。 掌握:四个量子数的概念和物理意义,多电子原子的能级,元素周期表和周期表中元素的

分区。 了解:电子的波粒二象性、电子波动方程、波函数和原子轨道、电子云、波函数的角度分 布和径向分布、电子几率密度和电子云,原子半径、元素电负性等元素性质的周期性变化规律 及与原子结构的关系。 3.教学重点难点: 重点:波函数,原子轨道,电子云的概论:描述核外电子运动状态的四个量子数的物理意 义及相应的合理取值:5P原子轨道角度部分及电子云的图形:多电子原子核外电子排布规律 轨道近似能级图,电子排布式和轨道式的书写:元素周期表,元素基本性质的周期性变化规律, 难点:波函数,原子轨道,电子云的概论:描述核外电子运动状态的四个量子数的物理意 义及相应的合理取值。 4,教学建议: 理论与实践相结合,多媒体与版书相结合。 第九章:分子结构与分子性质 1基本内容: 共价健,分子间作用力。 2教学基本要求: 熟练掌握:杂化轨道理论的要点并应用于说明分子的空间构型。 掌握:现代价健理论要点、共价键的本质和特性、共价健的类型、配位键、键参数,分子 的极性和分子的极化对分子间作用力的影响,取向力、诱导力、色散力和氢键,范德华力和氢 键对物质性质的影响。 了解:价层电子对互斥理论和分子轨道理论,分子间作用力产生的原因。 3.教学重点难点: 重点:共价健的特点及本质以及它们的形成过程:共价键的类型(σ健、π键),配位共价健: 现代价键理论、杂化轨道理论的基本要点及其应用:s即、s即、s即杂化轨道类型:分子间力(取 向力、诱导力、色散),氢键及对物理性质的影响。 难点:杂化轨道理论。 4教学建议: 理论与实践相结合,多媒体与版书相结合。 第十章:配合物结构与性质 1基本内容: 23
23 分区。 了解:电子的波粒二象性、电子波动方程、波函数和原子轨道、电子云、波函数的角度分 布和径向分布、电子几率密度和电子云,原子半径、元素电负性等元素性质的周期性变化规律 及与原子结构的关系。 3.教学重点难点: 重点:波函数,原子轨道,电子云的概论;描述核外电子运动状态的四个量子数的物理意 义及相应的合理取值;s、p 原子轨道角度部分及电子云的图形;多电子原子核外电子排布规律, 轨道近似能级图,电子排布式和轨道式的书写;元素周期表,元素基本性质的周期性变化规律。 难点:波函数,原子轨道,电子云的概论;描述核外电子运动状态的四个量子数的物理意 义及相应的合理取值。 4.教学建议: 理论与实践相结合,多媒体与版书相结合。 第九章:分子结构与分子性质 1.基本内容: 共价键,分子间作用力。 2.教学基本要求: 熟练掌握:杂化轨道理论的要点并应用于说明分子的空间构型。 掌握:现代价健理论要点、共价键的本质和特性、共价健的类型、配位键、键参数,分子 的极性和分子的极化对分子间作用力的影响,取向力、诱导力、色散力和氢键,范德华力和氢 键对物质性质的影响。 了解:价层电子对互斥理论和分子轨道理论,分子间作用力产生的原因。 3.教学重点难点: 重点:共价键的特点及本质以及它们的形成过程;共价键的类型(σ 键、π 键),配位共价键; 现代价键理论、杂化轨道理论的基本要点及其应用;sp、sp2、sp3 杂化轨道类型;分子间力(取 向力、诱导力、色散力) ,氢键及对物理性质的影响。 难点:杂化轨道理论。 4.教学建议: 理论与实践相结合,多媒体与版书相结合。 第十章:配合物结构与性质 1.基本内容:

配合物基本概念和化学键理论,配位平衡,整合物。 2.教学基本要求: 熟练掌握:配合物的概念、组成、命名,配合物的价键理论,应用价键理论说明配合物的 空间构型,配位平衡和稳定常数表达式,影响配位平衡的因素和配位平衡的移动, 掌握:内轨型和外轨型配合物,应用稳定常数进行计算。 了解:配合物的晶体场理论,整合物的概念、结构、性质。 3.教学重点难点: 重点:配合物的组成和命名方法;配合物的价键理论与应用:配合平衡的基本概念:影响 配合物稳定性和配位平衡移动的主要因素。 难点:配合物的价键理论及其应用:配位平衡的计算。 4.教学建议: 理论与实践相结合,多媒体与版书相结合。 第十一章:滴定分析基础 1基本内容: 滴定分析一般概念,酸碱滴定,误差与有效数字。 2教学基本要求: 熟练掌握:酸碱指示剂变色原理和变色范围,酸碱滴定结果的计算。 掌握:滴定突跃范围和酸碱指示剂的选择原则,酸碱标准溶液的配制和标定,有效数字的 概念及其运算规则。 了解:分析化学的分类和滴定分析的有关术语,滴定反应条件、滴定分析一般计算方法, 各类滴定曲线的特点,测定误差和偏差的概念、表示法及其计算,误差的来源及其消除措施, 配位滴定,氧化还原滴定,沉淀滴定。 3教学重点难点: 重点:酸碱指示剂的变色原理、变色范围及选择原则:一元弱酸、弱碱准确滴定的条件: 酸碱标准溶液的配制、标定:滴定分析的计算。 难点:滴定曲线及影响突跃的原因,分析结果的误差来源及减免误差的方法。 4.敦学建议: 理论与实践相结合,多媒体与版书相结合。 第十二章:仪器分析基础 1.基本内容: 24
24 配合物基本概念和化学键理论,配位平衡,螯合物。 2.教学基本要求: 熟练掌握:配合物的概念、组成、命名,配合物的价键理论,应用价键理论说明配合物的 空间构型,配位平衡和稳定常数表达式,影响配位平衡的因素和配位平衡的移动。 掌握:内轨型和外轨型配合物,应用稳定常数进行计算。 了解:配合物的晶体场理论,螯合物的概念、结构、性质。 3.教学重点难点: 重点:配合物的组成和命名方法;配合物的价键理论与应用;配合平衡的基本概念;影响 配合物稳定性和配位平衡移动的主要因素。 难点:配合物的价键理论及其应用;配位平衡的计算。 4.教学建议: 理论与实践相结合,多媒体与版书相结合。 第十一章:滴定分析基础 1.基本内容: 滴定分析一般概念,酸碱滴定,误差与有效数字。 2.教学基本要求: 熟练掌握:酸碱指示剂变色原理和变色范围,酸碱滴定结果的计算。 掌握:滴定突跃范围和酸碱指示剂的选择原则,酸碱标准溶液的配制和标定,有效数字的 概念及其运算规则。 了解:分析化学的分类和滴定分析的有关术语,滴定反应条件、滴定分析一般计算方法, 各类滴定曲线的特点,测定误差和偏差的概念、表示法及其计算,误差的来源及其消除措施, 配位滴定,氧化还原滴定,沉淀滴定。 3.教学重点难点: 重点:酸碱指示剂的变色原理、变色范围及选择原则;一元弱酸、弱碱准确滴定的条件; 酸碱标准溶液的配制、标定;滴定分析的计算。 难点:滴定曲线及影响突跃的原因,分析结果的误差来源及减免误差的方法。 4.教学建议: 理论与实践相结合,多媒体与版书相结合。 第十二章:仪器分析基础 1.基本内容:
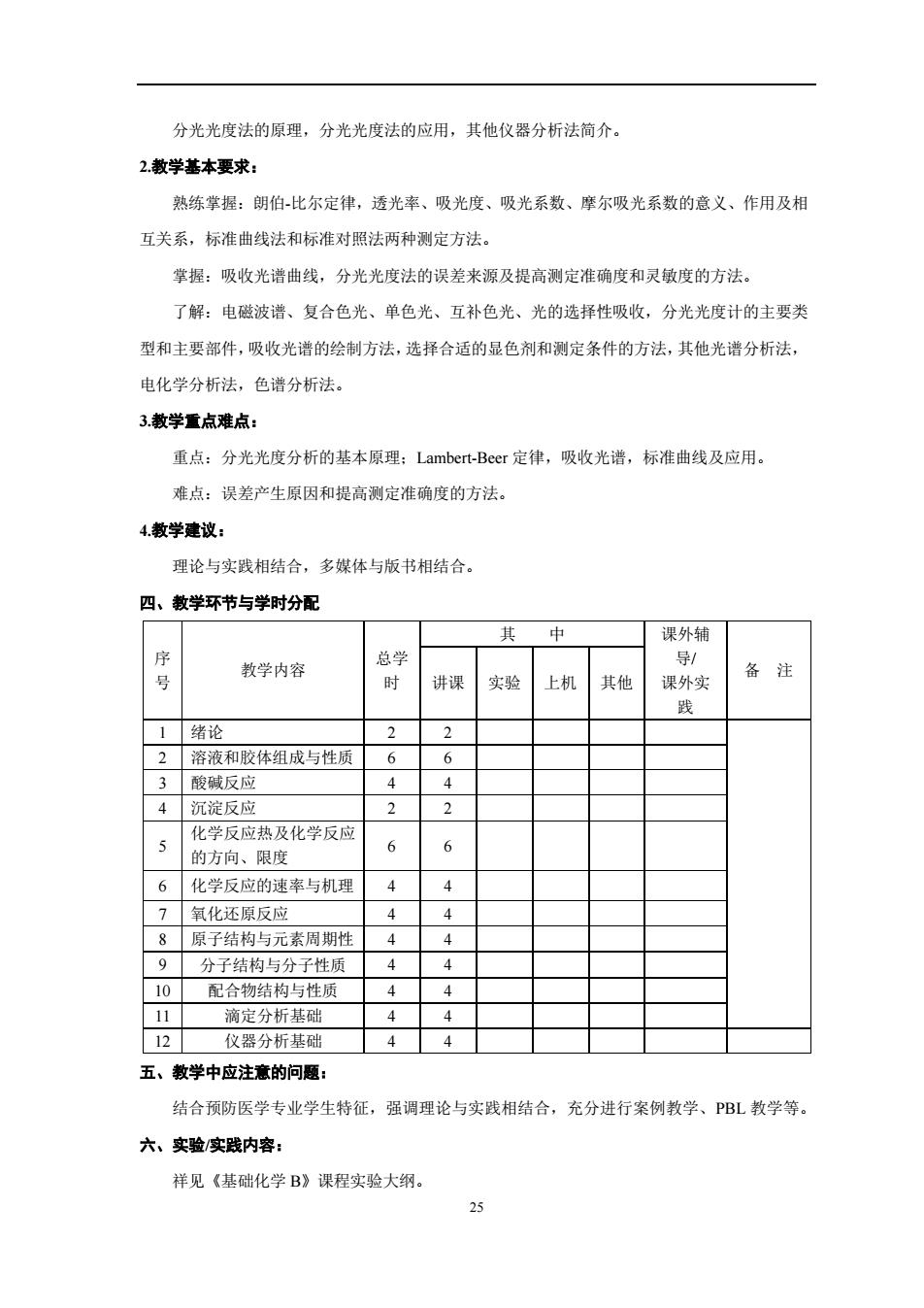
分光光度法的原理,分光光度法的应用,其他仪器分析法简介 2教学基本要求: 熟练掌握:朗伯比尔定律,透光率、吸光度、吸光系数、摩尔吸光系数的意义、作用及相 互关系,标准曲线法和标准对照法两种测定方法。 掌握:吸收光谱曲线,分光光度法的误差来源及提高测定准确度和灵敏度的方法。 了解:电磁波谱、复合色光、单色光、互补色光、光的选择性吸收,分光光度计的主要类 型和主要部件,吸收光谱的绘制方法,选择合适的显色剂和测定条件的方法,其他光谱分析法, 电化学分析法,色谱分析法。 3教学重点难点: 重点:分光光度分析的基本原理:Lambert-Beer定律,吸收光谱,标准曲线及应用。 难点:误差产生原因和提高测定准确度的方法。 4.教学建议: 理论与实践相结合,多媒体与版书相结合。 四、教学环节与学时分配 其 中 课外辅 总学 县/ 号 教学内容 讲课 实验 上机 其他 课外实 备注 1绪论 2 2溶液和胶体组成与性质 6 6 3酸碱反应 4 沉淀反应 2 2 化学反应热及化学反应 5 6 6 的方向、限度 6 化学反应的速率与机理 4 4 7 氧化还原反应 4 原子结构与元素周期性 9分子结构与分子性质44 10配合物结构与性质 44 11 滴定分析基础 4 4 12 仪器分析基础 44 五、教学中应注意的问题: 结合预防医学专业学生特征,强调理论与实践相结合,充分进行案例教学、PBL教学等。 六、实验实践内容: 祥见《基础化学B》课程实验大纲。 25
25 分光光度法的原理,分光光度法的应用,其他仪器分析法简介。 2.教学基本要求: 熟练掌握:朗伯-比尔定律,透光率、吸光度、吸光系数、摩尔吸光系数的意义、作用及相 互关系,标准曲线法和标准对照法两种测定方法。 掌握:吸收光谱曲线,分光光度法的误差来源及提高测定准确度和灵敏度的方法。 了解:电磁波谱、复合色光、单色光、互补色光、光的选择性吸收,分光光度计的主要类 型和主要部件,吸收光谱的绘制方法,选择合适的显色剂和测定条件的方法,其他光谱分析法, 电化学分析法,色谱分析法。 3.教学重点难点: 重点:分光光度分析的基本原理;Lambert-Beer 定律,吸收光谱,标准曲线及应用。 难点:误差产生原因和提高测定准确度的方法。 4.教学建议: 理论与实践相结合,多媒体与版书相结合。 四、教学环节与学时分配 序 号 教学内容 总学 时 其 中 课外辅 导/ 课外实 践 备 注 讲课 实验 上机 其他 1 绪论 2 2 2 溶液和胶体组成与性质 6 6 3 酸碱反应 4 4 4 沉淀反应 2 2 5 化学反应热及化学反应 的方向、限度 6 6 6 化学反应的速率与机理 4 4 7 氧化还原反应 4 4 8 原子结构与元素周期性 4 4 9 分子结构与分子性质 4 4 10 配合物结构与性质 4 4 11 滴定分析基础 4 4 12 仪器分析基础 4 4 五、教学中应注意的问题: 结合预防医学专业学生特征,强调理论与实践相结合,充分进行案例教学、PBL 教学等。 六、实验/实践内容: 祥见《基础化学 B》课程实验大纲