
区化学反应速率和限度反应速率与碰撞频率Z,分子有效碰撞分数f,以及方位因子p有关一般化学反应的活化能约在40~400kj.mol-1之间多数化学反应的活化能约在60~250kj.mol-1之间反应的活化能小于40kj.mol-1时,反应速度很快反应的活化能大于400kj.mol-1时,反应速度很慢中和化学反应的活化能约在13~25kj.mol-1之间
化学反应速率和限度 反应速率与碰撞频率Z,分子有效碰撞分数f,以 及方位因子p有关 一般化学反应的活化能约在40~400 kj.mol-1之间 多数化学反应的活化能约在60~250 kj.mol-1之间 反应的活化能小于 40 kj.mol-1时,反应速度很快 反应的活化能大于 400 kj.mol-1时,反应速度很慢 中和化学反应的活化能约在13~25 kj.mol-1之间

区化学反应速率和限度例 NO2(g) + Fz (g) → 2NO,F (g)慢反应)反应机理:①NO,+F,→NO,F+F(快反应)② F + NO, === NO,F反应速率有第①步反应决定。气体反应速率取决于三种因素:反应速率=正确取向的碰撞分数(p)×具有足够动能的碰撞分数()×气体分子碰撞频率(Z)V=P×f ×ZAl
化学反应速率和限度 例 NO2 (g) + F2 (g) → 2NO2F (g) 反应机理:①NO2 + F2 → NO2F + F (慢反应) ② F + NO2 === NO2F (快反应) 反应速率有第①步反应决定。 反应速率=正确取向的碰撞分数(p) 具有足够 动能 的碰撞分数(f ) 气体分子碰撞频率(Z) ZAB v = P f 气体反应速率取决于三种因素:

区化学反应速率和限度(2):过渡状态理论化学反应并非只经过简单的碰撞就能完成,而是在反应过程中要经过一个中间的过渡状态,先形成活化配合物活化配合物极不稳定,一经形成便会分解,或分解为反应物,或分为生成物;
化学反应速率和限度 (2).过渡状态理论 化学反应并非只经过简单的碰撞就能完 成,而是在反应过程中要经过一个中间的 过渡状态,先形成活化配合物。 活化配合物极不稳定,一经形成便 会分解,或分解为反应物,或分为生 成物;
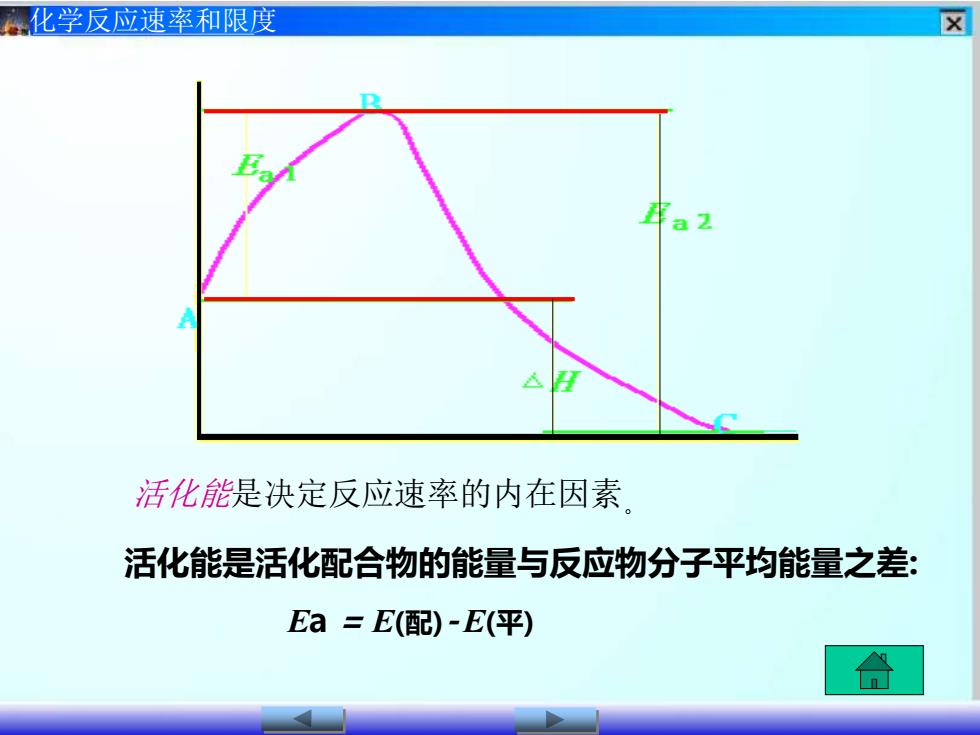
区化学反应速率和限度活化能是决定反应速率的内在因素活化能是活化配合物的能量与反应物分子平均能量之差Ea=E(配)-E(平)
化学反应速率和限度 活化能是决定反应速率的内在因素。 活化能是活化配合物的能量与反应物分子平均能量之差: Ea = E(配)-E(平)

化学反应速率和限度区第二节影响反应速率的因素内因:反应的活化能外因:浓度、温度、催化剂浓度对化学反应速率的影响一、>1。(基)元反应:对于简单反应,反应物分子在有效碰撞中经过一次化学变化就能转化为产物的反应。:可由质量作用2.(基)元反应的化学反应速率方程式:定律描述
化学反应速率和限度 一、浓度对化学反应速率的影响 1.(基)元反应:对于简单反应,反应物分子在有效碰 撞中经过一次化学变化就能转化为产物的反应。 2.(基)元反应的化学反应速率方程式:可由质量作用 定律描述。 第二节 影响反应速率的因素 内因:反应的活化能 外因:浓度、温度、催化剂