
区化学反应速率和限度化学反应速率理论1、化学反应历程(机理)一个化学反应,在一定条件下,反应物变成生成物实际经过的途径基元反应:在反应中反应物分子直接转化成生成物的反应一简单反应复杂反应:在反应中反应物分子经过多步才转化成生成物的反应--非基元反应
化学反应速率和限度 二、化学反应速率理论 1、化学反应历程(机理) 一个化学反应,在一定条件下,反应物变成生 成物实际经过的途径 基元反应:在反应中反应物分子直接转化成生成物 的反应—简单反应 复杂反应:在反应中反应物分子经过多步才转化成生 成物的反应-非基元反应

区化学反应速率和限度基元反应CO(g) + NO2(g) = CO2(g) + NO(g)非基元反应H2(g) + I2(g) = 2HI(g)快明I2(g) =2 I(g)慢H2(g) + 2I(g) = 2HI(g)
化学反应速率和限度 CO(g) + NO2 (g) = CO2 (g) + NO(g) 基元反应 非基元反应 H2 (g) + I2 (g) = 2HI(g) I2 (g) =2 I(g) 快 H2 (g) + 2I(g) = 2HI(g) 慢

化学反应速率和限度X2、化学反应速率理论(1)有效碰撞理论化学反应发生的必要条件是反应物分子(或原子、离子)间的碰撞。只有极少数活化分子的碰撞才能发生化学反应,称“有效碰撞”;活化分子是反应物分子中能量较高的分子,其比例很小;
化学反应速率和限度 2、化学反应速率理论 化学反应发生的必要条件是反应物分 子(或原子、离子)间的碰撞。 只有极少数活化分子的碰撞才能发生化学 反应,称“有效碰撞”;活化分子是反应物 分子中能量较高的分子,其比例很小; (1)有效碰撞理论
化学反应速率和限度X理论要点:※有效碰撞:能发生反应的碰撞※活化分子:具有较大的动能并且能发生有效碰撞的分子※活化能:活化分子所具有的最低能量与反应物分子的平均能量之差※其他条件相同时,活化能越低的化学反应,反应速率越高
化学反应速率和限度 理论要点: ※有效碰撞:能发生反应的碰撞 ※活化分子:具有较大的动能并且能发生 有效碰撞的分子 ※活化能:活化分子所具有的最低能量与 反应物分子的平均能量之差 ※其他条件相同时,活化能越低的化学反 应,反应速率越高
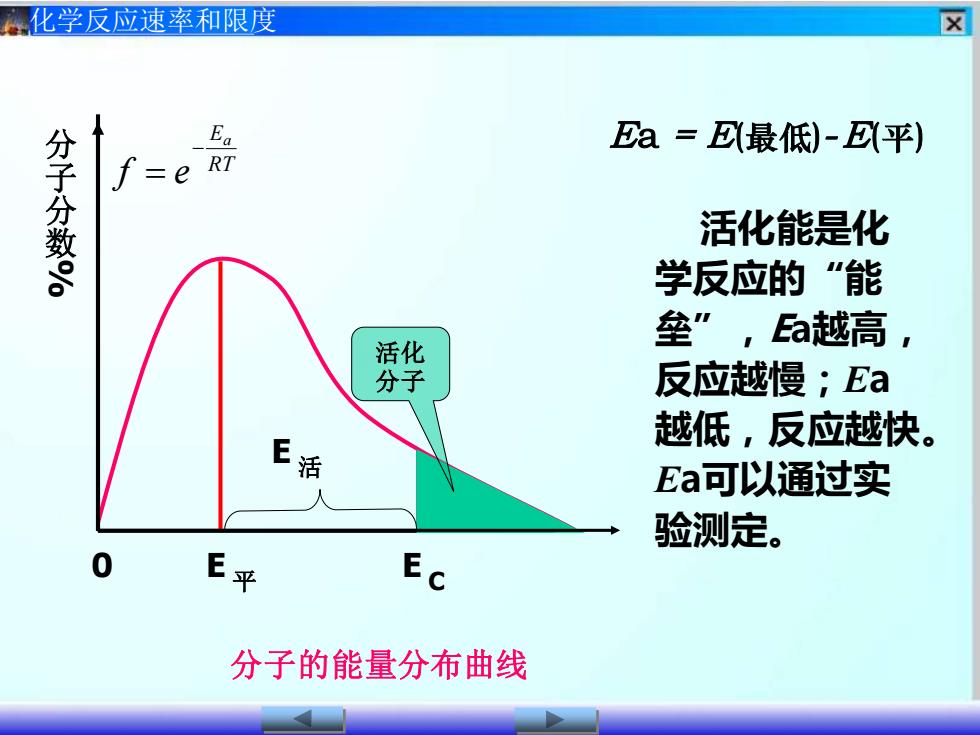
区化学反应速率和限度EaEa =E(最低)-E(平)分子分数%RTf=e活化能是化学反应的“能垒”,Ea越高,活化反应越慢;Ea分子越低,反应越快,E活Ea可以通过实人验测定。0EE平C分子的能量分布曲线
化学反应速率和限度 平 E C E 活 E 分 子 分 数 % 分子的能量分布曲线 0 Ea = E(最低)-E(平) 活化能是化 学反应的“能 垒” ,Ea越高, 反应越慢;Ea 越低,反应越快。 Ea可以通过实 验测定。 RT Ea f e − = 活化 分子