
化学反应自由能的计算 a.利用化学反应平衡常数计算 基本公式:△G'=△G°′+RTInQc(Qc-浓度商) △G°'=-RTlnKeq 例:计算磷酸葡萄糖异构酶反应的自由能变化 b.利用标准氧化还原电位(E°)计算(限于氧化还原反应) 基本公式:△G°′=一nFAE°' (△E°’=E+°′-E°’) 例:计算NADH氧化反应的△G°
化学反应自由能的计算 a.利用化学反应平衡常数计算 基本公式:ΔG′=ΔG°′+ RTlnQc (Qc-浓度商) ΔG°′= - RTlnKeq 例:计算磷酸葡萄糖异构酶反应的自由能变化 b.利用标准氧化还原电位(E°)计算(限于氧化还 原反应) 基本公式:ΔG°′=-nFΔE°′ (ΔE°′=E+ °′-E-°′) 例:计算NADH氧化反应的ΔG°′

计算磷酸葡萄糖异构酶反应的自由能变化 例题:反应G1-PG-6-P在38C达到平衡时,G-1-P占 5%,G-6-P占95%,求G'。如果反应未达到平 衡,设[G-1-P=0.01mol.L,[G6-P]=0.001mol.L, 求反应的G是多少? 解:达平衡时 [G-6P]=Keq-19 [G-1-P] △G°'=-RT1nKeq =-2.303×8.314×311×1og19 =-7.6KJ.mo-1 [G-6-P] 未达平衡时 [G1-P] =Qc=0.1 △G′=△G°′+RT1nQc(Qc-浓度商) =-7.6+2.303×8.314×311×1og0.1 =-13.6KJ.M0L-1
计算磷酸葡萄糖异构酶反应的自由能变化 解:达平衡时 =Keq=19 ΔG°′= - RTlnKeq =-2.3038.314 311 log19 =-7.6KJ.mol-1 ΔG′=ΔG°′+ RTlnQc (Qc-浓度商) =-7.6+ 2.3038.314 311 log0.1 =-13.6KJ.MOL-1 未达平衡时 =Qc=0.1 反应G-1-PG-6-P在380C达到平衡时,G-1-P占 5%,G-6-P占95%,求 G0 。如果反应未达到平 衡,设[G-1- P]=0.01mol.L, [G-6-P]=0.001mol.L, 求反应的 G是多少? 例题:

例题:计算下反应式△G° NADH+H++1/202-NAD++H2O 正极反应:1/202+2H+2e=H20 E+°′=0.82 负极反应:NAD+Ht+2e=NADH E。= -0.3 △G°′=-nF△E°/ -2×96485×[0.82-(-0.32)] =-220KJmo1-1
例题:计算下反应式ΔG°′ NADH+H++1/2O2====NAD++H2O 正极反应:1/2O2+2H++2e = H2O E +°′= 0.82 负极反应:NAD++H++2e = NADH E -°′= -0.3 ΔG°′=-nFΔE°′ = -2×96485×[0.82-(-0.32)] = -220 KJ·mol-1
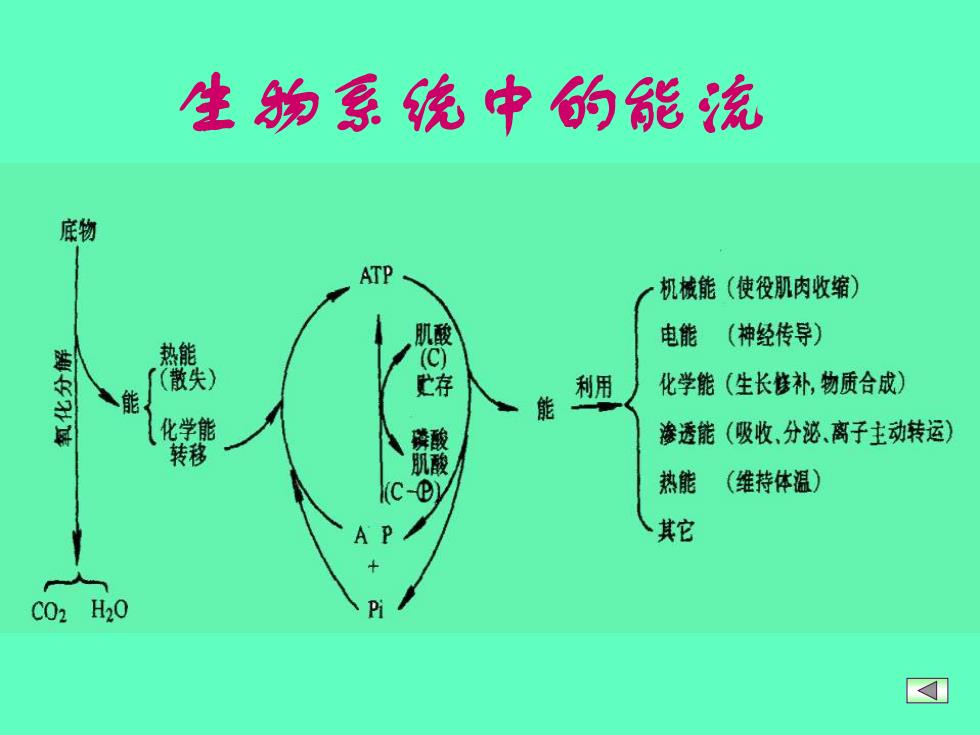
生如系统中的能流 底物 ATP 机核能(使役肌肉收缩) 电能 (神经传导) 热能 散失 利用 化学能(生长修补,物质合成) 能 化学能 渗透能(吸收、分泌、离子主动转运) 转移 热能 (维持体温) A 其它 C02H20 Pi ]
生物系统中的能流

《太 阳) 《光 能) 光 《电 德) 白 合 非 作 ATP 细 用 胞 ↓ 《化学能) 合成 ↓ (CH:O) CO 分解 H红O 《化学 电子传漫 《电 能) ADP ATP 个 《化 学能) 生 物合成 生命现象 机 功 主 动 运输 生物 发光 生 物发 生 图7一 生物界的能里传递及转化总过程