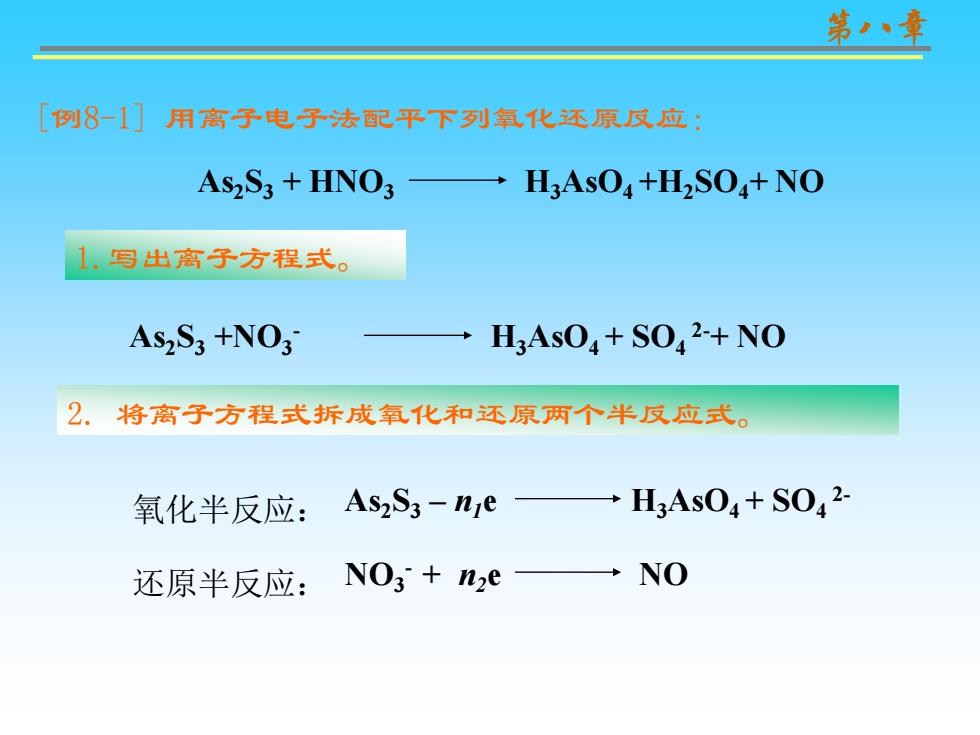
第章 [例81]用高子电子法配平下列氧化还原文应: As2S3 HNO →H3AsO4+HS0,+NO 1.写出高子方程式。 As2S3 +NO3 HAsO+SO2-+NO 2.将离子方程式拆成氧化和还原两个半反应式。 氧化半反应:AsS3-ne H3As04+S042 还原半反应:NO+2e一NO
第八章 1.写出离子方程式。 2. 将离子方程式拆成氧化和还原两个半反应式。 [例8-1] 用离子电子法配平下列氧化还原反应: 氧化半反应: As2S3 – n1e H3AsO4 + SO4 2- 还原半反应: NO3 - + n2e NO As2S3 + HNO3 H3AsO4 +H2SO4+ NO As2S3 +NO3 - H3AsO4 + SO4 2-+ NO

第章 3。配平半成应, 将箭头号改为等号。 氧化半反应:As2S3+20H20-28e2H3As04+3S042-+34H+① 还原半反应: N03+4H+3e= N0+2H20 ② 4。根据得失电子的最小公倍数,合并成一个方程式。 ①X33As2S3+60H20-84e =6H3As04+9S042. +102H+ ① +②X2828N03+112H+84e 28N0+56H20 ② 3As2S3+28N03+10H+4H20= 6H3As04+9S042-+28N0
第八章 3. 配平半反应,将箭头号改为等号。 氧化半反应: 2H3AsO4 + 3SO4 2- As2S3 +20H2O– 28e +34H+ 还原半反应: NO3 - + 4H++ 3e NO +2H2O 4. 根据得失电子的最小公倍数,合并成一个方程式。 ×3 6H3AsO4 + 9SO4 2- +102H+ 3As2S3 +60H2O– 84e + ×2828NO3 - + 112H++ 84e 28NO +56H2O 3As2S3 +28 NO3 - +10H++4H2O 6H3AsO4 +9SO4 2-+ 28NO

第章 5.将配平的离子方程式写为分子方程式。 3AsS3+28HN03+4H20=6H3As04+9H2S04+28N0
第八章 5.将配平的离子方程式写为分子方程式。 3As2S3 +28 HNO3 +4H2O 6H3AsO4 +9H2SO4+ 28NO
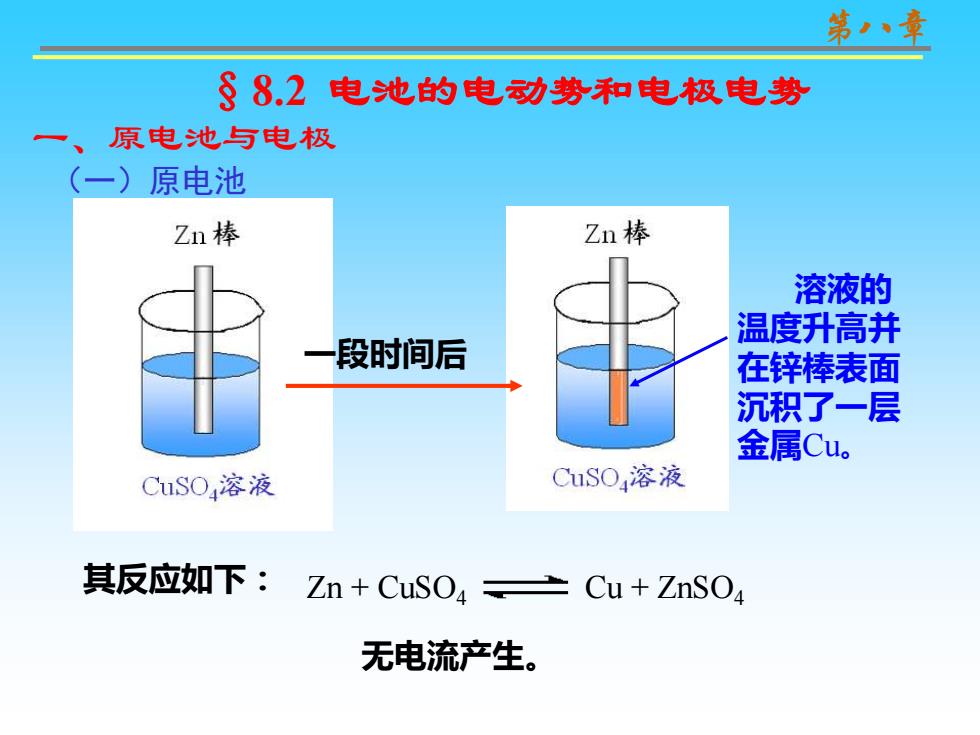
§8,2电池的电动势和电极电势 原电池与电极 一)原电池 Zn棒 Zn棒 溶液的 温度升高并 段时间后 在锌棒表面 沉积了一层 金属Cu。 C1SO,溶液 CuSO,溶液 其反应如下: Zn+CuSO4±Cu+ZnSO4 无电流产生
第八章 (一)原电池 一、原电池与电极 一段时间后 溶液的 温度升高并 在锌棒表面 沉积了一层 金属Cu。 其反应如下: Zn + CuSO4 Cu + ZnSO4 无电流产生。 §8.2 电池的电动势和电极电势
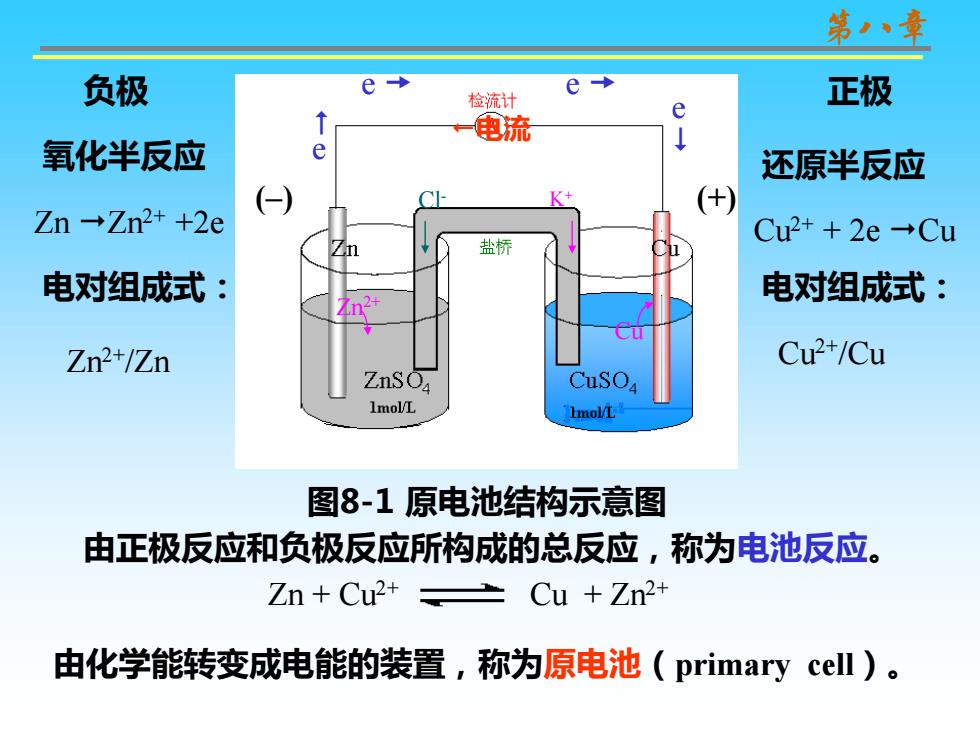
第八章 负极 e e 检流计 正极 e 电流 氧化半反应 还原半反应 Zn→Zn2++2e Cu2++2e→Cu 盐桥 电对组成式: 电对组成式: Zn2+/Zn Cu2+/Cu ZnSO CuSO4 1mol/L ImolL 图8-1原电池结构示意图 由正极反应和负极反应所构成的总反应,称为电池反应。 Zn Cu2+ 上 Cu +Zn2+ 由化学能转变成电能的装置,称为原电池(primary cell)
第八章 图8-1 原电池结构示意图 还原半反应 Cu2+ + 2e Cu 氧化半反应 Zn Zn2+ +2e e e 电流 负极 正极 由正极反应和负极反应所构成的总反应,称为电池反应。 e e Zn2+ Cu 电对组成式: Zn2+/Zn 电对组成式: Cu2+/Cu Cl- K+ (–) (+) 由化学能转变成电能的装置,称为原电池(primary cell)。 Zn + Cu2+ Cu + Zn2+