
第十章 分子结构 第一节 离子键 一、离子键的形成和特点 1、离子键的形成 2Na Cl2 ==2 Na+Cl- 阴、阳离子之间通过静电作用形成的化学键叫离子键 形成条件:两成键原子的电负性差别较大 2、离子键的本质及特点 特点:无方向性,无饱和性 3、晶格能 定义:在标准状态下将1m0l离子晶体转化为气态离子时 所吸收的能量。 NaCl (s)==Na+(g)+Cl(g) U=788kJ.mol-1 用于斯量离子键的强度,晶格能越大,离子键越强
第十章 分子结构 第一节 离子键 一 、离子键的形成和特点 1、离子键的形成 2Na + Cl2 == 2 Na +Cl - 阴、阳离子之间通过静电作用形成的化学键叫离子键 形成条件:两成键原子的电负性差别较大 2、离子键的本质及特点 特点:无方向性,无饱和性 3、晶格能 定义:在标准状态下将1mol离子晶体转化为气态离子时 所吸收的能量。 NaCl(s) == Na +(g) + Cl -(g) U=788kJ·mol -1 用于衡量离子键的强度,晶格能越大,离子键越强

二、离子的电荷、电子构型和半径 (一)离子的电荷 (二)离子的电子构型 1、2电子构型s2 例Lit、Be2+、H 2、8电子构型s2p6 例Na、Ca2+、F-等 3、18电子构型s2pd10 例Ag、Cu2+、Sn4+等 4、18+2电子构型s2p6d10s2 例Bi3+、Pb2+、Sn2+等 5、不规则电子构型spdl-9例Fe3+、Fe2+、Cr3+等 (三)离子半径
二、离子的电荷、电子构型和半径 (一)离子的电荷 (二)离子的电子构型 1、2电子构型 s 2 例Li+ 、Be 2+ 、H- 2、8电子构型 s 2p6 例Na + 、Ca 2+ 、F-等 3、18电子构型 s 2p6d10 例Ag+ 、Cu2+ 、Sn4+等 4、18+2电子构型 s 2p6d10s 2 例Bi 3 + 、Pb2+ 、Sn2+等 5、不规则电子构型 s 2p6d1-9 例Fe 3 + 、Fe 2+ 、Cr 3+等 (三)离子半径

§10.2 共价键 一、经典路易斯学说 同种元素的原子以及电负性相近的原子可以通过共用 电子对形成分子,每一个参与成键的原子都达到8电子的稳 定结构,即八隅律 优点:能解释许多共价化合物的形成,如HC1、H0等 局限性: 1、不能从根本上说明共价键的成因,为什么带负电的两 个电子不排斥而是配对。 2、不能解释BF3PC15、SF6等分子中共价键的形成 3、不能解释分子的一些性质,如02的顺兹性等
§10.2 共价键 一 、经典路易斯学说 同种元素的原子以及电负性相近的原子可以通过共用 电子对形成分子,每一个参与成键的原子都达到8电子的稳 定结构,即八隅律 优点:能解释许多共价化合物的 形成,如HCl、H2O等 1、不能从根本上说明共价键的成因,为什么带负电的两 个电子不排斥而是配对。 局限性: 2、不能解释BF3 PCl5、SF6 等分子中共价键的形成 3、不能解释分子的一些性质,如O2的顺磁性等
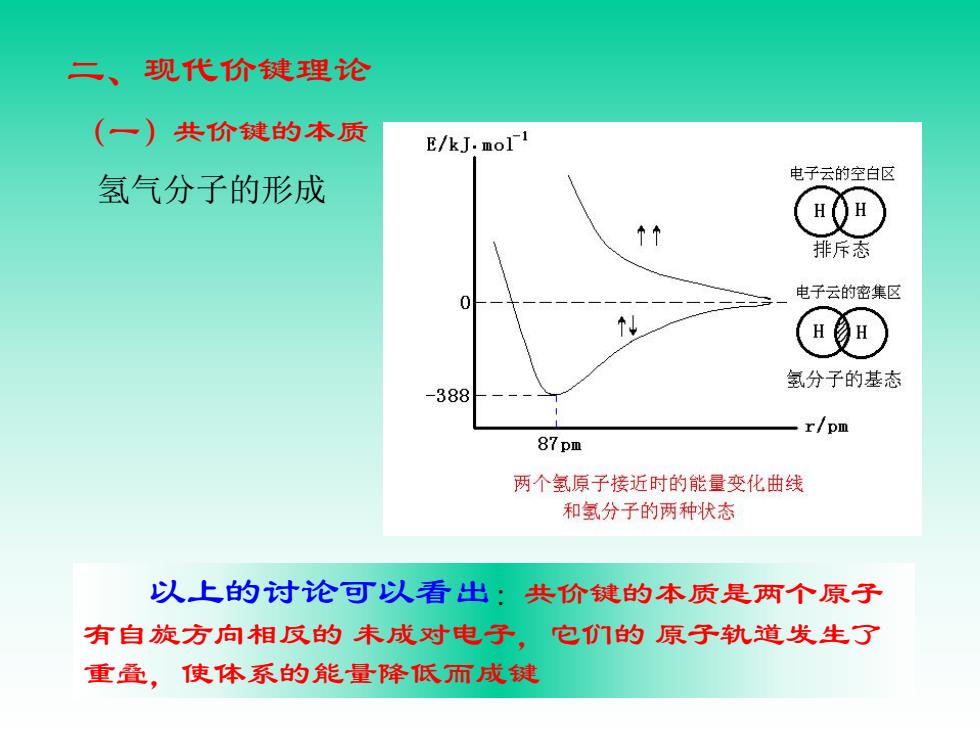
二、现代价键理论 (一)共价键的本质 E/kJ.mol广1 氢气分子的形成 电子云的空白区 HQ▣ 排斥态 电子云的密集区 HH 氢分子的基态 -388 r/pm 87pm 两个氢原子接近时的能量变化曲线 和氢分子的两种状态 以上的讨论可以看出:共价键的本质是两个原子 有自旋方向相反的未成对电子,它们的原子轨道发生了 重叠,使体系的能量降低而成键
二、现代价键理论 (一)共价键的本质 氢气分子的形成 以上的讨论可以看出:共价键的本质是两个原子 有自旋方向相反的 未成对电子,它们的 原子轨道发生了 重叠,使体系的能量降低而成键

共价键的形成条件是: 1.两原子接近时,只有自旋方向相反的单电子可以相 互配对(两原子轨道重叠),使电子云密集于两核之间, 系统能量降低,形成稳定的共价键。 2.成键时,两原子轨道重叠越多,两核间电子云越密 集, 形成的共价键越牢固,这称为原子轨道最大重叠原理。 (二)、共价键的特点 1.共价键的饱和性 自旋方向相反的单电子配对形成共价键后,就不能再和其他 原子中的单电子配对。所以,每个原子所能形成共价键的数目, 取决于该原子中的单电子数目。这就是共价键的饱和性
共价键的形成条件是: 1.两原子接近时,只有自旋方向相反的单电子可以相 互配对(两原子轨道重叠),使电子云密集于两核之间, 系统能量降低,形成稳定的共价键。 2. 成键时,两原子轨道重叠越多,两核间电子云越密 集,形成的共价键越牢固,这称为原子轨道最大重叠原理。 (二)、共价键的特点 1.共价键的饱和性 自旋方向相反的单电子配对形成共价键后,就不能再和其他 原子中的单电子配对。所以,每个原子所能形成共价键的数目, 取决于该原子中的单电子数目。这就是共价键的饱和性