
第7章吸收与蒸馏491 2.3总传质速率方程 总传质速率(N)即相间传质速率,总传质速率方程式是反映吸收过程进 行的快慢的特征量,其推动力是以主体浓度与平衡浓度差为推动力的;对稳定体 系来说,总传质速率等于相内传质速率,原则上,根据式(7-10)和式(7-11) 已可以对传质速率N进行计算。但是,这种做法必须引入界面浓度;而界面浓 度是难以得到的。与传热过程类似,为实用方便,希望能够避开界面浓度,直接 根据汽液两相的主体浓度计算相际传质速率N,下面我们在传质“双膜模型理 论”的基础上讨论总传质速率。 汽相主体 汽液相界面 液相主体 传质方正向 膜边界 图79相际传质 2.3.1总传质速率方程 在吸收过程中,相际传质是由汽相主体至界面的对流传质、界面上溶质组分 的溶解、界面至液相主体的对流传质3个步骤串联而成(参见图7-9)。在吸收塔 某截面汽液两相浓度为y,x(因讨论的是单组分吸收,故xA,yA的下标可省 略),则此3个步骤可根据相内传质方程(7-10a)和(7-11a)及相平衡关系分别 用以下方程式表征 气膜内传质速率 NA=ky (y-yi) (7-10a) 相界面 yi=f (xi) (平衡服从享利定律) yi=mxi 液膜内传质速率 NA=kx (xi-x) (7-11a)

492食品工程原理 式中:y,x为溶质的汽相与液相主体浓度,以摩尔分率表示;y,x;为紧贴界 面两侧汽、液相的溶质浓度,以摩尔分率表示;ky,kx分别为以(y一y)与 (x,-x)为推动力的汽相与液相传质分系数,kmol/(s.m);对稳定吸收体系, 各步传质速率相等即为总传质速率,并将上述速率方程写成 NA=推动力 阻力 尘 NA=y-=Z (7-20) 1 1 为消去界面浓度,将上式右端的分子、分母同乘以m,并根据数学上的合比定 律得 Na=y-+m(i-x)=y-y ,+ ,+双 于是相际传质速率方程式可表示为 NA=Ky (y-3) (7-21) 式中 Ky=1+ 1 (7-22) ky kx 式(7-21)即为总传质速率方程,Ky称为以汽相浓度差(y-y·)为推动 力的总传质系数,kmol/s·m。类似地也可将式(7-20)中每一项的分子、分母 同除以m,便得到 y=2+(x-x)」 N=- nk,+ 1 mky 故相际传质速率方程也可写成 NA=Kx(x-x) (7-21a) 式中K.,+安 1 (7-22a)

第7章吸收与蒸馏493 Kx称为以汽相浓度差(x·-x)为推动力的总传质系数,kmol/(s·m)。 比较式(7-22)和(7-22a)可知 mKy=Kx (7-23) 同理若以汽相分压和液相体积浓度为推动力的相际传质速率方程也可写成 NA=KG (p-*) (7-24) NA=KL (c*-c) (7-24a) 式中 点。=品+成 1 (7-25) 底是+ (7-25a) KG=HKL (7-26) 参照图7-7(b)不难导出解吸的速率方程为 NA=Ky (y*-y) (7-27) 或Na=Kx(x-x) (7-27a) 式中的总传质系数Kx,Ky与式(7-22)、(7-22a)相同,比较可得吸收与解吸 过程的推动力刚好相反。 与相内传质方程式一样,浓度的表示方法不同,其总传质速率方程式有不同 形式;所应用的亨利定律形式也不同,各传质系数的定义和相互关系也各不相 同。为此将传质速率方程的各种表示形式及传质系数的相互关系列于表76中, 以供参考。这些公式看起来繁多复杂,但只要把握住各自定义,按上述过程进行 分析、对比后,并不难掌握。一般用Ky,Kx的形式在吸收计算中用得多,而 KG,KL的形式则在实验测定等获取传质系数时用得多。 2.3.2传质阻力 式(7-21)可写成 Na=Ky(y-y)=yy=总推动力 1 总阻力 Ky 则与传热速率公式中总传热系数类似,1/K,即为传质总阻力,结合式(7-22)
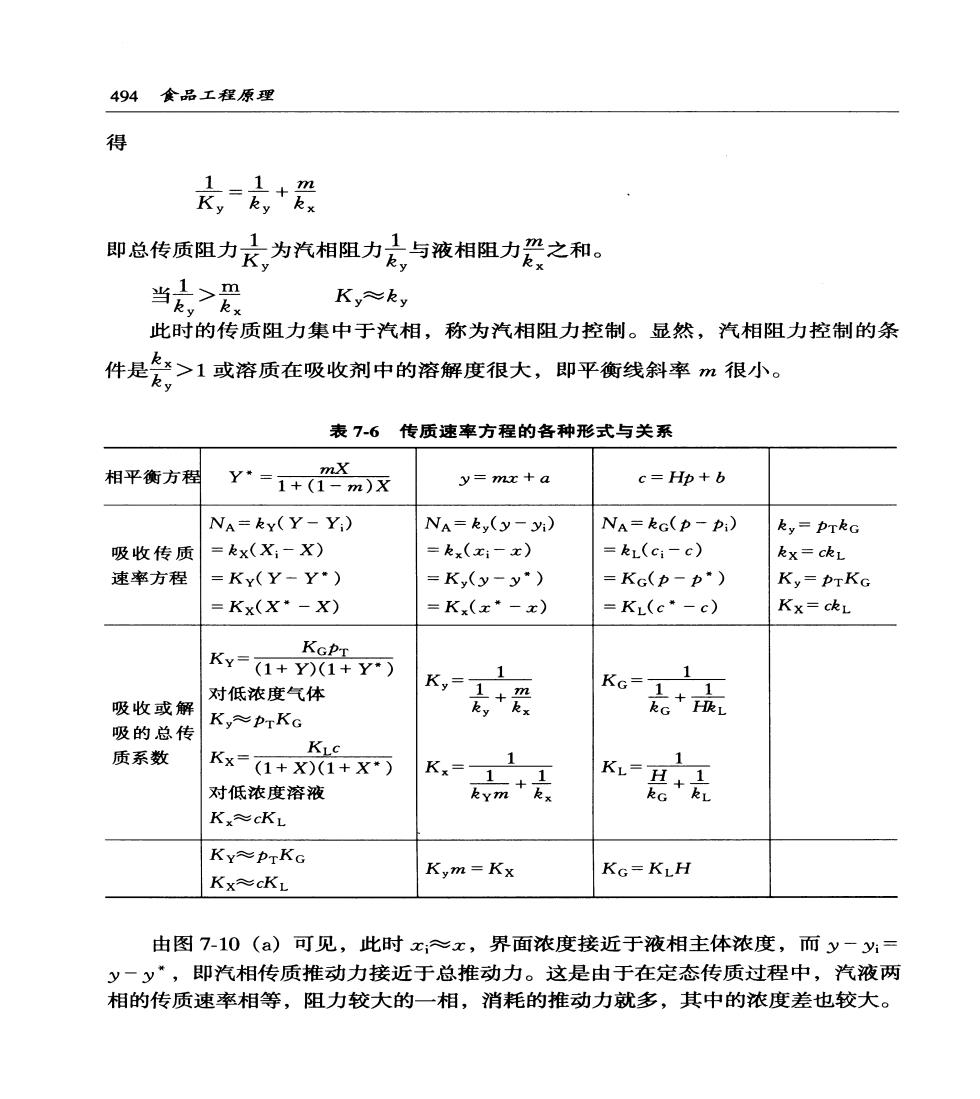
494食品工程原理 得 京名,+ 即总传质阻力尺为汽相阻力太,与液相阻力爱之和。 当,> Ky≈ky 此时的传质阻力集中于汽相,称为汽相阻力控制。显然,汽相阻力控制的条 件是冬,>1或溶质在吸收剂中的溶解度很大,即平衡线斜率m很小。 表7-6 传质速率方程的各种形式与关系 相平衡方程 -m)x y=mx+a c=Hp+b NA=ky(Y-Yi) NA=ky(y-yi) NA=kG(p-Pi) ky=PTkG 吸收传质 =kx(Xi-X) =kx(xi-x) =kL(ci-c) kx=ckL 速率方程 =Kx(Y-Y) =K,(y-y·) =Kc(p-p”) Ky=PTKG =Kx(X·-X) =K(x*-x) =KL(c·-c) Kx=ckL KGPT K¥=1+y)(1+Y) 1 1 对低浓度气体 K, Ko* 1 吸收或解 吸的总传 Ky≈pTKG 质系数 KL Kx=(1+X)1+X Kx=-1 对低浓度溶液 K是+ K≈cKL Ky≈PTKG Kym=Kx Kx≈cKL KG=KLH 由图7-10()可见,此时x,≈x,界面浓度接近于液相主体浓度,而y一y= y一y”,即汽相传质推动力接近于总推动力。这是由于在定态传质过程中,汽液两 相的传质速率相等,阻力较大的一相,消耗的推动力就多,其中的浓度差也较大

第7幸吸收与蒸馏495 (x.y (x】 (a) (b) 图710吸收传质阻力在两相中的分配 若k,<太,由式(7-2a)可知K≈kx 此时的传质阻力集中于液相,称为液相阻力控制。液相阻力控制的条件为 <1或溶质在吸收剂中的溶解度很大,即平衡线斜率m很大。 ky 由图7-10(b)可见,此时y:≈y,界面浓度接近于汽相主体浓度,而x;-x≈ x”一x,液相传质推动力接近于总推动力。 不难看出,传质总推动力在各传递步骤中的分配情况与传热过程极为相似, 所不同的是,对于吸收过程,汽液平衡关系对各传递步骤阻力的大小及传质总推 动力的分配有着极大的影响。易溶气体溶解度大而平衡线斜率m小,其吸收过 程通常为汽相阻力控制,例如用水吸收H3、便是如此;难溶气体溶解度小而 平衡线斜率m大,其吸收过程多为液相阻力控制,如在通气发酵中,溶解氧的 供给是液相阻力控制的吸收过程。分析清楚阻力控制的分配对如何在吸收操作中 有效采取措施,提高或降低传质速率有着重要的指导依据。 [例7-5]含氨极少的空气于101.33kPa,20℃被水吸收。已知气膜传质 系数kc=3.15×10-6kmol/(m2·skPa),液膜传质系数kL=1.81×10-4kmol/ (m2·s~kmol/m3),溶解度系数H=1.5kmol/(m3.kPa)。汽液平衡关系服从享 利定律。求:①汽相总传质系数KG,KY;液相总传质系数KL,Kx;②气膜与 液膜阻力的相对大小;③若汽相主体氨浓度的摩尔分率为0.03,液相主体浓度 为0.5kmol/m3,求界面浓度。 解:(1)因为物系的汽液平衡关系服从亨利定律,故可由式(7-25)求KG: