
第二节 共价键 ■ 经典共价键理论 现代共价键理论 湖 图 杂化轨道 共价键的属性
第二节 共价键 ▪ 经典共价键理论 ▪ 现代共价键理论 ▪ 杂化轨道 ▪ 共价键的属性
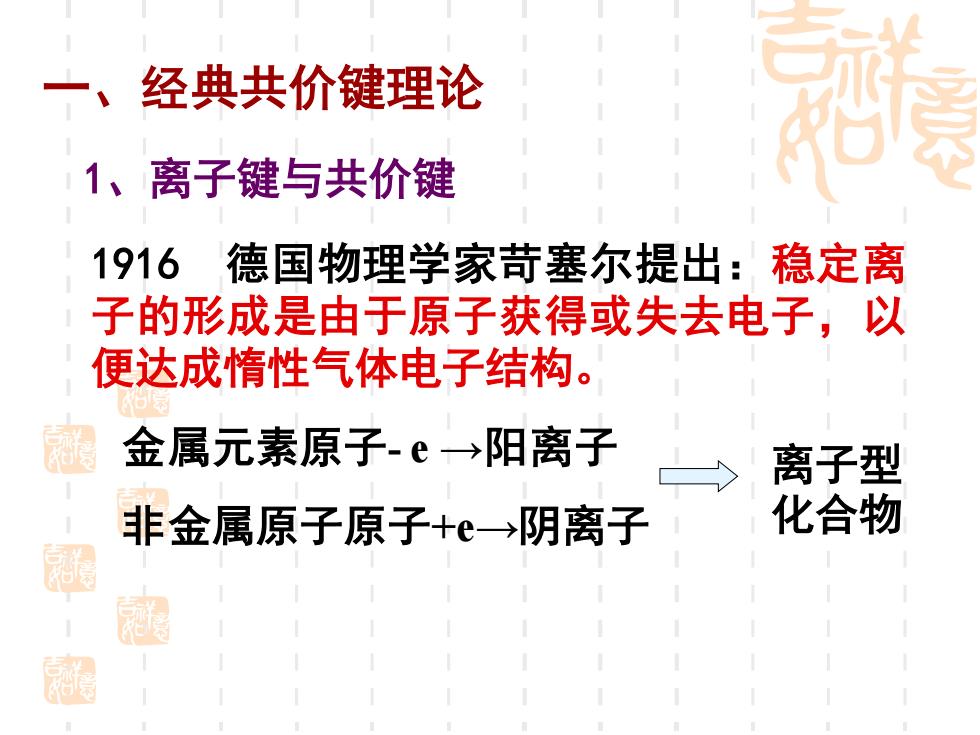
经典共价键理论 1、离子键与共价键 1916德国物理学家苛塞尔提出:稳定离 子的形成是由于原子获得或失去电子,以 便达成惰性气体电子结构。 金属元素原子.e→阳离子 离子型 非金属原子原子+e阴离子 化合物 厨 超
一 、经典共价键理论 1、离子键与共价键 1916 德国物理学家苛塞尔提出:稳定离 子的形成是由于原子获得或失去电子,以 便达成惰性气体电子结构。 金属元素原子- e →阳离子 非金属原子原子+e→阴离子 离子型 化合物

离子键:原子间通过电子转移产生的正负 离子结合而形成的化学键。 Na (1s22s22p63s1)-e >Nat CI (1s22s22p63s23p5)+e>CI Na++C→NaCI
离子键:原子间通过电子转移产生的正负 离子结合而形成的化学键。 Na+ + Cl- → NaCl Na (1s 22s 22p 63s 1 ) - e → Na+ Cl (1s 22s 22p 63s 23p 5 ) + e → Cl-

1916美国化学家Lewis提出共价键电子理论 两个(或多个)原子可以互相“共有” 一对或多对电子,以便达成惰性气体原子的 电子层结构而形成化学键(共价键),形成 稳定的分子(共价化合物) 國 用 超
1916 美国化学家Lewis提出共价键电子理论 两个(或多个)原子可以互相“共有” 一对或多对电子,以便达成惰性气体原子的 电子层结构而形成化学键(共价键),形成 稳定的分子(共价化合物)
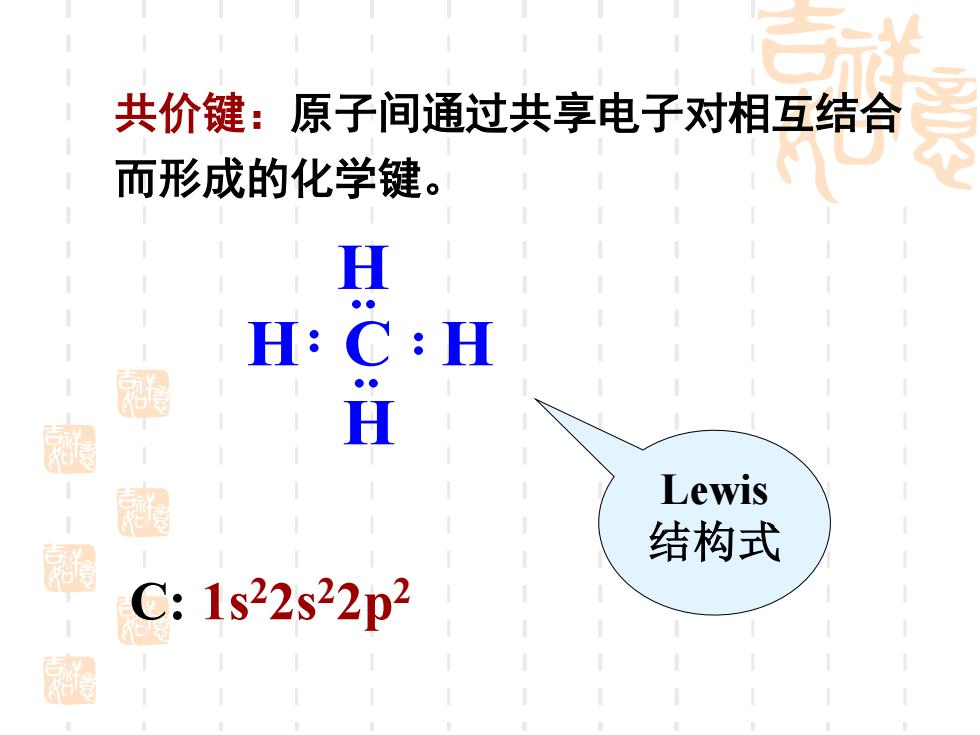
共价键:原子间通过共享电子对相互结合 而形成的化学键。 H H: C:H H Lewis 结构式 C:1s22s22p2 福
共价键:原子间通过共享电子对相互结合 而形成的化学键。 H C H H H Lewis 结构式 C: 1s22s22p2